人牙周膜干细胞成骨分化过程中P2X7受体mRNA的表达特点及作用研究
2021-10-06吴建书汤俊岭
吴建书,汤俊岭
(1.洛阳市第五人民医院口腔科,河南 洛阳 471000;2.河南省口腔医院牙体牙髓科,河南 郑州 450002)
目前,牙周炎的发病率较高,若治疗不当[1],可致牙周组织出现细菌感染,导致牙周软组织损伤或甚至坏死,造成牙槽骨腐蚀[2]。因此,临床治疗牙周炎重要是促使缺损牙槽骨进行再生修复,使得损伤牙周组织恢复原来的生理功能,但传统治疗方式只能机械性修复牙周组织[3],而不能刺激新组织生成及生长。
随着细胞组织工程研究的深入发现牙周膜干细胞(human periodontal ligament stem cells,hPDLS Cs)与牙周组织的稳定生长及缺损后的再生具有密切关系[4],并可诱导牙周膜干细胞定向分化为牙骨细胞。研究证明,细胞外核苷酸受体家族成员P2X7受体可诱导机体分泌细胞因子分泌,对骨细胞和破骨细胞增殖或凋亡产生明显的影响[5],可能参与调控hPDLSCs 向牙骨细胞分化的生理过程。本文选择笔者实验团队制备的牙原代培养hPDLSCs 作为实验材料,选择P2X7对该细胞进行干扰,旨在探讨P2X7受体对hPDLSCs 分化中的影响作用,报告如下。
1 材料与方法
1.1 实验材料 所有牙周膜均来自13~18 岁的健康个体10例,其中男性7例,女性3例,所有个体均有正畸需求而拔掉第一磨牙、第二磨牙和智齿而获得新鲜牙周膜。本次研究符合医学伦理,均与研究对象和其家长签订了知情同意书。
1.2 牙周膜干细胞原代培养方法 收集拔除时间<10min的无龋坏及根尖牙周炎患牙,置于75%酒精消毒后,滴入(羊抗兔及羊抗小鼠二抗,购自中国中杉金桥生物有限公司)双抗的PBS 洗3 次,提取牙根中的牙周膜置入离心管,滴入630U/mlⅠ型胶原酶(美国Gibco 公司)+2.5U/ml Dispase(美国Gibco 公司)后轻晃混匀,37℃下消化反应40 min,取出2000r/min 离心5min,弃上清。滴入培养基机械吹打均匀后,倒入洁净培养瓶内,置于含2mmol/L 谷胺酰胺+100 U/ml 青霉素+100 mg/L 链霉素的α-MEM 培养液后,放入5%CO2恒温培养箱内培养,待传代至90%,收集对数生长期内的第一代牙周膜细胞,调整细胞密度1.0×103/ L~1.5×103/ L,机械吹打制备均匀细胞悬液,将其接种于96 孔培养板内培养12 h,对单个细胞贴壁孔进行标记,补液至200μl,待7d 后换液,倒置显微镜下观察细胞增殖情况,若单孔细胞数≥100,滴入33%~50%后胰酶进行消化,转移12 孔板进行扩大培养。
1.3 牙周膜干细胞细胞表型鉴定方法 选择对数生长期转代3 次牙周膜干细胞,滴入含2%胎牛血清PBS 制备单细胞悬液,调整细胞密度为1×109/L,选取细胞悬液100μl 装入1.5ml EP 管内,放入温水冰浴,于每个EP 管中滴入2μl 1:500 调配人CD34、CD45、CD29、CD105及CD146抗体(美国Sigma 公司提供),对照组滴入Alexa Fluor 标记小鼠IgG(美国Sigma 公司提供),4℃避光下孵育1h,滴入含2%胎牛血清PBS 洗3 次,滴入羊抗小鼠二抗10μl,孵育1h 避光,使用流式细胞仪测定牙周膜干细胞细胞表型。
1.4 实验分组及成骨分化方法 将原代培养获得的牙周膜干细胞细胞分为4 组,⑴A 组-对照组,选择常规培养液处理;⑵B 组-三磷酸腺苷组,滴入100 nmol/L 三磷酸腺苷进行培养;⑶C 组-成骨诱导液组,滴入10%胎牛血清成骨诱导液,含10mol/L地塞米松+10mmol/Lβ-甘油磷酸钠+50mg/L 抗坏血酸;⑷D 组-三磷酸腺苷+成骨诱导液组,滴入100nmol/L 三磷酸腺苷、10%胎牛血清成骨诱导液,分别待培养7d、14d 时,滴入40mmol/L 茜素红,选择25℃染色10min,PBS 洗3 遍,选择倒置显微镜观察+拍照。
1.5 免疫细胞化学染色 将无菌载玻片置于6 孔板中,将密度为1×104/ml的h PDLSCs 滴加于载玻片上,37℃/5%CO2/饱和湿度下培养,6h 后补充液体至2.5ml;培养3d,细胞生长达75%左右时,取出玻片进行免疫细胞化学染色。
1.6 RUNX2、OCN基因表达和P2X7受体mRNA表达测定方法 分光光度仪定量分别测定四组总RNA,提取cDNA,real-time PCR测定RUNX2、OCN基因表达和P2X7受体mRNA表达,检测仪器选取Supcycler PCR 仪,购自澳大利亚昆士兰生物(中国)公司,检测试剂盒购自武汉伊莱瑞特生物科技有限公司。培养细胞至90%融合时静止,收取细胞进行裂解,氯仿抽提后异丙醇沉淀,75%乙醇洗涤采用DECP水溶后抽取2μg 逆转录产物加入PCR master MIX 扩增,条件为95℃预变性10min,95℃变 性20s,58.6℃退 火20s,72℃延 伸20s,30 个循环,从58.6℃与78℃直至99℃进行溶解曲线,片段长度231bp,仪器测定后自动形成荧光阈值。
1.7 统计学方法 数据处理采用SPSS16.0,RUNX2 mRNA、OCN mRNA、P2X7受体mRNA 采用()进行统计学描述,数据的对比采用方差分析和SNK-q 法;P<0.05 为差异具有统计学意义。
2 结果
2.1 牙周膜干细胞原代培养和克隆增殖 牙周膜组织原代培养在3 到5d 后,组织块周围游离出了密集的细胞以及组织块外部稀疏的细胞。镜下观察细胞呈梭形的单层生长,细胞体丰满,细胞浆均匀,细胞核清晰呈卵圆形;原代培养2 周后,细胞汇合度达到了80%,采用有限稀释法克隆化培养1周左右出现细胞克隆,即为PDLSCs(牙周膜干细胞)。见图1。
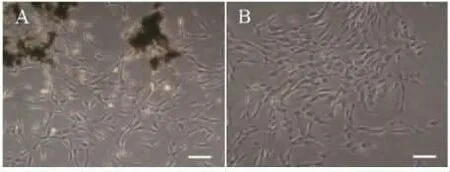
图1 PDLSCs 培养结果,A 为原代培养、B 为克隆培养,(100μm)
2.2 人牙周膜干细胞的细胞表型鉴定 流式细胞仪鉴定细胞表 面 CD34、CD45、CD105、CD29、CD146,其中鉴定PDLSCs的特异性标记物CD105、CD29、CD146 均为阳性表达,而造血细胞系表面标志CD34和白细胞共同抗原CD45 呈阴性表达。结果证实为人牙周膜干细胞。
2.3 各组细胞成骨分化情况 培养7d 牙周膜干细胞后,细胞排列有明显的方向性,有些呈不规则形和多角形,多数呈梭形,见图2。成骨诱导7d 左右,C 组D 组的实验细胞性状变为方形,显微镜下可见灰白色钙化小结节,茜素红染色检查结果显示阳性,D 组检出的钙结节较C 组多且明显(图C),在进行实验时间14d 时,镜下观察可以发现,C 组的钙结节主要表现为板层状的圆形、椭圆形团块,数量明显多于D 组(图D)。
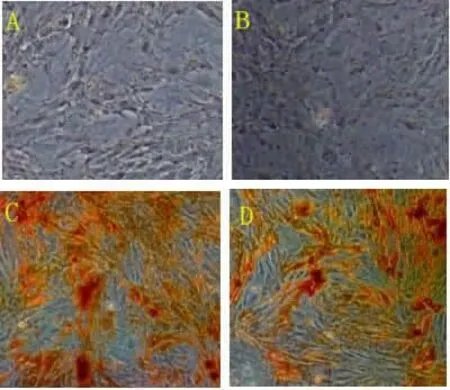
图2 A、B、C、D 分别为A 组、B 组、C 组、D组培养7d 后茜素红染色结果(×200 倍)
成骨诱导7d 时,D 组RUNX2的表达明显高于C 组,差异有显著性意义(P<0.05),A 组合B 租几乎没有变化;成骨诱导14d 时,D 组RUNX2的表达量与的7d 时比较,降低较为明显,而C 组RUNX2 相对表达强度较7d 时增高显著,组间差异具有统计学显著性(P<0.05),A 组、B 组RUNX2 相对表达强度变化不显著,见图3。
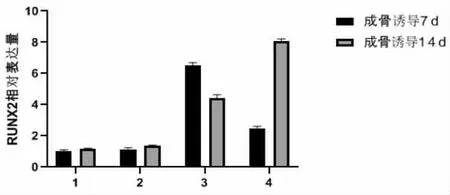
图3 A、B、C、D 组RUNX2表达量变化
2.4 免疫细胞化学染色 ⑴Stro-1和CD146的免疫细胞化学染色结果均呈现阳性,胞浆呈棕黄色,细胞核呈蓝色;证明h PDLSCs 能表达MSCs的表面标志物,见图4。⑵Vim 染色:细胞呈棕黄色,定位在胞浆,核呈蓝色,Vim(+);CK 染色:核呈蓝色,另外胞浆不着色,CK(-);说明h PDLSCs 来自于外胚间充质,而非上皮,见图4。

图4 hPDLSCs的免疫细胞化学染色 A Stro-1;B CD146;C Vim;D CK;(×200 倍)
2.5 各组牙RUNX2、OCN表达强度的比较在成骨后1 周和成骨后2 周成骨诱导液组和三磷酸腺苷+成骨诱导液组RUNX2和OCN mRNA的表达均高于对照组和三磷酸腺苷组,且差异具有统计学意义(P<0.05);在成骨后1 周三磷酸腺苷+成骨诱导液组的RUNX2和OCN mRNA表达高于成骨诱导液组,在成骨后2 周三磷酸腺苷+成骨诱导液组的RUNX2和OCN mRNA表达低于成骨诱导液组,且差异具有统计学意义(P<0.05)。成骨诱导液组成骨后1 周的RUNX2和OCN mRNA表达低于成骨后2 周,三磷酸腺苷+成骨诱导液组成骨后1周的RUNX2和OCN mRNA表达高于成骨后2周,且差异具有统计学意义(P<0.05)。见表1。
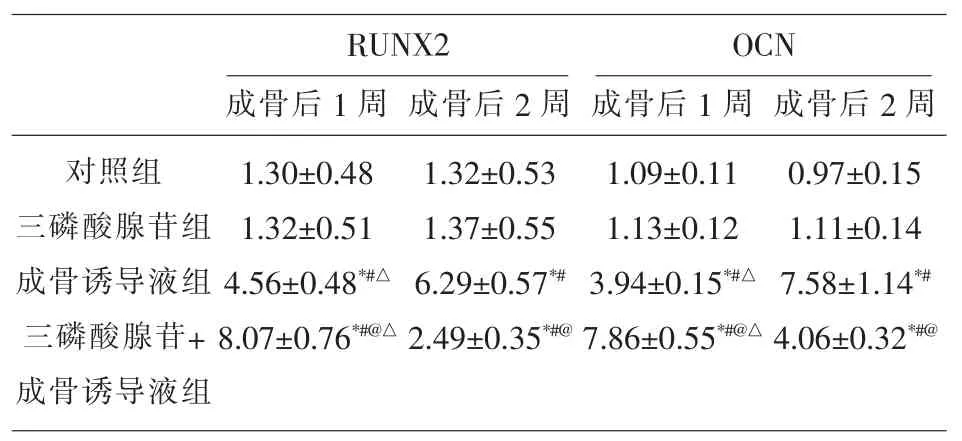
表1 各组RUNX2、OCN 相对表达强度的比较(x±SD)
2.6 各组牙周膜干细胞P2X7受体mRNA表达的比较在成骨后1 周三磷酸腺苷组的P2X7受体mRNA表达(8.17±0.32)和三磷酸腺苷+成骨诱导液组(8.78±0.22)均高于对照组(1.05±0.08)和成骨诱导液组(1.03±0.07),且差异具有统计学意义(P<0.05),三磷酸腺苷组和三磷酸腺苷+成骨诱导液组的P2X7受体mRNA 相对表达抢去的组间对比,差异无显著性(P>0.05);在成骨后2 周三磷酸腺苷组的P2X7受体mRNA表达(7.92±0.30)和三磷酸腺苷+成骨诱导液组(3.52±0.53)均高于对照组(1.01±0.10)和成骨诱导液组(1.02±0.09),且差异具有统计学意义(P<0.05),三磷酸腺苷组的P2X7受体mRNA表达高于三磷酸腺苷+成骨诱导液组,且差异具有统计学意义(P<0.05);三磷酸腺苷组成骨后1 周的P2X7受体mRNA表达高于成骨后2周,且差异具有统计学意义(P<0.05)。见表2。

表2 各组牙周膜干细胞P2X7受体mRNA表达的比较(x±SD)
3 讨论
牙周组织主要由牙周膜和牙槽骨等单元构成[6],其中研究显示多种离子通道均可影响而hPDLSCs 促进牙周组成单元的发育分化[7],因此,通过研究此类通道的作用机制,可使得hPDLSCs在可控范围内分化为能够新生牙周组织细胞,从而修复牙周组织缺损。笔者通过参阅既往文献发现,hPDLSCs和牙槽骨接触程度紧密[8],造成其具有明显的成骨特性,可转变为成熟牙骨细胞,促使牙槽骨再生,而多种因子均可诱导hPDLSCs 分化。研究显示,P2X7受体能够诱导骨骼干细胞分化成骨细胞,其属于P2X受体蛋白家族一员[9],并在高表达条件下被激活。其诱导骨骼干细胞分化的机制可描述为其和胞外三磷酸腺苷相互结合后,造成机体钠离子、钙离子内流,而钾离子外流[10],诱发连锁式的细胞数量变化。P2X7 广泛存在于免疫细胞内,可调控多种细胞及炎性因子分泌,造成细胞骨架重塑。文献表明,P2X7受体能够介导前列腺、结肠癌及甲状腺恶性肿瘤产生及发展,并可刺激神经系统释放复杂生物信号[11],对释放神经递质和胶质细胞活化产生影响。
随着研究深入,有学者发现P2X7受体可诱导幼儿骨骼发育,引起骨骼干细胞分化成骨细胞,显著影响骨骼发育及生长,同时其也可影响破骨细胞增殖和吸收[12]。因此,笔者选择P2X7 干扰hPDLSCs分化成牙槽骨细胞,修复牙周组织缺损。既往研究认为三磷酸腺苷表达水平处于100nmol/L 时[13-15],能够使得P2X7 有效发挥促hPDLSCs 分化,笔者经过本实验前初步研究也认可该结论,实验结果显示,P2X7受体在hPDLSCs 分化过程中可显著表达。
在本研究中分别测得各组Runx2和OCN基因表达,D 组的组Runx2和OCN基因表达显著高于成骨诱导液组,提示辅加三磷酸腺苷可以加强hPDLSCs 分化为成骨细胞的能力。在本实验中还发现外源性三磷酸腺苷对于hPDLSCs 分化调节具有阶段性。笔者选择Real-time PCR 检测P2X7受体表达水平,三磷酸腺苷组和三磷酸腺苷+成骨诱导液组mRNA 高于对照组与成骨诱导液组,提示了P2X7受体在外源性三磷酸腺苷影响下可以显著表达,而其表达与hPDLSCs和成骨分化存在正相关关系。三磷酸腺苷+成骨诱导液组P2X7受体mRNA表达则低于三磷酸腺苷组,提示了hPDLSCs成骨效果受P2X7受体表达的影响。
综上所述,P2X7受体可以明显提高牙周膜干细胞的成骨效果,且三磷酸腺苷可以激活P2X7受体的表达。
