卵巢组织中BMP15、GPR30的表达与PCOS卵泡发育障碍的关系
2021-10-06忽平
忽平
(南阳市中心医院妇产科,河南 南阳 473000)
多囊卵巢综合征(PCOS)是妇科常见的生殖内分泌系统疾病,生育期妇女PCOS 发病率达4%~18%,占无排卵性不孕症的50%~70%。PCOS 可诱发多种生殖系统肿瘤、代谢综合征、精神症状等不良远期并发症,严重影响妇女的生活质量[1-3]。故研究PCOS 卵泡发育障碍发病机制,为其治疗提供思路是生殖领域研究热点。关于PCOS的发病机制研究目前尚未阐明。有报道指出[4]PCOS 发病原因主要与卵巢内部自分泌和旁分泌因子水平紊乱有关。有研究报道[5]骨形成蛋白15(BMP15)在PCOS卵泡发育障碍患者血清中水平异常,BMP15 是转化生长因子β 超家族中的一员,可促进初级卵泡和原始卵泡的生长发育,并促进原始卵泡向次级卵泡进化。雌二醇(E2)及其受体可促进卵泡体细胞的增殖分化,对卵泡功能的完整性起着重要作用。雌激素受体G蛋白偶联受体(GPR30)是新型雌激素受体,已有研究证实[6,7]其在正常人的卵巢和卵泡中有显著作用,但是否在PCOS 发病过程中起作用,相关研究报道较少。本研究选取我院实施手术治疗的41例PCOS患者卵巢组织(PCOS 组)、因良性肿瘤实施卵巢肿瘤切除术获取的正常卵巢组织40例(对照组),对比分析两组卵巢组织中的BMP15、GPR30表达差异,旨在确定上述指标在PCOS 诊断中的价值。报告如下。
1 资料与方法
1.1 临床资料 选取我院2016年1 月-2018年1月实施手术治疗的41例PCOS患者卵巢组织(PCOS 组)、因良性肿瘤实施卵巢肿瘤切除术获取的正常卵巢组织40例为对照组。PCOS 组,年龄27~39 岁,平均30.6±2.0 岁。对照组,年龄26~40 岁,平均30.8±2.9 岁。两组研究对象的年龄比较,差异均无统计学意义(P>0.05)。
1.2 入选排除标准 入选标准:⑴PCOS的诊断标准参考鹿特丹诊断标准:患者表现为稀发排卵、无排卵,高雄激素血症,超声检查发现卵巢呈多囊性改变;⑵对照组为的月经周期规律,经期3~5d;⑶对照组卵巢组织经病理学检查证实未被肿瘤侵犯;⑷本研究符合《赫尔辛基宣言》相关医学伦理规定,对研究对象的各项资料保密。排除标准:⑴甲状腺疾病;⑵先天性肾上腺皮质增生;⑶库欣综合征;⑷免疫系统疾病、风湿性疾病。
1.3 免疫组化染色 采用免疫组化Elivision 二步法。100 ml/L 甲醛溶液固定卵巢组织将其连续切片厚度为5μm,脱蜡至水,0.01 mol/L 柠檬酸溶液(pH 6.0)高压蒸汽3 min,修复抗原。分别将组织切片与GPR30 一抗(兔来源多克隆抗体,浓度1:200,Invitrogen 公司生产)或BMPl5 一抗(兔来源单克隆抗体,浓度1:200,克隆号:JE51-47,Invitrogen 公司生产),4℃孵育过夜。PBs 洗涤3 遍,再与二抗(山羊抗兔IgG,浓度:1:2000,Invitrogen 公司生产)室温孵育30min。PBS 洗涤3 遍,DAB 显色。实验均设立阴性对照和空白对照。染色后切片背景为紫蓝色,阳性表达为黄色或棕褐色,每张切片均由2 名经验丰富的病理医生共同判断。免疫组化结果判定:BMP15、GPR30 主要在卵母细胞细胞核和细胞膜中表达。BMP15蛋白、GPR30蛋白的阳性表达呈黄色、棕黄色、褐色表达,⑴根据着色强度:0 分为无色、1 分为淡黄色、2 分为棕黄色、3 分为褐色、黑色;⑵根据阳性细胞比例:阳性细胞数目所占比例≤10%为1 分、阳性细胞所占比例11%~50%为2 分、阳性细胞数51%~75%为3 分、阳性细胞数所占比例>75%为4 分,两种积分相乘总分<3 分为阴性、≧3 分为阳性。
1.4 一般指标检测 检测两组的体质量指数(BMI)、血清雌激素(E2)、促黄体生成素(LH)、促卵泡生成素(FSH)、睾酮(T)、胰岛素抵抗指数(HOMA-IR)。BMI、E2、LH、FSH、T、HOMA-IR 检测:采用ELISA 法,所需试剂盒均购自罗氏公司,操作步骤严格按照说明书要求进行。
1.5 统计学方法 本研究收集的所有数据均在SPSS21.0 中进行统计分析,计量数据分别采用进行统计描述,采用t 检验进行数据分析;采用χ2检验进行统计分析;P<0.05 为差异具有统计学显著性。
2 结果
2.1 PCOS 组和对照组的BMI、生殖激素水平、HOMA-IR 比较 PCOS 组患者的BMI、血清E2、LH、T、HOMA-IR 测定值均高于对照组(P<0.05),PCOS 组的血清FSH 低于对照组(P<0.05),见表1。
表1 PCOS 组和对照组的BMI、生殖激素水平、HOMA-IR 比较()

表1 PCOS 组和对照组的BMI、生殖激素水平、HOMA-IR 比较()
2.2 PCOS 组和对照组的原始卵泡中卵母细胞的BMP15蛋白、GPR30蛋白表达比较 PCOS 组的原始卵泡中卵母细胞的GPR30蛋白阳性率显著高于对照组(P<0.05),BMP15蛋白阳性表达率低于对照组(P<0.05),见表2、图1、图2。
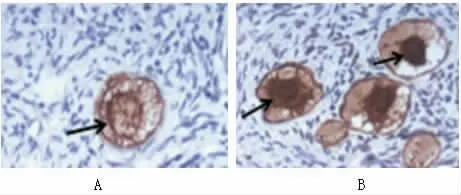
图1 原始卵泡中卵母细胞的GPR30蛋白表达(如图中箭头所示细胞核中的GPR30蛋白着色颗粒),A 为对照组、B 为PCOS 组,400 倍。

图2 原始卵泡中卵母细胞的BMP15蛋白表达(如图中箭头所示细胞核中的BMP15蛋白着色颗粒),A 为对照组、B 为PCOS 组,400 倍。

表2 原始卵泡中卵母细胞的BMP15蛋白、GPR30蛋白表达比较[n(%)]
2.3 PCOS 组和对照组的初级卵泡中卵母细胞的BMP15蛋白、GPR30蛋白表达比较 PCOS 组的初级卵泡中卵母细胞的GPR30蛋白阳性率显著高于对照组(P<0.05),BMP15蛋白阳性表达率低于对照组(P<0.05),见表3、图3、图4。

图3 初级卵泡中卵母细胞的GPR30蛋白表达(图中红箭头和黑色箭头分别为细胞膜及细胞核中的GPR30蛋白着色颗粒),A 为对照组、B 为PCOS 组,400 倍。

图4 初级卵泡中卵母细胞的BMP15蛋白表达(图中红箭头和黑色箭头分别为细胞膜及细胞核中的BMP15蛋白着色颗粒),A 为对照组、B 为PCOS 组,400 倍。

表3 初级卵泡中卵母细胞的BMP15蛋白、GPR30蛋白表达比较[n(%)]
3 讨论
卵源性因子在卵泡发育和卵母细胞成熟过程中起重要作用[8]其中包括BMP15蛋白,有研究报道[9]BMP15 可促进原始卵泡和初级卵泡的形成,促进原始卵泡向次级卵泡的生长转化,还能促进窦前卵泡向窦卵泡的转化,诱导卵丘膨胀,在卵泡发育和卵母细胞成熟过程中起着重要作用。还有研究通过对比分析经过卵巢刺激的废弃卵子复合物和正常卵巢颗粒细胞中BMP15水平发现,颗粒细胞中与卵子中BMP15水平一致,说明其同时在促进卵母细胞成熟和颗粒细胞增生过程中发挥作用。还有研究报道[10,11]BMP15 可直接调节颗粒细胞的增生、分化、代谢、黄素化和凋亡过程,上述一系列分泌信号可通过颗粒细胞的缝隙连接蛋白传导至卵细胞,建立颗粒细胞和卵子间的交流,共同影响卵泡发育的整个过程。此外,有研究报道[12]BMP15 除了直接影响卵泡成熟和颗粒细胞增殖外,可通过调节黄体的生成和功能间接影响卵泡的发育和排卵过程。鉴于BMP15在卵泡发育过程中的多样功能,推测BMP15 分泌异常可能参与PCOS 卵巢功能障碍的发病过程。本研究结果显示,PCOS 组较正常卵巢组,原始卵泡中卵母细胞和初级卵泡中卵母细胞分泌的BMP15蛋白阳性表达率显著下降,这与既往研究报道一致[13]。说明,BMP15 可促进初级卵泡和原始卵泡的成熟,对维持卵巢正常功能具有积极作用。
目前已有报道明确[14]甾体激素代谢异常是PC OS患者卵巢功能异常发病的主要因素,其中已证实,雄激素代谢异常在PCOS 发病机制的作用,关于雌激素代谢异常对PCOS患者卵巢功能影响的研究报道相对较少。有基础研究报道[15]通过单独使用戊酸雌二醇或联合使用孕激素、雄激素、人绒毛膜促性腺激素(Human Chorionic Gonadotropin,HCG)及胰岛素等均可建立PCOS 模型,但单独使用戊酸雌二醇建立的PCOS 模型与人体PCOS 病理状态更接近。另外有研究[16]通过使用抑制雌激素合成的药物(如克罗米芬、他莫昔芬等)可诱导PCOS患者的卵泡继续发育。以上研究报道均提示,雌激素过多可能是PCOS患者卵巢功能障碍的危险因素,故研究雌激素及其受体在PCOS患者卵细胞中的表达水平有利于加深卵泡发育机制的研究。经典的雌激素受体包括ERα和ERβ,定位于胞浆或胞核,通过调节不同基因发挥生理学效应,GPR30 是一种与传统雌激素受体ERα、ERβ 不同源的新型雌激素受体,通过传统的基因型效应和新型的非基因型效应调控雌激素水平。后者发生效应迅速,可在几秒至几分的短时间内诱导雌二醇与GPR30 结合,激活下游信号通路,促进细胞增殖或凋亡。有研究报道[17]斑马鱼中GPR30 可抑制卵母细胞减数分裂,抑制其成熟。目前已有研究发现GPR30在正常卵巢组织卵母细胞和卵泡膜细胞中的表达但未有报道表明其在PCOS患者卵巢组织中的表达状况。本研究结果显示,PCOS患者卵巢组织初级卵泡和原始卵泡中GPR30 较正常卵巢组织显著高表达,证明,GPR30 作为新型雌激素受体在雌激素信号传导中的作用及参与PCOS 卵巢功能障碍过程的作用。此外,本研究结果显示,PCOS患者BMI、HOMA-IR、LH、T水平显著升高与既往利用胰岛素或孕激素的方法建立PCOS 模型的原理一致。而FSH水平显著降低,是卵泡发育障碍的主要原因,与既往研究报道一致[18]。
综上所述,PCOS患者卵巢组织中BMP15表达下调、GPR30表达上调,可能参与卵泡发育过程有关。本研究创新处,确定雌激素受体信号通路、卵源性因子BMP15在PCOS 卵巢功能障碍发病机制中的作用,为其临床治疗提供思路。
