猕猴桃生香酵母筛选鉴定及其发酵特性
2021-10-05鲁云风刘智兴张四普牛佳佳胡瑞英田龙杨永峰
鲁云风,刘智兴,张四普,牛佳佳,胡瑞英,田龙,杨永峰
猕猴桃被称为果中之王,含有10 多种氨基酸、矿物质及多种维生素,对保持人体健康具有重要的作用[1-2]。猕猴桃果酒以猕猴桃果实为原料,经过酵母发酵而成,维生素C含量亦高于其他各类果酒[3-4]。
目前,我国在猕猴桃酿酒研究和酿制过程中,所使用的酵母基本是酿酒活性干酵母或葡萄酒酵母[5],这些酵母大多是针对葡萄酒的生产工艺特点开发出来的,具有明显的针对性,在其他果酒生产中效果并不显著[6],使得猕猴桃果酒的特有风味和营养特征并不突出,缺乏与猕猴桃香气相协调的果香与酒香。因此,筛选适于猕猴桃果酒发酵的专用酵母显得极为重要。韦婷等[7]从高糖发酵完成的酒液中筛选猕猴桃果酒专用酵母,伍强等[8]从野生猕猴桃汁中分离筛选出1株适于猕猴桃果酒发酵的酿酒酵母JM11,但关于猕猴桃生香酵母分离筛选及其发酵特性的研究尚不多见。河南西峡位于温带和亚热带交界区,地处伏牛山系,生物多样性丰富,是猕猴桃最佳适生区之一。为此,从西峡太平镇山区多年野生猕猴桃树叶、枝干、果皮及树下土壤中分离猕猴桃生香酵母,对菌株进行鉴定,研究其发酵特性,以期为开发猕猴桃果酒专用菌种或选育驯化的出发菌株提供科学依据。
1 材料和方法
1.1 样品与培养基
样品采自西峡太平镇山区多年野生猕猴桃树叶(标记为Y)、枝干(标记为Z)、果皮(标记为R)及树下土壤(标记为X),土壤分为表层土壤(标记为X0cm)、5 cm 处土壤(标记为X5cm)、10~20 cm 处土壤(标记为X10~20cm)、20~40 cm 处土壤(标记为X20~40cm),每份样品采集3份。徐香猕猴桃选自内乡猕猴桃合作社,糖度9.86°Bx。
YPD 培养基、麦芽汁培养基、WL 琼脂培养基、猕猴桃果汁培养基及菌种保藏培养基依据文献[9-12]方法配制。YPD培养基:酵母浸膏1%,蛋白胨2%,葡萄糖2%(固体YPD 培养基:添加2%琼脂粉)。麦芽汁培养基:麦芽汁培养基130.1 g/L,115 ℃灭菌15 min(固体培养基:添加2%琼脂粉)。WL 琼脂培养基:酵母浸粉0.500 00%,胰蛋白胨0.500 00%,葡萄糖5%,琼脂2%,磷酸二氢钾0.055 00%,氯化钾0.042 50%,氯化钙0.012 50%,氯化铁0.000 25%,硫酸镁0.012 50%,硫酸锰0.000 25%,溴甲酚绿0.002 20%,pH 值6.5。猕猴桃果汁培养基:选八成熟、发软的果实,清洗干净,加偏重亚硫酸钾,使SO2含量为0.06 g/kg(1 g偏重亚硫酸钾可产生560 mg SO2,1 L溶液中加入0.107 g偏重亚硫酸钾),打浆,加入1 mL/kg 的果胶酶,40 ℃水浴中酶解2 h后灭活,放凉。4 层纱布过滤上述果浆,放置过夜,取上清液,62~65 ℃灭菌30 min。菌种保藏培养基:酵母浸粉1.5 g/L,蛋白胨3.5 g/L,葡萄糖15.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 1.0 g/L,(NH4)2SO41.0 g/L,琼脂20.0 g/L,121 ℃灭菌20 min。所需试剂均为国产分析纯。
1.2 主要仪器与设备
TU-1810 紫外分光光度计(北京普析通用仪器有限责任公司),HH.B11.600-S-Ⅱ型电热恒温培养箱(上海跃进医疗器械厂),手持糖度计(上海米青科实业有限公司),SW-CJ-1F 型单人双面净化台(江苏苏中净化设备有限公司),立式实验室高压灭菌器(上海申安LDZM-40KCS),微分干涉显微镜(德国徕卡DMI1)。
1.3 生香酵母的分离、纯化及筛选
按常规方法处理1.1 中的样品,然后分别在YPD 培养基中富集微生物。将富集培养液稀释至10-4、10-5、10-6,各取0.1 mL 涂布于麦芽汁培养基平板上,28 ℃培养48 h,观察菌落质地、菌落颜色及菌落表面特征。用接种环挑取表面光滑、湿润的酵母单菌落,接种于麦芽汁斜面培养基中,28 ℃培养48 h,备用。酵母的分离、纯化依据文献[11]的方法。酵母菌一级复筛:采用杜氏管发酵法,根据菌株产气速率及产气量,初步获得发酵性能较强菌株[11]。酵母菌二级复筛:将一级复筛的菌种活化后接入猕猴桃汁培养基中,28 ℃条件下发酵8 d,测定残糖和酒精度,采用CO2失重法比较各菌株发酵能力[12]。酵母菌三级复筛:根据二级复筛的菌种发酵性能,挑取YPD 培养基上的单菌落接种于50 mL YPD 液体培养基中,于28 ℃条件下恒温培养24~72 h,采用嗅闻法判断产香情况[13]。综合三级复筛结果,筛选出生香能力强、发酵力好的猕猴桃生香酵母。
1.4 生香酵母的鉴定
1.4.1 菌株形态学鉴定 参照《酵母菌的特征与鉴定手册》[14]进行,初步确定1.3 中筛选出的猕猴桃生香酵母分类地位。
1.4.2 生理生化鉴定 参照《酵母菌的特征与鉴定手册》[14]和马荣山等[15]的方法,通过糖发酵试验、碳源同化试验、氮源同化试验等生理生化试验对分离出的生香酵母进行鉴定,初步判断菌株的种属。
1.4.3 分子鉴定 参照文献[15]的方法,提取酵母总DNA,纯化扩增26S rDNA D1/D2 区域序列,送往上海生工生物工程公司测序,将得到的测序结果与NCBI基因序列库中已知序列进行同源性比对,绘制系统发育树图谱,确定目的菌株种属。
1.5 发酵特性研究
1.5.1 耐性试验 参照文献[16-17]的方法,将生香酵母种子液接入YPD 液体培养基中,接种量为8%(1.1×106cfu/mL),分别调整SO2质量浓度(0.10~0.30 mg/L)、酒精度(6%~18%)和葡萄糖质量浓度(100~300 g/L),28 ℃下恒温培养24 h 后测定菌悬液600 nm 处OD 值,依据OD 值大小判定生香酵母的耐受性。
1.5.2 最适发酵温度和pH 值确定 参照文献[18]的方法,将生香酵母种子液接入24°Bx 猕猴桃果汁培养基中,接种量为8%,分别在不同温度和不同pH值条件下恒温培养72 h,用酒精计法测定酒精度,依据酒精度的大小确定最适发酵温度和pH值。
1.5.3 发酵效果评价 将筛选到的生香酵母活化后,接种于糖度240 g/kg 猕猴桃果汁,接种量为8%,调整pH 值为4.0,25 ℃发酵8 d 后测定每瓶发酵液的残糖、维生素C、总酸含量及酒精度、澄清度、色度,感官评定酒的风味(色泽、香味等)[12]。
其中,残糖(以还原糖计)、总酸(以柠檬酸计)、维生素C含量采用GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定;酒精度采用GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》方法进行测定。
1.6 数据处理
试验数据均以平均值±标准差表示,采用SPSS 21.0软件进行数据分析。
加快推进全市基础行业和优势行业的转型升级和提质增效。发挥百色铝产业优势,合理开发利用铝土矿资源,着力构建铝产业链和配套产业链。加快淘汰冶炼行业落后产能、改造提升技术装备水平;整合全市矿产资源,发展铝铜深加工行业。全面提升铝加工行业的整体竞争力,加快发展高性能、绿色环保的精细化工产品和高端化工新材料产品。加强与贵州、云南区域间的电力合作,实现优势互补,降低工业用电成本。提升改造传统建材行业,突破发展新兴建材行业。
2 结果与分析
2.1 生香酵母的筛选与鉴定
2.1.1 天然酵母的分离、纯化及初筛 经富集培养以及分离,WL 琼脂培养基培养,观察菌落的特征,最终得到了18株初筛酵母。WL琼脂培养基上菌落的颜色为奶油色(浅黄色)至绿色,表面为球形突起、光滑、不透明、奶油状。
2.1.2 酵母菌的一级复筛 将初筛得到的酵母菌株分别接入猕猴桃果汁培养基中发酵进行酵母菌的一级复筛,28 ℃培养48 h,分别在第12、24、36 h和48 h 观察杜氏小管中产气情况和絮凝情况。共获得6株产气效果好(产气达到1/2杜氏小管体积以上)、絮凝能力好的菌株。
2.1.3 酵母菌的二级复筛 以每天酵母失重量为指标做发酵力测试进行酵母菌的二级复筛,结果见图1。6 株菌株中,X-35cm起酵速度最快,1 d 达到最高发酵速率,且CO2失重量最高,发酵能力最好,其次为Z-3。
发酵8 d 后,发酵液的酒精度、残糖和CO2总失重量见表1。酒精度在5.6%以上的有菌株X-35cm、Z-3 和X-110~20cm,CO2总失重量在7.0 g 以上的有菌株X-35cm和Z-3,显著高于其他菌株,菌株X-35cm、Z-3 和X-110~20cm发酵液残糖相对较低。综合评价,筛选出X-35cm、Z-3 和X-110~20cm3 株菌株,作为三级复筛的出发菌株。
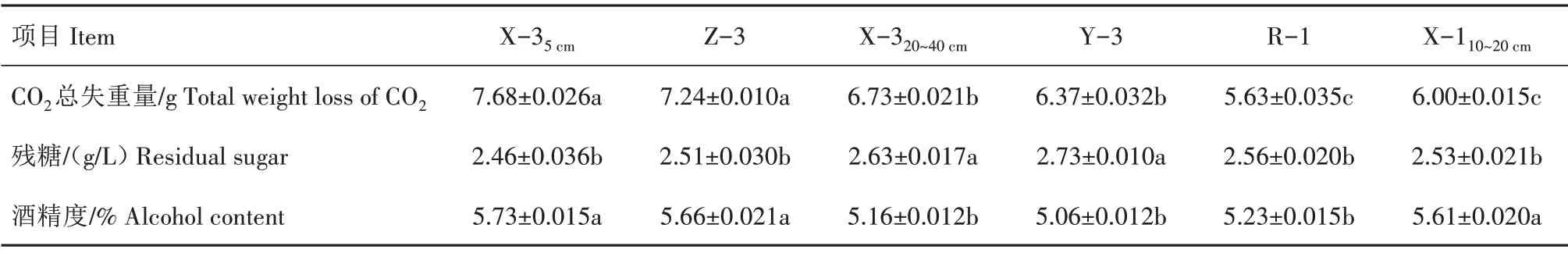
表1 不同菌株的发酵指标Tab.1 Fermentation indexes of different strains
2.1.4 酵母菌的三级复筛 按1.3 所述方法进行酵母菌的三级复筛,采用嗅闻法判断产香情况,结果见表2。综合发酵性能和产香能力,选择X-35cm为猕猴桃发酵生香酵母(将X-35cm命名为X-5)。
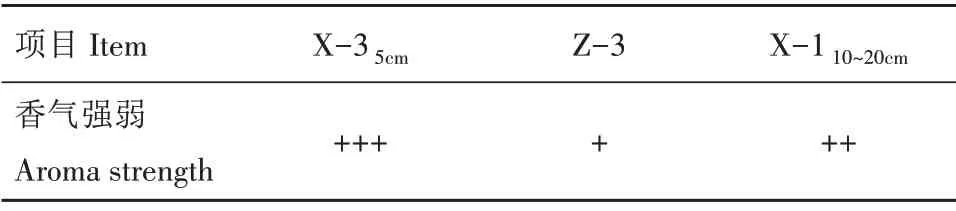
表2 不同菌株产香情况Tab.2 Aroma production of different strains
2.1.5 菌株的形态鉴定 X-5 菌落突起,颜色呈乳白色,不透明,表面光滑,湿润,边缘整齐。显微镜检结果(图2)显示,X-5 菌株形态为椭圆形,无性繁殖方式均为多端出芽繁殖。
2.1.6 菌株生理生化鉴定 通过糖发酵试验、同化碳源、同化氮源和其他生理生化试验对分离出的生香酵母X-5 进行鉴定,结果见表3。经形态观察和生理生化试验,并根据国际权威的酵母菌鉴定系统[14]鉴定,分离菌株为有孢汉逊酵母属(Hanseniaspora) 的葡萄园有孢汉逊酵母(Hanseniaspora vineae)。

表3 菌株X-5生理生化鉴定试验结果Tab.3 The results of physiological and biochemical identification of strain X-5
2.1.7 菌株26S rDNA 鉴定 经测序获得X-5 菌株的26S rDNA序列,长度为523 bp,与PCR结果(图3)一致。将此序列提交到NCBI 基因数据库进行序列对比分析,结果表明,分离菌株的序列与葡萄园有孢汉逊酵母的26S rDNA 序列相似性最高为96%。应用邻接法构建系统发育树,结果显示,菌株X-5与葡萄园有孢汉逊酵母亲缘关系最近,且在一个分支上(图4)。综合形态特征、生理生化试验结果以及序列比对结果,初步鉴定菌株X-5 为典型性生香酵母葡萄园有孢汉逊酵母。
2.2 生香酵母X-5的发酵性能
2.2.1 耐受性 高质量浓度SO2、糖和酒精度会对酵母产生胁迫作用[16-17],抑制其生长与发酵,进而影响果酒品质。耐受性试验结果(表4)表明,当SO2质量浓度超过0.20 g/L、酒精度大于12%时,生香酵母X-5 生长均受到抑制;糖质量浓度低于300 g/L 时,对其影响不大。
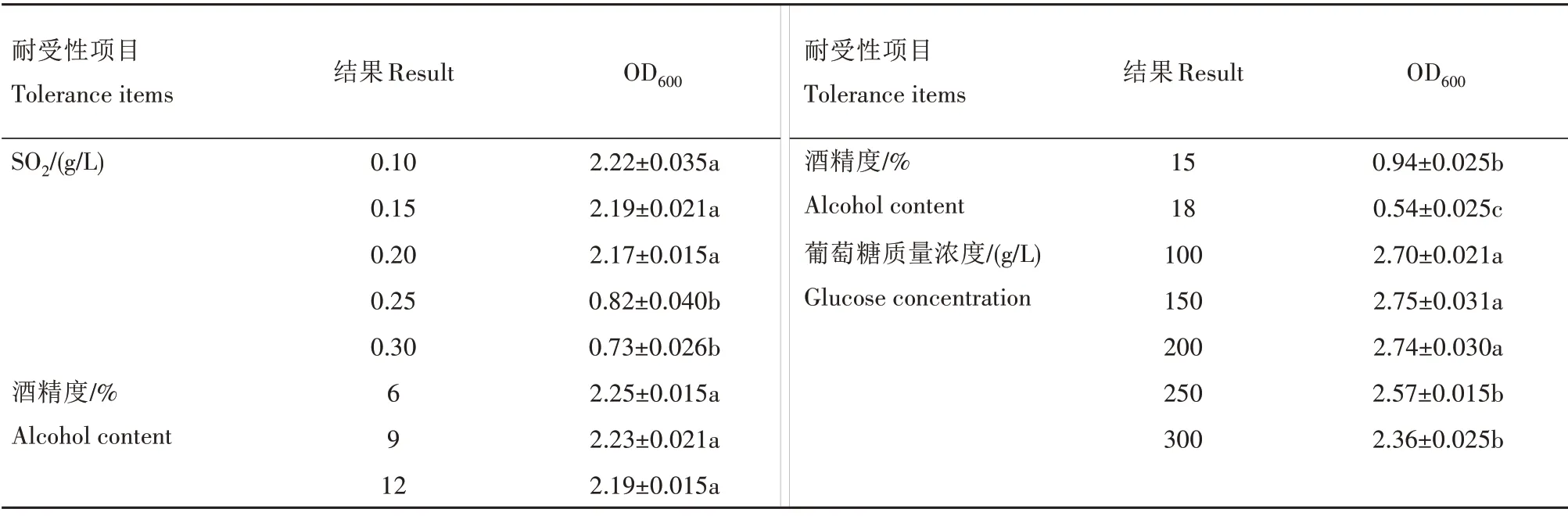
表4 菌株X-5耐受性试验结果Tab.4 The results of physiological tolerance test of strain X-5
2.2.2 最适发酵温度和pH 值 发酵温度和pH 值变化对生香酵母X-5 发酵影响较大,随着温度上升,酵母生长活性变大,发酵能力增强。当温度为26 ℃时,酒精度最大,之后随着温度上升,酵母活性有所降低,产酒精能力下降。pH值变化对酵母产酒精能力影响有相同的趋势。由图5 和图6 可以看出,生香酵母X-5 最适的发酵温度为26 ℃,最适pH值为4.0。
2.2.3 发酵效果评价 将生香酵母X-5 活化后,接种于糖度240 g/kg猕猴桃果汁中,25 ℃发酵8 d后测理化指标和感官指标,X-5 发酵性能测定结果见表5。由表5 可知,生香酵母X-5 发酵的猕猴桃果酒,酒度较低,维生素C含量高,感官评价高,酒香浓郁,香气、口感好。

表5 生香酵母X-5发酵猕猴桃酒的理化指标和感官指标Tab.5 Physico-chemical and sensory indexes of sweet kiwifruit wine fermented by yeast X-5
3 结论与讨论
从猕猴桃种植园土壤或猕猴桃表皮及汁中分离酿酒或非酿酒酵母是筛选猕猴桃果酒发酵专用菌种或选育驯化出发菌株的主要方法和重要途径。研究者先后筛选分离出多种酿酒和非酿酒酵母[7-8,17,19-20]。然而,酿酒酵母酿造的酒通常存在风味平淡的缺陷[21]。产香酵母会赋于酒不同的风味特征[22]。因此,筛选生香酵母等非酿酒酵母用于果酒发酵成为近些年的研究热点,主要应用于优质葡萄酒和梨酒的酿造[16,23]。
本研究以多年野生猕猴桃树叶、枝干、果皮及树下土壤为材料,通过分离、纯化后筛选出1株产香能力强、发酵性能优良的生香酵母。经形态观察、生理生化试验和26S rDNA基因序列同源性分析,鉴定为葡萄园有孢汉逊酵母。耐受性试验结果表明,该菌株可耐受12%的酒精度、300 g/L 的糖和0.20 g/L SO2,发酵后酒液澄清透明,酒香果香浓郁,酒精度9.6%,维生素C 含量0.327 7 g/L,感官品质高,可作为猕猴桃果酒发酵的专用菌种或选育驯化的出发菌株。该菌株在乙醇耐受性及产酒精度等方面与酿酒酵母相比还有差距,但果酒中乙醇含量过高时会影响酒的风味特征,生产低醇果酒成为新的趋势[23-24]。因此,可以利用该菌株生产低醇优质猕猴桃果酒,也可以此菌株为出发菌株,进行化学、物理及ARTP 等诱变育种,以及利用基因组重排技术、基因工程技术等改造培育遗传稳定的工程菌,提升其发酵特性。另外,当前将酿酒酵母和生香、产脂等非酿酒酵母混合发酵酿造果酒取得了较好的效果,刘晓柱等[16]将葡萄汁有孢汉逊酵母与酿酒酵母X16混合发酵刺梨果汁,降低了刺梨果酒中挥发酸和残糖量,提升了果酒品质。阎贺静等[25]利用酿酒酵母和葡萄汁有孢汉逊酵母混合发酵玫瑰香葡萄酒,显著提高了玫瑰香葡萄酒中乙酸乙酯等典型特征香气成分的含量。张博钦等[23]研究发现,葡萄园有孢汉逊酵母与酿酒酵母混合发酵可使葡萄酒中乙酸苯乙酯含量提升36.04 倍。因此,将本研究筛选鉴定的生香酵母与酿酒酵母混合发酵猕猴桃果酒值得进一步研究。
综上,本研究从多年野生猕猴桃树下土壤中分离到1 株发酵能力较强的生香酵母,对SO2、糖和酒精度耐受性较好,产香力强,可作为猕猴桃果酒发酵的专用菌种或选育驯化的出发菌株开展进一步研究。
