E3泛素连接酶调控 GA、ABA 影响种子萌发综述
2021-10-03李静吴翼弓淑芳杨耀东
李静 吴翼 弓淑芳 杨耀东
摘要赤霉素( GA)和脫落酸( ABA)在植物种子萌发过程中存在着拮抗作用,两者间平衡关系的变化是维持和打破种子休眠的主要调控机制。E3泛素连接酶在种子萌发过程中起到重要的调节作用。从 E3泛素连接酶的分类、作用部位和它们在种子萌发过程中参与脱落酸和赤霉素信号转导的作用机制,以及与其他基因的互作等方面展开论述,发现 E3泛素连接酶可以通过影响 GA 和 ABA信号通路成员的蛋白质活性、定位和基因互作来精确地调控 GA 和 ABA信号转导,从而影响种子休眠与萌发。此外,GA 和 ABA 都存在“解除抑制”信号传导模式,因此,今后在相关研究中可以利用 E3泛素连接酶解除 ABA对种子萌发的抑制,提高 GA对种子萌发的促进作用,达到提高出芽率,培养优质种苗的生产目的;或者在成熟种子储存过程中利用 E3泛素连接酶解除 GA对种子萌发的促进作用,维持 ABA对种子的休眠作用,延长粮食作物等的储藏期。
关键词 E3泛素连接酶;脱落酸;赤霉素;种子萌发;调控机理
中图分类号 Q786 文献标识码 A DOI:10.12008/j.issn.1009-2196.2021.12.017
Review of E3 Ubiquitin Ligase Regulating GA and ABA Affecting Seed Germination
LI Jing WU Yi Gong Shufang YANG Yaodong
(Coconut Research Institute , CATAS/Hainan Key Laboratory of Tropical Oil Crops Biology,Wenchang, Hainan 571339,China)
Abstract Gibberellin (GA) and abscisic acid (ABA) have antagonistic effects in the process of plant seed germination, and the change in the balance relationship between GA and ABA is the main regulatory mechanism for maintaining and breaking seed dormancy. E3 ubiquitin ligases play an important role in regulation of seed germination. A review was made from the aspects of classification of E3 ubiquitin ligases, the role of the site and the mechanism of their involvement in the signal transduction of GA and ABA during seed germination, as well as the interaction with other genes. The review shows that E3 ubiquitin ligases can precisely regulate GA and ABA signal transduction to affect the seed dormancy and germination by affecting the protein activity, localization and gene interaction of the GA and ABA signaling pathway members. In addition, both GA and ABA have a “disinhibition” signal transduction mode. Therefore, E3 ligases can be used in related research to release the inhibition of ABA in seed germination and increase the promotion role of GA in seed germination to improve the germination rate for propagation of high-quality seedlings in the future . They can also be used during the storage of mature seeds to relieve the promoting effect of GA on seed germination and maintain the dormancy effect of ABA on seeds to extend the storage life of seeds of food crops.
Keywords E3 ubiquitin ligase ; gibberellin (GA); abscisic acid (ABA); seed germination ; regulation mechanism
种子是所有种子植物通过有性生殖繁衍后代的重要材料。种子萌发的成功与否决定着植物繁衍后代的成败,因此种子具有重要的经济价值[1-2]。种子从成熟状态到萌发状态以及随后的幼苗形成阶段经历了一个相当复杂的过程,影响种子萌发的因素也很多,包括生理生化指标、基因、蛋白质等的调控。因此,研究种子萌发机理对于指导生产具有重要的理论价值和现实意义。Shuai 等[3]研究发现,种子的休眠和萌发的生理过程受所有植物激素调控。而作为种子休眠正调节剂的植物激素也可作为种子萌发的负调节剂[2,4],研究植物激素对种子萌发的作用机理可为生产实践中指导种苗繁育提供理论依据。一些研究表明,乙烯、生长素、油菜素类固醇参与种子的休眠和萌发[5],但更多的学者认为,脱落酸( ABA)和赤霉素( GA)是调控种子萌发最主要的2个激素[6-7]。近年来研究发现,E3泛素连接酶可通过参与 ABA 和 GA 信号转导从而达到调控种子萌发的作用。本文着重分析 E3泛素连接酶在参与 ABA 和 GA 信号转导中所起到的调控作用以及它们对种子萌发的影响,为提高种子发芽率、加快种苗繁育进程等提供理论依据。
1 ABA和GA在种子萌发过程中的作用
ABA在许多细胞过程中发挥重要作用,包括种子发育、休眠、萌发、营养生长和逆境胁迫响应[8]。在种子成熟过程中以及对环境胁迫的反应中,ABA水平会显著增加。Pandey 等[9]认为,ABA 调控的过程分为两类:一类是种子中 ABA信号传导维持种子休眠,抑制种子萌发及幼苗早期发育;第二类是较成熟植物的生物胁迫反应,包括保卫细胞功能和离子通道调节。赤霉素能拮抗 ABA对种子萌发的抑制作用。除激素含量外,许多种子从休眠状态转变为非休眠状态的特征为 ABA敏感性降低,GA敏感性提高[10]。因此,种子中 ABA/GA 间平衡关系的变化是维持和打破种子休眠的主要调控机制[11-12]。研究表明,一部分 ABA/GA 平衡的变化受 ABA、 GA 代谢及信号传导有关基因表达的调控[13-14]。目前,已经鉴定出参与 ABA 和 GA 代谢途径的主要酶(表1、2)。不同植物中参与种子萌发的 ABA代谢和信号转导相关基因不尽相同,过表达和基因突变后,这些基因表现出延长种子休眠或者促进种子萌发等特性(表1),例如在水稻中过表 OsAP2-39基因,会使种子中内源 ABA水平提高,从而导致种子萌芽率降低[15],而突变拟南芥中的 cyp707a2可以通过改变种子中的 ABA水平而延长休眠时间[16]。不同植物中参与种子萌发的 GA代谢和信号转导相关基因的作用模式不同。如通过突变或过表达改变 GA 生物合成相关基因[17-18],或改变种子中 ABA 和 GA 的信号转达[19]等方式抑制种子萌发(表2)。
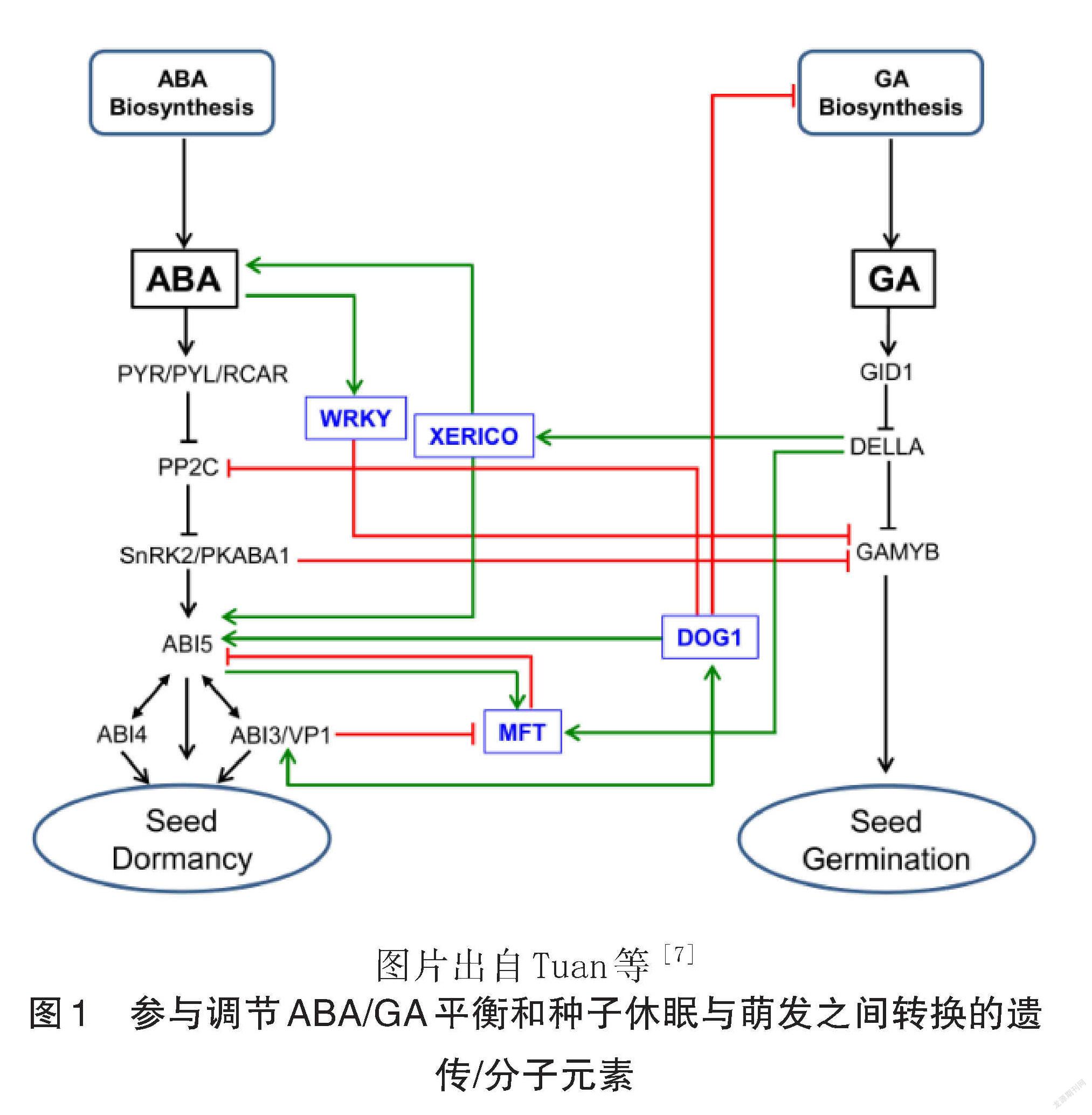
Tuan等[7]在对 ABA/GA平衡调控谷类种子休眠和萌发的分子机制中对相关基因的互作做了详细论述(图1)。 ABA 通过调节 WRKY 转录因子的表达来抑制 GAMYB介导的 GA反应[28]。DELLA蛋白通过与 Ring-H2锌指 E3泛素连接酶 XERICO 相互作用,调节 GA 和 ABA 反应之间的平衡[13]。FT 和 MFT 通过负反馈机制抑制表达,从而抑制 ABA 信号传导[29]。延迟发芽基因( DOG1)通过其与 PP2C 的相互作用来调节 ABA 信号传导,从而调节种子休眠[30],并可能通过调节 ABI5的表达且与 ABI3相互作用[31]。 DOG1还通过以温度依赖性方式表达 GA 生物合成和失活基因来调节 GA 代谢[32-33]。 SnRK2/PKABA1与 GAMYB结合并抑制其转录[34]。
2泛素化在种子萌发过程中的作用
泛素/26S 蛋白酶体途徑主要由泛素激活酶(ubiquitin activating enzyme, E1)、泛素结合酶 (ubiquitin conjugating enzyme, E2)、泛素蛋白连接酶(ubiquitin ligase enzyme, E3)和26S 蛋白酶体(26s Proteasome)组成。E1泛素激活酶通过交酯作用将活化的泛素转移到 E2泛素结合酶上。之后,E3泛素连接酶将结合 E2泛素结合酶的泛素特异地连接到底物蛋白上,最终靶蛋白在26S蛋白酶体上被水解为较小的肽段[35]。
泛素化-蛋白酶系统中的 E3泛素连接酶可以通过影响 GA 和 ABA 信号通路成员的蛋白质活性、定位和基因互作来精确地调控 GA 和 ABA 信号转导,从而影响种子休眠与萌发。其中研究较多的是 E3泛素连接酶对 ABA和 GA信号通路成员的调控[36]。
2.1 E3泛素连接酶
E3泛素连接酶能够特异地识别底物蛋白并与之结合,促进泛素向底物蛋白转移,是泛素化反应的关键酶[37]。E3泛素连接酶数量庞大,种类繁多。根据 E3泛素连接酶所含结构域和结合方式将其分为 HECT、Ring、U-box 和 CRLs 四类[38]。其中 Ring 结构域是一个由40~60个氨基酸组成富含Cys的区域,由含有8个空间保守的Cys和 His残基充当金属配体以螯合2个锌离子来实现泛素向靶蛋白的转移。Smalle等[39]推测,拟南芥基因组中存在超过1300个基因编码不同类别的 E3连接酶。这意味着泛素依赖性蛋白水解广泛地参与不同的细胞过程。在这1300个预测的潜在 E3连接酶中,大约有450多个属于 Ring锌指结构域[40]。
大多数植物 Ring结构域 E3泛素连接酶存在于细胞核、细胞质和细胞膜中。例如拟南芥 ATRF1位于细胞核内[41],水稻OsHTAS位于细胞核内和细胞质中[42]。同时,油菜 BrRZFP1位于细胞质和细胞膜上[43]。另还有一些蛋白质位于内质网或细胞的其他部分。SpRing位于内质网中[44],水稻 OsHCI1主要分布在细胞骨架附近[45]。根据最近的研究, Ring结构域 E3泛素连接酶的定位与它们的功能存在一定的相关性。研究发现,位于细胞核中的 Ring结构域 E3泛素连接酶主要参与转录因子或其他核表达蛋白的降解[46-47]。
2.2 E3泛素连接酶参与脱落酸和赤霉素信号转导及其对种子萌发的影响
RHA2a是一种功能性的 E3泛素连接酶,其保守的环结构域可能对 RHA2a在 ABA信号转导中的生物学功能起重要作用。Bu等[48]研究发现,在种子萌发和幼苗早期发育过程中,rha2a 突变体对 ABA 的敏感性低于野生型,而过度表达 rha2a 的转基因植株对 ABA 的敏感性较高,表明 rha2a 对 ABA 介导的种子萌发和幼苗早期发育具有正调控作用。他们的研究表明,RHA2a是种子萌发和幼苗早期发育过程中 ABA信号转导的重要调控因子。Hsia 等[49]指出,拟南芥 Ring結构域蛋白 BRIZ1和 BRIZ2对于正常种子萌发和发芽后生长至关重要。Zhao等[50]发现,ECERIFERUM9( CER9)基因编码的 E3泛素连接酶参与拟南芥种子和幼苗中的脱落酸信号传导。他们的研究表明,CER9是种子发芽过程中 ABA生物合成和 ABA信号通路的新型负调节因子。Jin等[51] 发现, COP9 Signalosome ( CSN)作为一种保守的多亚基蛋白复合物,是Cullin-Ring 家族 E3泛素连接酶( CRLs)调节物。他们的研究发现,除了csn5b-1,CSN 的多个可行突变体均表现出萌发力弱的特点,而 csn1-10具有更强的使种子休眠的能力,csn5a-1突变体除了休眠之外,还表现出延迟种子萌发的能力。Rao 等[52]研究表明,在种子的发育和萌发过程中,拟南芥 SKP1类蛋白13( ASK13)均在不同器官中受到差异调节,并响应非生物胁迫而被上调表达。GARU ( GA受体 Ring E3泛素连接酶)介导了 GID1的泛素依赖性降解,拟南芥garu突变体和 TAGK2过表达植物可加速 GID1稳定和 DELLA 降解。在盐胁迫下,GARU抑制种子发芽。水稻Tilier Enhancer ( TE)编码 APC/CTE E3泛素连接酶复合物的激活物,该复合物可促进种子发芽[53]。
研究表明,XERICO在种子萌发过程中对 ABA和 GA 的合成代谢起着重要的调控作用。Zeng等[54]在拟南芥中分离 XERICO全长基因并在水稻中异源表达,发现过表达 XERICO的纯合转基因植株在种子萌发和幼苗早期生长过程中表现出对胁迫(盐、渗透和外源 ABA)的超敏反应,使种子中 ABA水平升高,导致种子发芽延迟。Brugière等[55]在玉米( Zea mays)中鉴定到2个 Ring-H2基因ZmXerico1和 ZmXerico2,过表达这2个基因导致 ABA水平升高。Kim 等[56]在拟南芥中过表达杨树Ptxerico基因使幼苗对盐和 ABA 的敏感性增强。Ko等[57]发现,在拟南芥种子萌发和幼苗早期生长期间,过量表达 XERICO基因的转基因拟南芥植株表现出对盐含量和渗透胁迫以及 ABA 的敏感性,酵母双杂交筛选表明,XERICO与 E2泛素结合酶( AtUBC8)和 ASK1相互作用的 F-box蛋白( AtTLP9)相互作用,参与 ABA信号通路。
2.3植物种子萌发休眠过程中 E3泛素连接酶与其他基因间的互作
研究表明,DELLA可以通过与 XERICO相互作用来介导 GA 和 ABA 反应之间的平衡,从而实现对种子休眠和萌发的调控[13,58]。当 GA 水平低时, DELLA激活 XERICO的表达,从而增强 ABA 的积累并激活 ABI5的转录,抑制种子发芽,使种子保持休眠状态。Zeng等[59]研究发现,XERICO在水稻中的过表达导致 ABA水平升高,并分别提高 OsNCED1和 OsABI5的表达,从而导致种子发芽延迟。 KEG(Keep on going)是 Ring 型 E3泛素连接酶,它能泛素化 ABA 信号通路中的核心转录因子 ABI5及其上游激活蛋白 CIPK26[60-61]。KEG 还可以与 ABF1以及 ABF3互作,调控其泛素化及降解[62]。此外,研究表明,在过表达 U-box 型 E3泛素连接酶 CHIP植株中,种子的萌发和气孔的关闭对 ABA 的敏感性增强[63]。
3研究趋势和新思路
种子萌发和休眠是高等植物整个生育周期中比较重要的阶段。种子萌发的质量决定着幼苗的形态建成及后期的生长发育。脱落酸和赤霉素作为影响植物种子萌发的两大重要激素,已经在多种作物中研究得比较详尽[64-65]。蛋白质的泛素化修饰参与了植物的生长发育过程以及对生物胁迫和非生物胁迫的响应。目前,E3泛素连接酶对 ABA 信号通路成员的调控影响种子萌发已成为新的研究热点[66-67]。阐述 E3泛素连接酶在种子萌发过程中的作用机理,对于一些研究基础较为薄弱的木本作物尤其一些具有萌发时间久、萌芽率相对较低等特点的椰子、油棕、椰枣等热带木本作物,不仅可加快其分子育种进程,还可通过激素介导处理加快种子萌发进程,提高萌芽率。但是,目前 E3泛素连接酶在种子萌发过程中的作用机理及其对应的实际应用研究上还比较薄弱,为此,未来的研究方向建议如下。
3.1深入研究 E3泛素连接酶对 ABA 和 GA 信号通路成员的调控机理
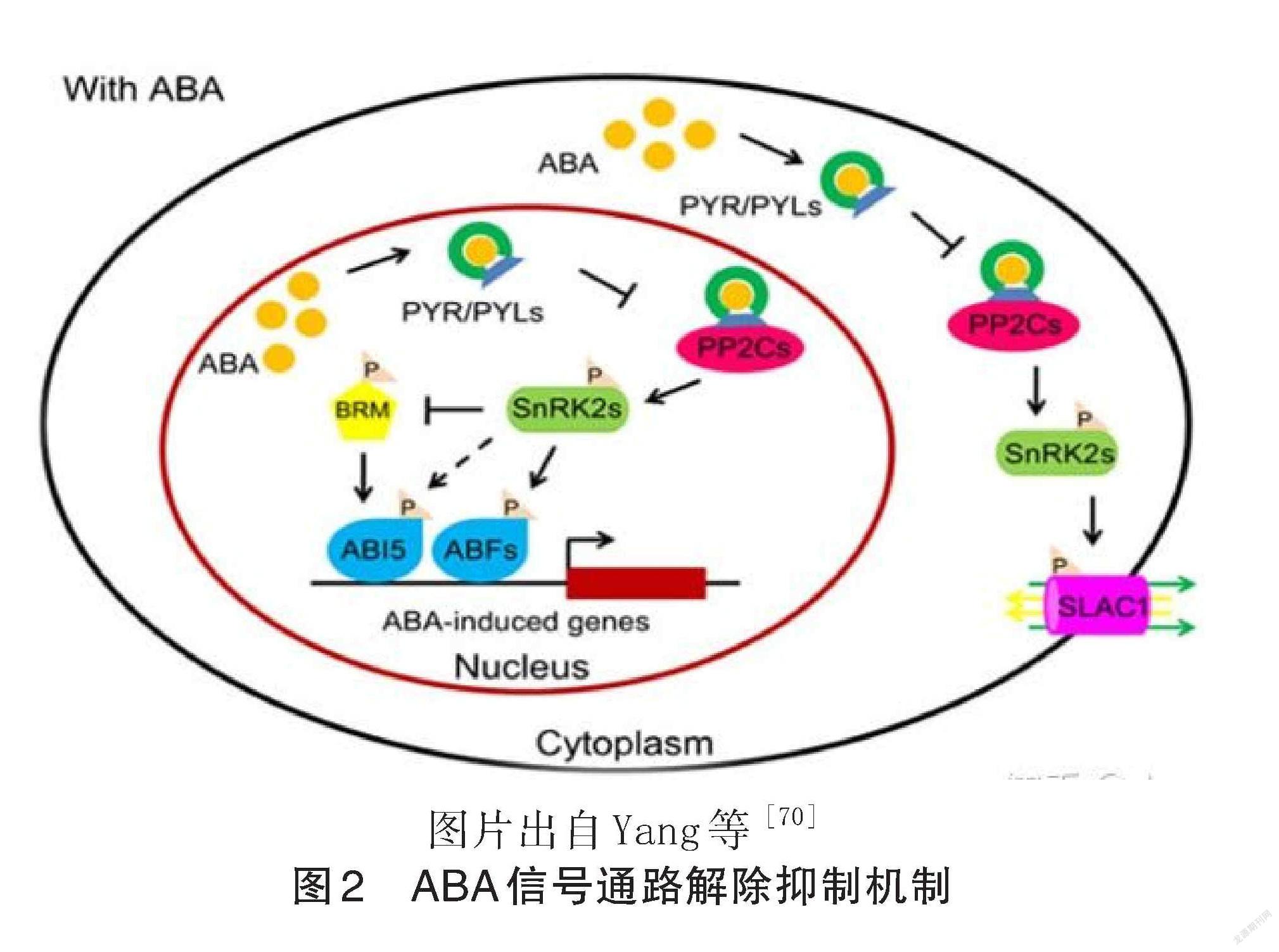
ABA对种子休眠、种子发芽、幼苗生长以及生物和非生物胁迫反应起重要的调控作用。像其他的植物激素信号通路一样,ABA信号通路遵循一种“解除抑制”信号传导模式(图2)。因此可通过研究 ABA 的“解除抑制”信号传导模式研究种子萌发机理。泛素系统对于植物中的多种激素信号通路至关重要,可以通过深入研究 E3泛素连接酶对ABA 和 GA信号通路成员的调控机理解析种子萌发过程中 ABA 的信号转导。Linden 等[68]揭示了拟南芥E3连接酶 BRIZ,在脱落酸( ABA)信号传导或响应中起作用。Kong 等[69]通过体外分析拟南芥 ABA信号关键 PP2C 蛋白 ABI1( ABA-INSENSITIVE 1),发现它受26S蛋白酶体途径降解,并通过酵母双杂交筛选到与其互作的 U-box E3泛素连接酶 PUB12和 PUB13,揭示了 PUB12和 PUB13调控 ABI1水平的机制。
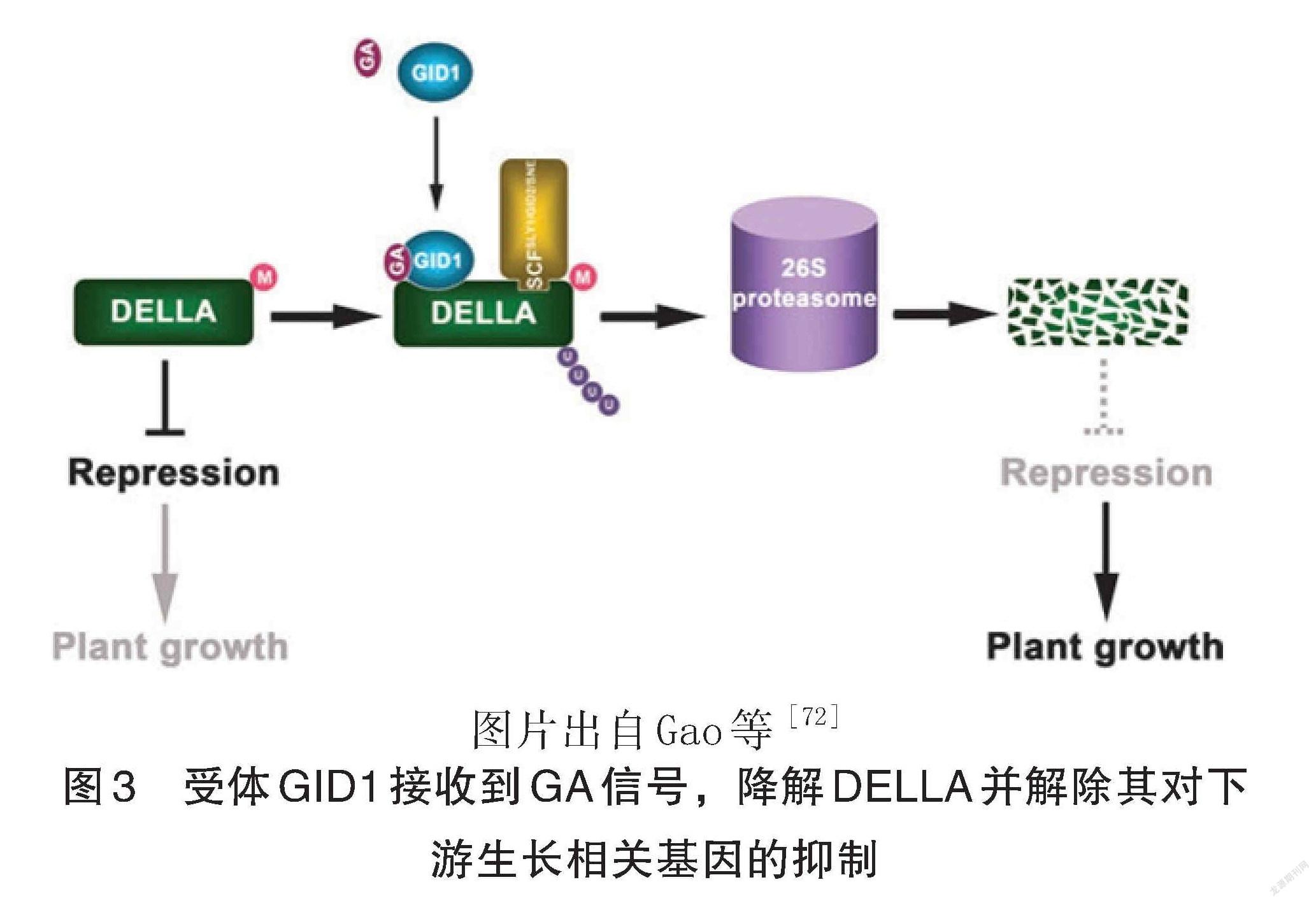
GA 也存在“解除機制”的工作模式调控植物生长发育,参与生物胁迫和非生物胁迫(图3)。Ariizumi等[71]发现,DELLA 对拟南芥种子萌发的抑制可以通过泛素-蛋白酶体途径的 DELLA 蛋白水解或通过不依赖蛋白水解的赤霉素( GA)激素信号传导解除。GA 与 GA 受体 GID1结合会刺激 GID1- GA-DELLA 复合物的形成,进而通过 SCF ( SLY1) E3泛素连接酶和26S蛋白酶受体触发 DELLA蛋白泛素化和蛋白水解。
3.2开展 E3泛素连接酶在种子萌发过程中的作用机理研究
E3泛素连接酶种类繁多,功能强大,研究其作用机理,有望解析其在种子萌发过程中的作用。 Nelson等[73]研究发现,SLY1基因编码 SCF E3泛素连接酶的 F-box亚基,这是 GA 触发的 DELLA种子萌发抑制因子蛋白水解所需。DELLA 在 sly1-2种子中的过度积累导致种子休眠期延长。但是种子萌发是一个复杂过程,在未来的研究中可以针对 E3泛素连接酶的亚细胞定位确定其作用部位,再通过酵母单杂交、酵母双杂交确定其上下游调控基因以及互作蛋白等,深入解析 E3泛素连接酶在种子萌发中的作用机理。
参考文献
[1] Bewley J D. Seed Germination and Dormancy [J]. The Plant cell,1997,9(7):1055-1066.
[2] Rajjou L, Duval M, Gallardo K, et al. Seed germination and vigor [J]. Annual Review of Plant Biology,2012,63:507-533.
[3] Shuai H, Meng Y, Luo X, et al. Exogenous auxinrepresses soybean seed germination through de ‐ creasing the gibberellin/abscisic acid (GA/ ABA) ratio [J].Sci Rep,2017,7(1):12620.
[4] Holdsworth M J,Bentsink L,Soppe W J. Molecu‐lar networks regulating Arabidopsis seed matura‐tion, after-ripening, dormancy and germination [J].New Phytologist,2008,179,33-54.
[5] Zhong C, Patra B, Tang Y, et al. A transcrip‐tional hub integrating gibberellin-brassino‐ steroid signals to promote seed germination in Arabidopsis [J]. J Exp Bot,2021,erab192.
[6] Gubler F, Millar A A, and Jacobsen J V. Dormancy release, ABA and pre-harvest sprouting [J]. CurrOpin Plant Biol,2005,8:183-187.
[7] Tuan P A, Kumar R, Rehal P K, et al. Molecularmechanisms underlying abscisic acid/gibberellin balance in the control of seed dormancy and ger ‐mination in Cereals [J].Front Plant Sci, 2018,9:668.
[8] Murata Y, Mori I C,Munemasa S. Diverse stoma ‐tal signaling and the signal integration mecha‐nism [J]. Annu Rev Plant Biol, 2015, 66,369-392.
[9] Pandey S, Chen J G, Jones A M, et al. G-proteincomplex mutants are hypersensitive to abscisic acid regulation of germination and postgermina‐tion development [J].Plant Physiol,2006, 141:243-256.
[10] Chiwocha S D, Cutler A J, Abrams S R, et al.The etr1-2 mutation in Arabidopsis thaliana af‐fects the abscisic acid, auxin, cytokinin and gibberellin metabolic pathways during mainte‐nance of seed dormancy, moist-chilling and germination [J]. Plant J,2005,42:35-48.
[11] Shu K, Liu X D,Xie Q , et al. Two faces of one seed: hormonal regulation of dormancy and ger ‐mination [J]. Mol Plant,2016,9:34-45.
[12] Finch-Savage W E, and Footitt S. Seed dormancycycling and the regulation of dormancy mecha‐nisms to time germination in variable field environments [J].J Exp Bot,2017,68:843-856.
[13] Piskurewicz U,Jikumaru Y, Kinoshita N,et al.The gibberellic acid signaling repressor RGL2 inhibits Arabidopsis seed germination by stimu‐lating abscisic acid synthesis and ABI5 activity [J].Plant Cell,2008,20:2729-2745.
[14] Izydorczyk C, Nguyen T N, Jo S, et al. Spatiotemporal modulation of abscisic acid and gibberellin metabolism and signaling mediates the effects of suboptimal and supraoptimaltem‐peratures on seed germination in wheat ( Triti‐cumaestivum L.)[J].Plant Cell Environ, 2017,41:1022-1037.
[15] Yaish M W, El-Kereamy A, Zhu T, et al. TheAPETALA-2-like transcription factor OsAP2-39 controls key interactions between abscisic acid and gibberellin in rice [J].PLoS Genet, 2010,6:e1001098.
[16] Asano T, Hakata M, Nakamura H, et al. Func‐tionalcharacterisation of OsCPK21, a calcium- dependent protein kinase that confers salt tol‐erance in rice [J]. Plant Mol Biol, 2011, 75:179-191.
[17] Gabriele S, Rizza A, Martone J, et al. The Dofprotein DAG1 mediates PIL5 activity on seed germination by negatively regulating GA biosyn‐ thetic gene AtGA3ox1[J]. Plant J, 2010, 61:312-323.
[18] Oh E, Yamaguchi S, Hu J, et al. PIL5, a phy‐tochrome-interacting bHLH protein, regulates gibberellin responsiveness by binding directly to the GAI and RGA promoters in Arabidopsis seeds [J].Plant Cell,2007,19:1192-1208.
[19] Liu X, Hu P, Huang M, et al. The NF-YC-RGL2module integrates GA and ABA signalling to reg ‐ulate seed germination in Arabidopsis [J]. Nat Commun,2016,7:12768.
[20] Shu K, Zhou W, Yang W. APETALA 2-domain-con ‐taining transcription factors: focusing on ab ‐scisic acid and gibberellins antagonism [J]. New Phytol,2018,217:977-983.
[21] Shu K, Zhang H, Wang S, et al. ABI4 regulatesprimary seed dormancy by regulating the biogen‐esis of abscisic acid and gibberellins in Ara ‐bidopsis [J]. PLoS Genet, 2013, 9:e1003577.
[22] Lin P C, Hwang S G, Endo A, et al. Ectopic ex ‐pression of ABSCISIC ACID 2/GLUCOSE INSENSITIVE 1 in Arabidopsis promotes seed dormancy and stress tolerance [J]. Plant Physiol, 2007,143:745-758.
[23] Lee K H, Piao H L, Kim H Y, et al. Activationof glucosidase via stress-induced polymeriza‐tion rapidly increases active pools of abscisic acid [J]. Cell,2006,126:1109-1120.
[24] Miura K, Lee J,Jin J, et al. Sumoylation of ABI5 by the Arabidopsis SUMO E3 ligase SIZ1 neg ‐atively regulates abscisic acid signaling [J].Proc Natl Acad Sci U S A, 2009,106:5418-5423.
[25] Koornneef M, Van Der Veen J. Induction andanalysis of gibberellin sensitive mutants in Arabidopsis thaliana ( L.) Heynh. Theor [J]. Appl Genet,1980,58:257-263.
[26] Gabriele S, Rizza A, Martone J, et al. The Dofprotein DAG1 mediates PIL5 activity on seed germination by negatively regulating GA biosyn‐ thetic gene AtGA3ox1[J]. Plant J, 2010, 61:312-323.
[27] Benson J.,Zeevaart J. Comparison of ent-kaurene synthase A and B activities in cell-free extracts from young tomato fruits of wild-type and gib-1, gib-2, and gib-3 tomato plants [J]. J Plant Growth Regul, 1990, 9: 237-242.
[28] Xie Z, Zhang Z L, Zou X, et al. Interactionsof two abscisic-acid induced WRKY genes in re ‐ pressing gibberellin signaling in aleurone cells [J].Plant J,2006,46:231-242.
[29] Xi W, Liu C, Hou X, et al. Mother of FT andTFL1 regulates seed germination through a nega‐tive feedback loop modulating ABA signaling in Arabidopsis [J]. Plant Cell, 2010, 22:1733-1748.
[30] Née G, Kramer K, Nakabayashi K, et al. DELAY OF GERMINATION 1 requires PP2C phosphatases of the ABA signaling pathway to control seed dor‐mancy [J]. Nat Commun, 2017, 8:72.
[31] Dekkers B J W, He H, Hanson J, et al. The Ara ‐bidopsis DELAY OF GERMINATION 1 gene affects ABSCISIC ACID INSENSITIVE 5( ABI5) expression and genetically interacts with ABI3 during Ara ‐bidopsis seed development [J]. Plant J,2016, 85: 451-465.
[32] Kendall S L,Hellwege A, Marriot P, et al.Induction of dormancy in Arabidopsis summer an ‐nuals requires parallel regulation of DOG1 and hormone metabolism by low temperature and CBF transcription factors [J]. Plant Cell,2011, 23: 2568-2580.
[33] Graeber K,Linkies A,Steinbrecher T, et al.2014. Delay of germination mediatesaconserved coat-dormancy mechanism for the temperature and gibberellin-dependent control of seed germina‐tion [J]. Proc Natl Acad Sci. U S A.2014,111:3571-3580.
[34] Gómez-Cadenas A,Zentella R, Walker-Simmons MK, et al. Gibberellin/abscisic acid antagonism in barley aleurone cells: site of action of the protein kinase PKABA1 in relation to gibberellin signaling molecules [J]. Plant Cell, 2001,13: 667-680.
[35] Nagels D A,Pauwels L,Goossens A. The ubiqui‐ tin system and jasmonate signaling [J]. Plants, 2016, 5(1):6.
[36]陳熙. AtDGA1参与脱落酸调控的种子萌发和幼苗生长[ D].武汉:武汉大学,2017.
[37] Berndsen C E,Wolberger C. New insights into ubiquitin E3 ligase mechanism [J]. Nature Structural & Molecular Biology, 2014, 21:9301-9307.
[38] Vierstra R D. The ubiquitin-26S proteasome sys ‐tem at the nexus of plant biology [J]. Nature Reviews Molecular Cell Biology, 2009, 10(6): 385-397.
[39] Smalle J,Vierstra R D. The ubiquitin 26S pro ‐teasome proteolytic pathway [J].Annu Rev Plant Biol,2004,55:555-590.
[40] Stone S L,Hauksdottir H, Troy A, et al.Functional analysis of the RING-type ubiquitin ligase family of Arabidopsis [J].Plant Physi‐ol,2005,137:13-30.
[41] Qin X M, Huang S, Liu Y Q, et al. Overexpression of a RING finger ubiquitin ligase gene AtATRF1 enhances aluminium tolerance in Arabi ‐dopsis thaliana [J]. J Plant Biol, 2017, 60:66-74.
[42] Liu J, Zhang C, Wei C, et al. The RING FingerUbiquitin E3 Ligase OsHTAS enhances heat toler‐ance by promoting H2O2-Induced stomatal closurein rice [J].Plant Physiol,2016,170:429-443.
[43] Jung Y J, Lee I H,Nou I S, et al. BrRZFP1 aBrassica rapa C3HC4-type RING zinc finger pro ‐tein involved in cold, salt and dehydration stress [J]. Plant Biol,2013,15:274-283.
[44] Qi S L, Lin Q F, Zhu H S, et al. The RING Fin ‐ger E3 Ligase SpRing is a positive regulator of salt stress signaling in salt-tolerant wild to ‐mato species [J]. Plant Cell Physiol, 2016,57:528-539.
[45] Lim S D, Cho H Y, Park Y C,et al. The rice RINGfinger E3 ligase, OsHCI1, drives nuclear ex ‐ port of multiple substrate proteins and its heterogeneous overexpression enhances acquired thermotolerance [J]. J Exp Bot, 2013, 64:2899-2914.
[46] Gao W, Liu W, Zhao M, et al. NERF encodes aRING E3 ligase important for drought resistance and enhances the expression of its antisense gene NFYA5 in Arabidopsis [J]. Nucleic Acids Res,2015,43:607-617.
[47] Kim J H, Lim S D, Jang C S. Oryza sativa heat- induced RING finger protein 1( OsHIRP1) posi‐tively regulates plant response to heat stress [J]. Plant Mol Biol,2019,99:545-559.
[48] Bu Q, Li H, Zhao Q, et al. The ArabidopsisRING finger E3 ligase RHA2a is a novel positive regulator of abscisic acid signaling duringseedgermination and early seedling development [J]. Plant Physiol,2009,150(1):463-481.
[49] Hsia M M,Callis J. BRIZ1 and BRIZ2 proteinsform a heteromeric E3 ligase complex required for seed germination and post-germination growth in Arabidopsisthaliana [J].J Biol Chem,2010,285(47):37070-37081.
[50] Zhao H, Zhang H, Cui P, et al. The putative E3ubiquitin ligase ECERIFERUM9 regulates abscisic acid biosynthesis and response during seed ger ‐mination and postgermination growth in Arabi ‐dopsis [J]. Plant Physiol, 2014, 165(3):1255-1268.
[51] Jin D, Wu M, Li B, et al. The COP9 Signalosomeregulates seed germination by facilitating pro ‐tein degradation of RGL2 and ABI5[J]. PLoS Genet,2018,14(2): e1007237.
[52] Rao V, Petla B P, Verma P, et al. Arabidopsis SKP1-like protein13( ASK13) positively regu‐ lates seed germination and seedling growth under abiotic stress [J].J Exp Bot,2018,69(16):3899-3915.
[53] Lin Q, Zhang Z, Wu F, et al. The APC/CTE E3Ubiquitin Ligase complex mediates the antago‐nistic regulation of root growth and tillering by ABA and GA [J]. Plant Cell, 2020, 32(6):1973-1987.
[54] Zeng D E, Hou P, Xiao F, et al. Overexpressionof Arabidopsis XERICO gene confers enhanced drought and salt stress tolerance in rice ( Oryza Sativa L.)[J].J Plant Biochem Biotech ‐nol,2015,24:56-64.
[55] Brugière N, Zhang W, Xu Q, et al. Overexpression of RING Domain E3 Ligase ZmXerico1 confers drought tolerance through regulation of ABA ho ‐meostasis [J] Plant Physiology,2017,175(3):1350-1369.
[56] Kim M H, Cho J S, Park E J, et al. Overexpression of a poplar RING-H2 Zinc Finger,Ptxeri‐ co, confers enhanced drought tolerance via re ‐duced water loss and ion leakage in Populus [J]. International Journal of Molecular Sciences,2020,21(24):9454.
[57] Ko J H, Yang S H, Han K H. Upregulation of anArabidopsis RING-H2 gene, XERICO, confers drought tolerance through increased abscisic acid biosynthesis [J].Plant Journal,2006,47(3):343-355.
[58] Zentella R, Zhang Z L, Park M, et al. Globalanalysis of DELLA direct targets in early gib ‐berellin signaling in Arabidopsis [J]. Plant Cell,2007,19:3037-3057.
[59] Zeng D E, Hou P, Xiao F, Liu Y. Overexpressinga novel RINGRingH2 finger protein gene,Os‐ RHP1, enhances drought and salt tolerance in rice ( Oryza sativa L.) [J]. J Plant Biol,2014,57:357-365.
[60] Stone S L, Williams L A, Farmer L M. Keep ongoing, a RINGRing E3 ligase essential for Ara ‐bidopsis growth and development, is involved in abscisic acid signaling [J].Plant Cell, 2006,18:3415-3428.
[61] Lyzenga W J, Liu H, Schofield A, et al. Arabidopsis CIPK26 interacts with KEG, components of the ABA signaling network and is degraded by the ubiquitin-proteasmoe system [J].J EXP Bot,2013,64:2779-2791.
[62] Chen Y T, Liu H, Stone S, et al. ABA and theubiquitin E3 ligase Keep on going affect prote‐olysis of the Arabidopsis thaliana transcrip‐tion factors ABF1 and ABF3[J].Plant J,2013,75:965-976.
[63] Luo J, Shen G, Yan J, et al. AtCHIP functionsas an E3 ubiquitin ligase of protein phosphatase 2A subunits and alters plant response to ab ‐scisic acid treatment [J]. Plant J, 2006, 46(4):649-657.
[64] Guo X, Hou X, Fang J, et al. The rice GERMINATION DEFECTIVE 1, encoding a B3 domintran‐scriptional repressor, regulates seed germi‐ nation and seedling development by integrating GA and carbohydrate metabolism [J]. Plant J,2013,75:403-416.
[65] Yan A, Wu M, Yan L, et al.AtEXP2 is involvedin seed germination and abiotic stress response in Arabidopsis [J].Plos One,2014,9:e85208.
[66] Cho S K, Ryu M Y, Kim J H, et al. RING E3 li ‐ gases: key regulatory elements are involved in abiotic stress responses in plants [J]. Bmb Reports ,2017,50(8):393-400.
[67] Sun J H, Sun Y H, Ahmed R I, et al. Research progress on plant RING-finger proteins [J]. Genes,2019,10:973.
[68] Linden J, Hsia M, Chen T, et al. The Arabidopsis thaliana E3 Ubiquitin Ligase BRIZ Func‐tions in Abscisic Acid Response [J]. Front Plant Sci,2021,12:641849.
[69] Kong L, Cheng J, Zhu Y, et al. Degradation ofthe ABA co-receptor ABI1 by PUB12/13 U-box E3 ligases [J]. Nat Commun,2015,6:8630.
[70] Yang W, Zhang W, Wang X. Post-translational control of ABA signalling: the roles of protein phosphorylation and ubiquitination [J]. Plant Biotechnol J,2017,15(1):4-14.
[71] Ariizumi T,Hauvermale A L, Nelson S K, et al. Lifting della repression of Arabidopsis seed germination by nonproteolytic gibberellin sig ‐naling [J]. Plant Physiol, 2013, 162(4):2125-2139.
[72] Gao X H, Xiao S L, Yao Q F, et al. An updatedGA signaling 'relief of repression' regulatory model [J]. Mol Plant,2011,4(4):601-606.
[73] Nelson S K,Steber C M. Transcriptional mecha‐nisms associated with seed dormancy and dormancy loss in the gibberellin-insensitive sly1-2 mu ‐ tant of Arabidopsis thaliana [J]. PLoS One,2017,12(6): e0179143.
(編辑:龙娅丽;排版:郭彩杉)
