三苯基锑配合物催化二吲哚甲烷衍生物高效合成及活性研究*
2021-09-30王灵晓李宁波
王灵晓, 范 琪, 马 榕, 续 立, 李宁波
(1.太原工业学院 化学化工系,山西 太原 030006;2.山西医科大学 基础医学院,山西 太原 030001)
0 引言
我国锑资源比较丰富,相比于过渡金属钛、锆、铪等有机金属配合物的路易斯酸的研究,有机锑金属配合物作为路易斯酸催化剂研究较少[1-3].目前,对于有机锑化合物研究主要是配合物结构的多样性[4-7],而在路易斯酸催化领域报道较少[8-9].可能原因是C-Sb键不稳定,大多数有机锑配合物对空气敏感.尽管有些研究者使用螯合配体增加了有机锑配合物空气稳定性,但是酸性较弱,催化活性低.以上问题的存在使得有机锑配合物在路易斯酸催化领域里的发展较为缓慢.因此,设计合成对空气稳定和具有强酸性的新型有机锑路易斯酸催化剂很有必要.
二吲哚甲烷衍生物因具有重要的生理活性而备受科学家关注.目前,制备二吲哚甲烷衍生物的主要方法是通过醛和吲哚衍生物合成.报道的催化剂体系包括:质子酸和路易斯酸,如SiO2-SO3H[10]、氨基磺酸(H2NSO3H)[11]、H3PW12O40[12]、BF3·Et2O[13]、Br2[14]、LiClO4[15]、Dy(OTf)3[16]、Yb(OTf)3/SDS[17]、ZrOCl2·8H2O[18]和Zr(Salophen)Cl2[19]等,然而,上述催化剂存在一些弊端, 如催化剂对水敏感、反应条件苛刻、使用有毒溶剂、产物产量低、反应时间长、不能回收利用等.因此,开发一种能够催化合成二吲哚甲烷衍生物的新型高效稳定催化剂具有一定的研究价值.
前期发现长链的全氟烷基磺酸基团与金属离子结合后,可以增加有机金属配合物的空气稳定性和酸性[20-28].基于此, 本文采用对水敏感的Ph3SbCl2与AgOSO2C8F17反应,合成了三苯基锑全氟辛基磺酸盐, 表征了配合物结构,探究其物理性质,并将其应用于催化醛与吲哚衍生物的反应.系统考察其催化效果, 探究不同反应条件,如溶剂、催化剂用量、反应时间等对产率的影响.在最优条件下,三苯基锑配合物催化醛与吲哚衍生物合成了一系列二吲哚甲烷衍生物,并考察了目标化合物对胃癌细胞SGC-7901和结肠癌细胞HCT116的体外抗肿瘤活性.
1 实验方法
1.1 实验试剂和仪器
1H NMR和13C NMR由Varian-400核磁共振谱仪测定(TMS为内标);高分辨质谱由Thermo Scientific Q Exactive质谱仪测定;热重分析仪器由北京恒久HCT-1 型测定;硅胶为青岛海洋化工厂产品.溶剂CH2Cl2通过氢化钙过夜搅拌除水后蒸出,三苯基二氯化锑,吲哚及其衍生物、醛均在安耐吉公司购买, 其他试剂均为分析纯.胃癌细胞SGC-7901和结肠癌细胞HCT116均由中国科学院细胞库提供.
1.2 催化剂和二吲哚甲烷衍生物制备
1.2.1 三苯基锑配合物的制备及实验数据向25 mL的Schlenk管中依次加入三苯基二氯化锑Ph3SbCl2(0.5 mmol, 0.209 g), 全氟辛基磺酸银AgOSO2C8F17(1.0 mmol, 0.607 g)和无水二氯甲烷15 mL,氮气保护下,室温反应2 h.反应完毕后,过滤,向滤液中加入5 mL干燥的正己烷.置于-20 ℃冰箱中,过夜结晶,抽滤得白色固体Ph3Sb(OSO2C8F17)2(1),M.p.: 187~188 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.15 (d,J=8.0 Hz, 4H), 7.75~7.69 (m, 9H), 7.58 (t,J=7.6 Hz, 3H);19F NMR (376 MHz,CDCl3)δ(ppm): -80.76~-80.82 (t, 3F), -112.82 (s, 2F), -120.65 (s, 2F), -121.60~-121.83 (d, 6F), -122.71 (s, 2F), -126.14 (s, 2F);ESI-HRMS calculated for C34H15F34NO6S2Sb2[1 + Na]+:1 372.870 3;Found:1 372.618 2.
1.2.2 二吲哚甲烷衍生物的制备及实验数据向25 mL的Schlenk管中,依次加入Ph3Sb-(OSO2C8F17)2(27 mg,0.02 mmol), 芳香醛(1.0 mmol)和吲哚衍生物(2.0 mmol), 室温下搅拌,TLC跟踪反应.反应完毕后,加入10 mL 乙醚,过滤分离回收催化剂(催化剂真空抽干,直接用于下一循环).滤液旋干后柱层析分离(V(PE)∶V(EA) =1∶10),得到二吲哚甲烷衍生物.
3, 3’-二吲哚基苯甲烷(4a)[20],浅粉红色固体, M.p.: 127~128 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.85 (br. s, 2H), 7.41 (d,J= 8.0 Hz, 2H), 7.37~7.33 (m, 4H), 7.27 (t,J= 7.2 Hz, 2H), 7.23 (d,J= 8.0 Hz, 3H), 7.19 (t,J= 7.6 Hz, 2H), 7.00 (t,J= 7.6 Hz, 2H), 6.65 (d,J= 1.6 Hz, 2H), 5.91 (s, 1H);13C NMR (100 MHz, CDCl3)δ(ppm):144.0, 136.7, 128.7, 128.5, 128.2, 127.1, 126.1, 120.0, 119.0, 119.8, 119.2, 111.0, 40.2; MS (EI)m/z: 322.1 (M+).
3, 3’-二吲哚基-4-甲基苯基甲烷(4b)[20], 浅粉红色固体, M.p.: 96~97 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.89 (br. s, 2H), 7.36 (d,J= 7.6 Hz), 7.34 (d,J= 7.6 Hz , 2H), 7.21 (d,J= 8.0 Hz, 2H), 7.15 (t,J= 7.6 Hz, 2H), 7.07 (d,J= 8.0 Hz, 2H), 6.99 (t,J= 7.6 Hz, 2H), 6.65 (d,J= 1.0 Hz, 2H), 5.85 (s, 1H), 2.30 (s, 3H);13C NMR (100 MHz, CDCl3)δ(ppm): 141.0, 136.7, 135.5, 128.9, 128.6, 127.1, 123.5, 121.9, 120.0, 119.9, 119.2, 111.0, 39.8, 21.1; MS (EI)m/z: 336.1 (M+).
3, 3’-二吲哚基-2-羟基苯基甲烷(4c), 浅粉红色固体, M.p.: 120~121 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.00 (br. s, 2H), 7.40~7.36 (m, 4H), 7.22~7.18 (m, 4H), 7.03 (t,J= 7.6 Hz, 2H), 6.89~6.83 (m, 2H), 6.75 (d,J= 1.6 Hz, 2H), 6.03 (s, 1H);13C NMR (100 MHz, CDCl3)δ(ppm): 154.5, 136.9, 130.0, 129.2, 128.0, 126.9, 123.6, 122.3, 120.8, 119.9, 119.6, 117.3, 116.6, 111.2, 35.8; MS (EI)m/z: 338.1 (M+).
3, 3’-二吲哚基-4-氯苯基甲烷(4d)[20], 浅粉红色固体, M.p.: 105~106 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.95 (br. s, 2H), 7.33 (t,J= 8.4 Hz, 4H), 7.26~7.20 (m, 4H), 7.17 (t,J= 8.0 Hz, 2H), 7.01 (t,J= 8.0 Hz, 2H), 6.65 (d,J= 1.2 Hz, 2H), 5.85 (s, 1H; CH);13C NMR (100 MHz, CDCl3)δ(ppm): 141.6, 135.7, 130.8, 129.1, 127.3, 125.9, 122.6, 121.0, 118.8, 118.3, 118.1, 110.1, 38.6; MS (EI)m/z: 356.1 (M+).
3, 3’-二吲哚基-4-溴苯基甲烷(4e)[20], 浅粉红色固体, M.p.: 101~102 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.93 (br. s, 2H), 7.38~7.33 (m, 6H), 7.20~7.14 (m, 4H), 7.01 (t,J= 7.6 Hz, 2H), 6.62 (d,J= 1.6 Hz, 2H), 5.85 (s, 1H; CH);13C NMR (100 MHz, CDCl3)δ(ppm): 143.1, 136.7, 131.3, 130.5, 126.9, 123.6, 122.1, 119.9, 119.8, 119.4, 119.1, 111.1, 39.7; MS (EI)m/z: 400.1 (M+).
3, 3’-二吲哚基-3-硝基苯基甲烷(4f)[20], 浅粉红色固体, M.p.: 217~218 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.20 (t,J= 2.0 Hz, 1H), 8.10 (d,J= 8.0 Hz, 1H), 8.01 (br. s, 2H), 7.70 (d,J= 7.6 Hz, 1H), 7.45 (t,J= 8.0 Hz, 1H), 7.38 (t,J= 7.8 Hz, 4H), 7.21 (t,J= 7.6 Hz, 2H), 7.02 (t,J= 7.6 Hz, 2H), 6.67 (d,J=1.2 Hz, 2H), 6.01 (s, 1H);13C NMR (100 MHz, CDCl3)δ(ppm): 148.5, 146.4, 136.8, 134.9, 129.1, 126.7, 123.7, 122.3, 121.5, 119.6, 118.3, 111.2, 40.0; MS (EI)m/z: 367.1 (M+).
3, 3’-二(5-甲基吲哚基)苯甲烷(4g)[23]: 浅粉红色固体, M.p.: 192~193 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.82 (br. s, 2H), 7.34 (d,J= 7.6 Hz, 2H), 7.28 (t,J= 7.2 Hz, 4H), 7.23 (d,J= 4.0 Hz, 1H), 7.18 (d,J= 6.8 Hz, 2H), 6.98 (d,J= 8.0 Hz, 2H), 6.59 (s, 2H, CH), 5.83 (s, 1H), 2.35 (s, 6H);13C NMR (100 MHz, CDCl3)δ(ppm):144.2, 135.1, 128.7, 128.4, 128.2, 127.3, 126.0, 123.9, 123.5, 119.5, 119.4, 110.7, 40.0, 21.5; MS (EI)m/z: 350.1 (M+).
3, 3’-二(5-氯吲哚基)苯甲烷(4h)[23]: 浅粉红色固体, M.p.: 191~192 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.28 (s, 2H), 7.26 (d,J= 4.0 Hz, 4H), 7.19 (t,J= 8.4 Hz, 3H), 7.09 (d,J= 8.8 Hz, 2H), 6.58 (s, 2H), 5.73 (s, 1H);13C NMR (100 MHz, CDCl3)δ(ppm): 143.2, 135.0, 128.6, 128.5, 128.0, 126.6, 125.1, 125.0, 122.4, 119.2, 119.0, 112.3, 40.0; MS (EI)m/z: 390.1 (M+).
3, 3’-二吲哚基-2,3,4-三羟基苯基甲烷(4i): 浅粉红色固体, M.p.: 123~125 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.04 (s, 2H), 7.41~7.32 (m, 4H), 7.20 (t,J= 7.6 Hz, 2H), 7.03 (t,J= 7.6 Hz, 2H), 6.76 (s, 2H), 6.63 (d,J= 8.4 Hz, 1H), 6.47 (d,J= 8.4 Hz, 1H), 5.93 (s, 1H), 5.46 (s, 3H);13C NMR (100 MHz, CDCl3)δ(ppm): 171.3, 143.0, 142.2, 136.9, 132.2, 126.8, 123.5, 122.4, 120.5, 120.0, 119.6, 117.5, 112.2, 107.6, 60.5; MS (EI)m/z: 370.1 (M+).
三(3-吲哚基)甲烷 (4j)[23]: 红色固体, M.p.: 245~246 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.95 (s, 2H), 7.56 (d,J= 7.6 Hz, 3H), 7.41 (t,J= 8.0 Hz, 3H), 7.20 (t,J= 7.2 Hz, 3H), 7.06 (t,J= 7.6 Hz, 3H), 6.83 (d,J= 1.2 Hz, 2H), 6.23 (s, 1H), 4.21~4.15 (m, 1H);13C NMR (100 MHz, CDCl3)δ(ppm): 142.7, 136.8, 127.2, 125.8, 123.3, 121.7, 120.1, 119.4, 119.0, 60.4; MS (EI)m/z: 361.1 (M+).
3, 3’-二吲哚基-4-喹啉基甲烷(4k)[23]: 红色固体, M.p.: 212~213 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.75 (d,J= 4.4 Hz, 2H), 8.34 (s, 1H), 8.23 (d,J= 8.4 Hz, 2H), 7.74 (t,J= 7.8 Hz, 1H), 7.51~7.42 (m, 4H), 7.26~7.20 (m, 3H), 7.09 (d,J= 7.6 Hz, 2H), 6.73 (s, 1H), 6.59 (s, 2H);13C NMR (100 MHz, CDCl3)δ(ppm):150.7,149.9, 147.75, 136.8, 129.4, 129.3, 127.4, 126.8, 126.7, 124.5, 124.3, 122.2, 121.0, 119.5, 119.4, 117.4, 111.4, 60.5; MS (EI)m/z: 373.1 (M+).
3, 3’-二吲哚基-5-硝基-2-呋喃基甲烷(4l): 浅粉红色固体, M.p.: 98~99 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 8.08 (s, 2H), 7.46 (d,J= 8.0 Hz, 2H), 7.39 (d,J= 8.0 Hz, 2H), 7.27~7.18 (m, 2H), 7.08 (t,J= 8.0 Hz, 2H), 6.94 (d,J= 2.0 Hz, 2H),6.30(d,J= 3.2 Hz, 2H), 5.99 (s, 1H);13C NMR (100 MHz, CDCl3)δ(ppm): 164.5, 136.6, 126.3, 123.5, 122.4, 119.8, 119.2, 114.6, 113.0, 111.4, 110.7, 34.7; MS (EI)m/z:467.1 (M+).
3, 3’-二吲哚基丁烷(4m)[23]:白色固体; M.p.: 63~64 ℃;1H NMR (400 MHz, CDCl3)δ(ppm): 7.82 (s, 2H); 7.74 (d,J= 8.4 Hz, 2H), 7.37 (d,J= 8.0 Hz, 2H), 7.28 (t,J= 7.2 Hz, 2H), 7.16 (t,J= 7.4 Hz, 2H), 6.98 (d,J= 2.0 Hz, 2H), 4.57 (t,J=7.4 Hz,1H), 2.35~2.26 (m, 2H), 1.58~1.48 (m, 2H), 1.07 (t,J= 7.2 Hz, 1H);13C NMR (100 MHz, CDCl3)δ(ppm)136.6, 127.3, 121.7, 121.5, 121.5, 120.5, 119.7, 119.0, 111.2, 38.2, 33.7, 21.5, 14.3; MS (EI)m/z: 288.1 (M+).
1.2.3 二吲哚甲烷衍生物活性测试实验细胞计数后用96孔板铺板(5 000个/孔),按照空白组、对照组、实验组分组,每组设置3个复孔,待细胞培养至贴壁后,弃去原有培养基并用PBS清洗3次.将100 μL培养基加入空白组和对照组的所有孔中,用培养基将待测药物的浓度稀释为100 μg/mL,然后分别取100 μL加入实验组孔中,培养24 h后弃去所有液体,PBS清洗3次,将10 μL CCK-8试剂和90 mL培养基一起加入每个孔中,培养3 h后酶标仪测450 nm处吸光度并计算抑制率.
2 结果与分析
2.1 催化剂制备与表征如图 1所示,三苯基二氯化锑Ph3SbCl2与全氟辛基磺酸银AgOSO2C8F17通过置换反应,可制备得到三苯基锑全氟辛基磺酸盐.通过核磁共振和高分辨质谱对配合物进行表征,如图2所示,证明其结构式为Ph3Sb(OSO2C8F17)2.
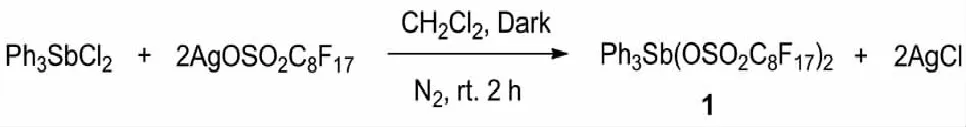
图1 三苯基锑全氟辛基磺酸盐合成路线Fig.1 The synthetic route of triphenylantimony perfluorooctanesulfonate
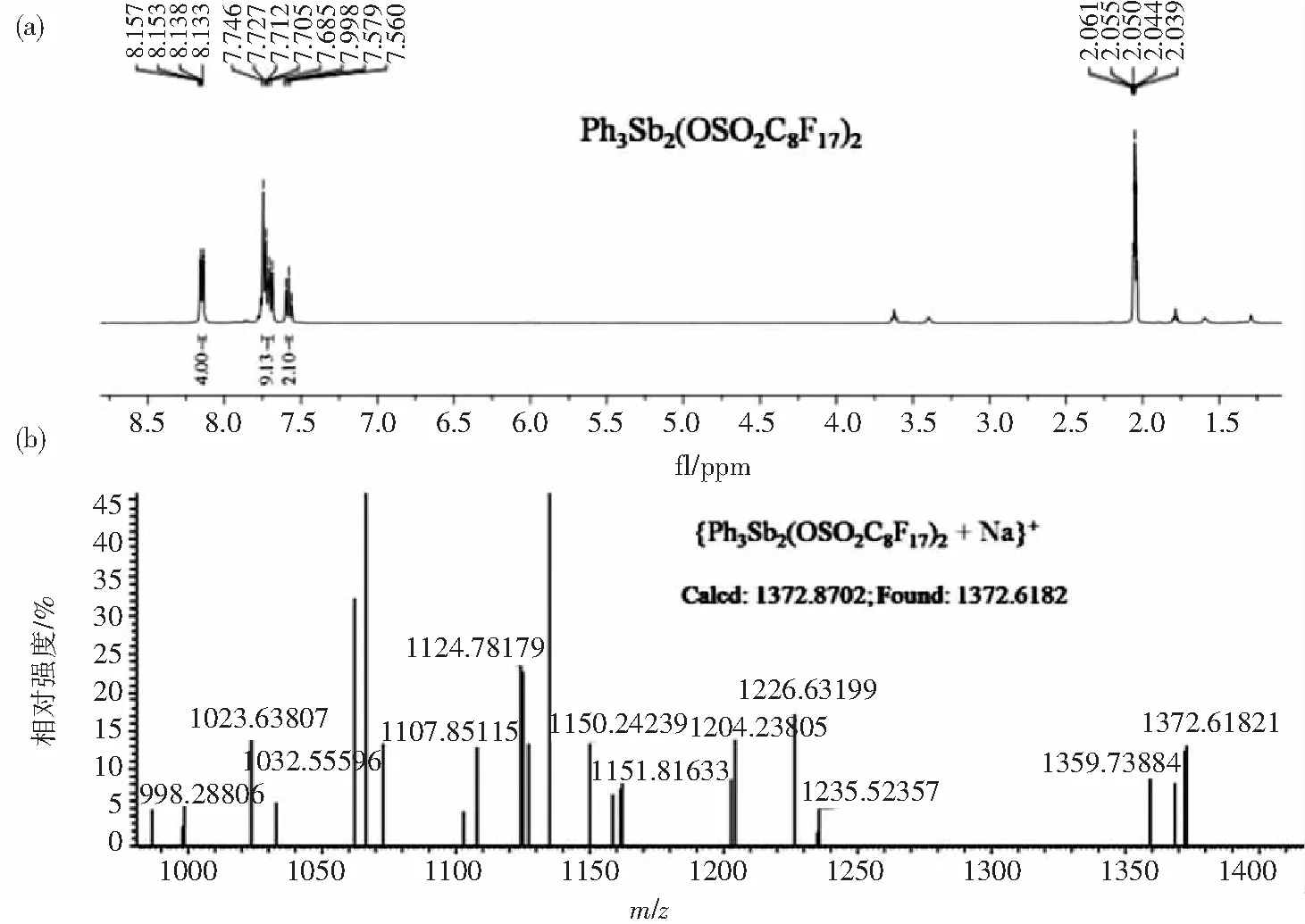
图2 三苯基锑配合物(a)核磁氢谱和(b)高分辨质谱图Fig.2 1H NMR and HRMS spectra of triphenylantimony complex
2.2 催化剂物理性质
三苯基锑全氟辛基磺酸配合物在空气中能够稳定存在三个月以上(核磁氢谱表征结构无变化),通过Hammett(哈密特)指示剂法测试配合物的酸性,酸强为0.8≤Ho≤3.3(Ho 为Hammett 酸强度函数).而Ph3SbCl2的酸强为3.3≤Ho≤4.6,说明引入全氟辛基磺酸基团后,路易斯酸性增强.配合物在极性溶剂,如丙酮、乙醇、乙酸乙酯、乙腈中溶解性较好,而在乙醚,甲苯和正己烷中不溶解.另外,热重分析(TG-DSC)结果表明,如图3所示,配合物具有较高的热稳定性,能够在300 ℃以下稳定存在.
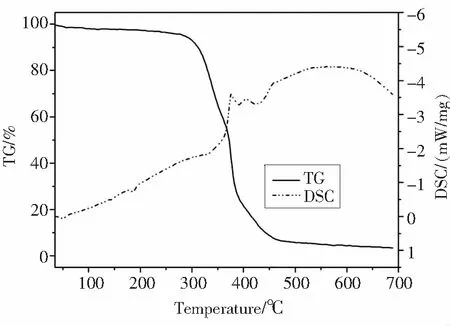
图3 三苯基锑配合物热重分析图Fig.3 TG-DSC of triphenylantimony complex
2.3 三苯基锑配合物催化二吲哚甲烷衍生物合成
2.3.1 反应条件优化以吲哚(2.0 mmol)与苯甲醛(1.0 mmol)的反应作为模型,探究反应的最优条件,结果见表1.由表1可知,缺少三苯基锑催化剂1,没有目标产物生成(entry 1).当催化剂三苯基锑配合物的摩尔分数为2%时,对反应溶剂进行探究.结果表明,THF为溶剂时产率较高,在其他溶剂下产率一般(entries 2~6).可发现,在无溶剂条件下,产率高达95%,反应时间为30 min(entry 7).当进一步缩短反应时间时,产率降低(entry 8).进一步,探究了催化剂用量,发现最佳摩尔分数为2%(entries 9~10).因此,最优条件为:三苯基锑全氟辛基磺酸配合物摩尔分数为2%,无溶剂条件下,室温反应30 min.
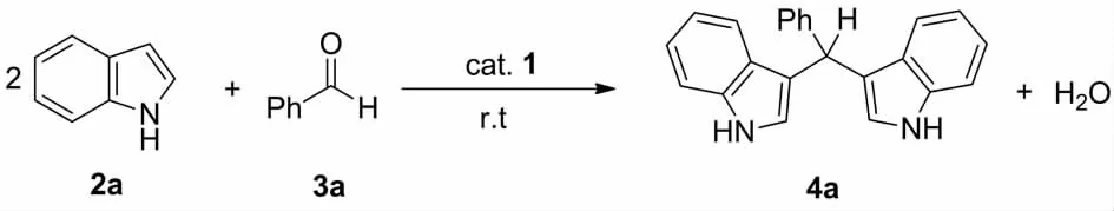
表1 反应条件优化a
2.3.2 三苯基锑配合物催化二吲哚甲烷衍生物合成在最优条件下,探索了催化剂的适用范围,结果见表2.由表2可知,在三苯基锑催化剂作用下,不同取代基的芳香醛均能与吲哚很好地反应,产率为89%~97%.苯环上连有吸电子基团(如Cl、Br、NO2)比连有供电子基团(如CH3, OH)显示了较高的催化活性(entries 2~6,9).取代基吲哚也能够与苯甲醛顺利地发生反应(entries 7~8).含有杂环的芳香醛(如3-吲哚甲醛、4-喹啉甲醛、5-硝基呋喃甲醛)显示了较高活性,均获得较为满意的收率(entries 10~12).此外,脂肪族的正丁醛与吲哚也能够顺利地反应,生成对应二吲哚化合物,产率为90%(entry 13).
表2 Ph3Sb(OSO2C8F17)2催化二吲哚甲烷衍生物的合成a
2.3.3 催化剂重复利用性探究三苯基锑催化剂的重复利用情况.以吲哚(2.0 mmol)与苯甲醛(1.0 mmol)为例,结果见表3.由表3可知:三苯基锑全氟辛基磺酸盐催化剂重复使用5次后,产率仍达到90%,说明三苯基锑配合物具有良好的重复利用性能.

表3 三苯基锑配合物循环利用性a
2.3.4 催化体系比较进一步,比较三苯基锑配合物和其他催化体系对于催化合成二吲哚甲烷的情况.由表4可知,与文献报道的催化剂相比[13-19],三苯基锑催化剂催化合成二吲哚甲烷衍生物具有反应时间短、催化剂量少、无须使用溶剂、催化活性高、能够重复利用等优点.
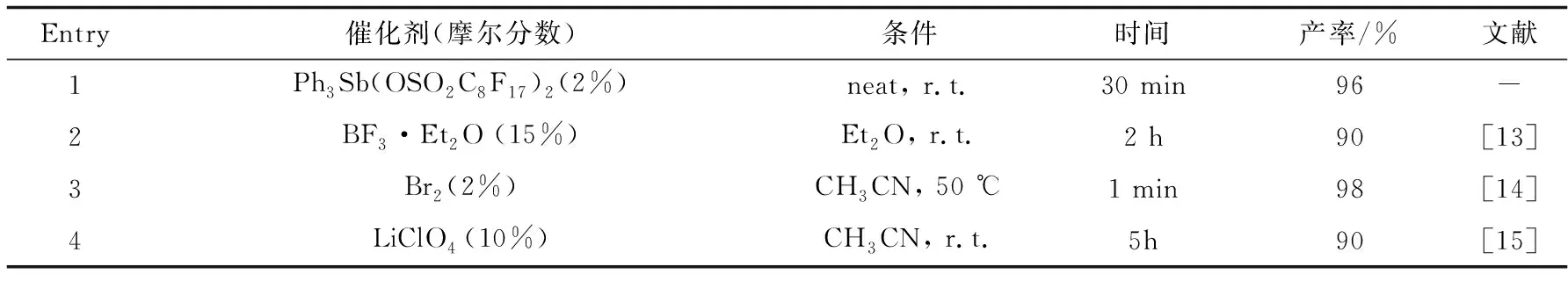
表4 三苯基锑配合物与其他催化剂体系比较a
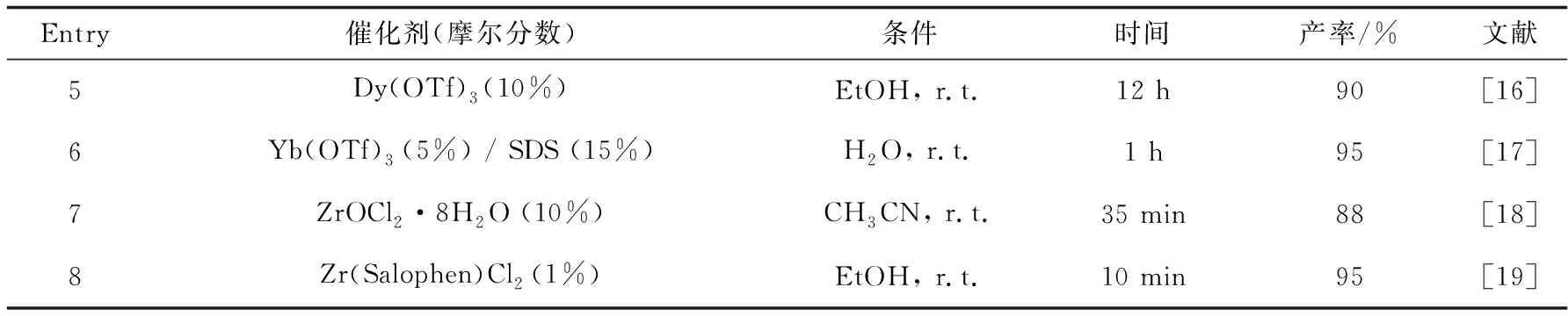
表4(续)
2.4 二吲哚甲烷衍生物活性测试
采用CCK-8法进行了12个二吲哚甲烷衍生物(4a-4m)体外抗肿瘤活性测试.如图4所示,二吲哚甲烷衍生物(100 μg/mL)对两种癌细胞胃癌细胞SGC-7901和结肠癌细胞HCT116均有一定的抑制作用,大多数吲哚衍生物对两种癌细胞抑制率超过50%.对SGC-7901细胞的抑制活性普遍比HCT116细胞抑制活性略大.含有杂环的吲哚基和5-硝基呋喃基的二吲哚化合物4j和4l对结肠癌细胞HCT116抑制效果最好.二吲哚甲烷衍生物的体外抗肿瘤活性和抗癌机制还在进一步研究中.
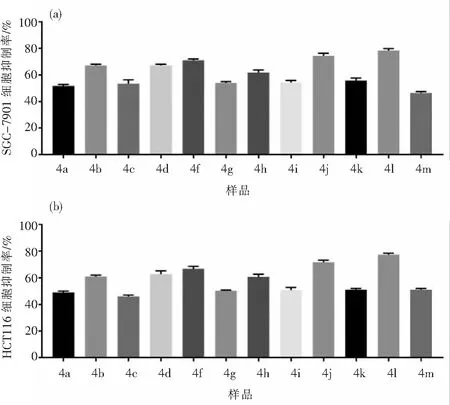
图4 二吲哚化合物体外抗肿瘤活性测试Fig.4 Antitumor activity of bis(indolyl) methane derivatives in vitro
3 结论
本文设计合成了一种对空气稳定和强酸性的三苯基锑全氟辛基磺酸盐配合物,该催化剂能够高效催化吲哚与芳香醛反应制备二吲哚甲烷衍生物.该方法具有条件温和、无须使用溶剂、催化剂剂量少、时间短、产率高和催化剂能够重复利用等优点.此外,二吲哚甲烷衍生物对胃癌细胞SGC-7901和结肠癌细胞HCT116具有一定的抑制作用,尤其是含杂环的二吲哚衍生物显示了较高的活性.总之,上述方法为二吲哚甲烷衍生物的制备提供一条简单有效途径,为生物医药领域提供了重要参考.
