Gattermann反应单因素对苯酚转化率影响的研究
2021-09-30王思宇王相承
王思宇 王相承
(中国人民解放军陆军防化学院,北京 102205)
对羟基苯甲醛(PHB)是重要的精细化工中间体,其合成方法众多,以对甲酚或苯酚为原料的合成路线最为普遍。以对甲酚为原料时,通常采用催化氧化法制得苯甲醛,但因反应过程中氧化程度难以控制,对催化剂、氧化剂的选择要求高,成本较高,在实际应用中存在一定的限制;以苯酚为原料的诸多方法中,如Reimer-Tiemann反应、三氯乙醛缩合法[1]、Vilsmierm法[2]等,也常因设备要求过高、反应条件苛刻、产物分离提纯成本过高等问题,无法转变为经济、环保的工艺路线。
德国化学家路德维希·加特曼[3](Ludwig Gattermann)首次提出了一种利用HCN与芳香族化合物在AlCl3等路易斯酸的催化作用下,生成芳香醛的有效方法[4]。无水条件下,在HCN与苯酚体系通入干燥的HCl气体,再经过水解可制备出芳香醛,如图1所示。随后,Adams[5,6]、Niedzielsky[7,8]等人用相对较安全的氰盐代替了HCN,这种Gattermann反应的改进法能够有效避免剧毒HCN气体对环境造成的污染以及对人员形成的伤害。但改进后的反应产率稍有下降[9]。此法已被证实是利用多种酚类生产一些天然化合物中间体的方法[5]。
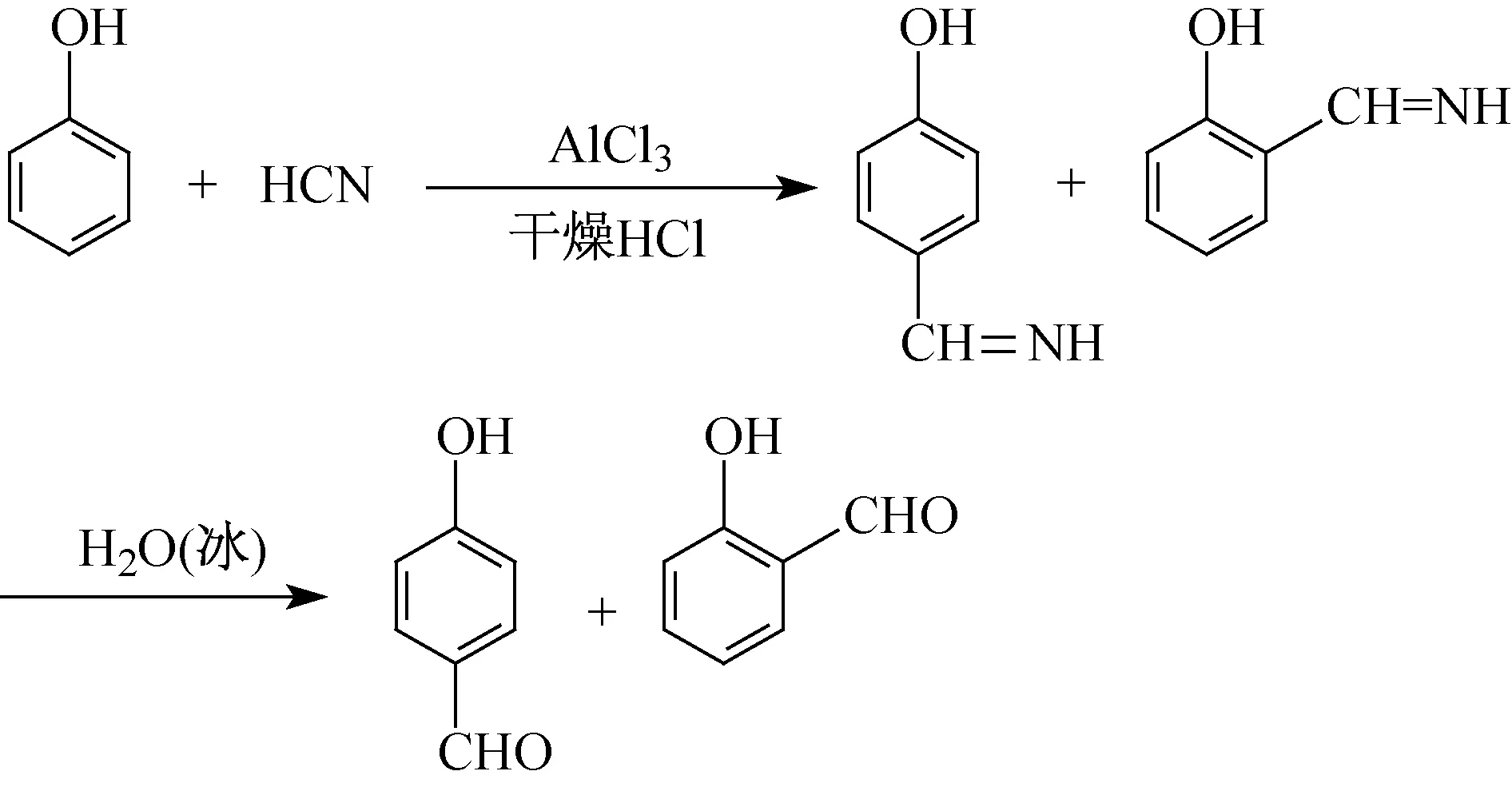
图1 Gattermann反应合成对羟基苯甲醛
Gattermann反应作为一种原料来源广泛、反应条件温和、操作简便且时间短的合成方法,在大规模的工业生产中具有一定的优势与发展潜力。该反应属于气-液-固三相反应,良好的反应条件是三相间有效传质的前提,但是近年来,国内外鲜有相关的实验研究,其单因素条件的影响及动力学问题的研究未见报道,因此,很大程度上限制了Gattermann反应制备芳香醛在国内的工业化应用与发展。本文从反应时间、反应温度、催化剂用量以及反应溶剂四个方面,考察Gattermann反应过程中苯酚的转化率与各单因素之间存在的关系,形成动力学曲线,拟合出动力学方程。通过因素分析,为进一步的催化剂优化研究提供数据支撑。
1 实验部分
1.1 试剂与仪器
苯酚,苯,氯仿,环己烷,氯苯,无水AlCl3(均为分析纯),氢氧化钠,盐酸(北京化工厂),Zn(CN)2(自制),HCl气体(北京兆格气体科技有限公司),机械搅拌器,Agilent6890N气相色谱仪,DF-101S集热式恒温加热磁力搅拌器。
1.2 实验步骤
将一定量苯酚溶于苯中,搅拌下加入Zn(CN)2粉末。冷却条件下,快速通入干燥的HCl气体,搅拌反应,缓慢加入粉末状无水AlCl3,移去冷却装置,继续通入HCl气体,升温至回流反应。气相色谱面积归一化法测定苯酚含量的变化,研究单因素对苯酚转化率的变化规律。
2 实验结果与讨论
本文从反应时间、反应温度、催化剂用量以及反应溶剂四个方面,探究Gattermann反应过程中原料苯酚的含量变化与各单因素之间存在的关系。
图2 Gattermann反应前后苯酚含量变化气相色谱图
2.1 反应时间与苯酚转化率
基本操作步骤不变,回流温度控制在65 ℃左右,无水AlCl3用量为苯酚摩尔数的1.5倍,探究反应时间t(h)对苯酚转化率α的影响,如图3所示。
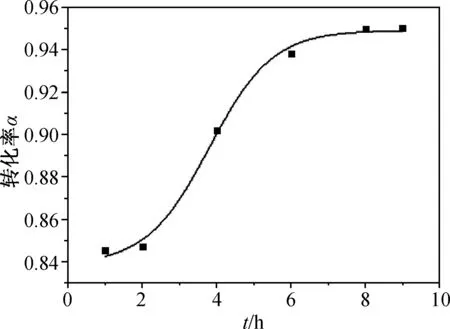
图3 反应时间对苯酚转化率的影响
由图3得到,加入催化剂后2 h内,反应进行缓慢,2 h 后苯酚转化率迅速升高,4 h时反应速率达到最大,8 h 后原料苯酚转化程度达到最大。由此拟合出苯酚转化率α与反应时间t(h)的动力学方程:
某基本符合Boltzmann函数。
Gattermann反应的速率在2 h内较小,主要是因为Zn(CN)2从固态转化为离子态CN-需要一定的时间,2 h后HCl与CN-在体系中达到一定的浓度,在无水AlCl3的催化作用下,发生迅速的亲核取代反应,此时速率明显增加,反应物形态与颜色也明显发生变化。8 h后原料基本消耗完毕,Zn(CN)2完全转变为ZnCl2,反应开始减缓。
2.2 反应温度与苯酚转化率
基本实验操作下,反应时间为6 h,无水AlCl3用量仍保持苯酚摩尔数的1.5倍,改变反应温度T(℃),探究对苯酚转化率α可能存在的影响。如图4所示。
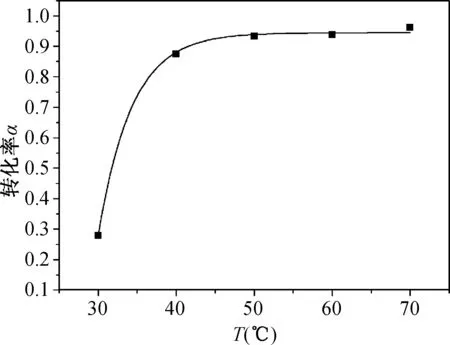
图4 反应温度对苯酚转化率的影响
由图4能够得到,常温条件下该反应进行缓慢,当反应温度达到30 ℃以上时,反应速率迅速增加,50 ℃ 以上更有利于反应进行,苯酚转化率达到最高。由以上曲线拟合出温度T(℃)与苯酚转化率α之间存在的动力学方程:
反应温度的上升虽然能够在一定程度上提高苯酚的转化速率,但是,温度升高至70 ℃以上时,AlCl3引发的聚合与缩合副反应的趋势增加。同时,快速通过的HCl气流极易将反应溶剂带出,NaOH尾气吸收液面明显出现有机溶液分层,溶剂的流失影响了反应环境,进而影响到苯甲醛的产率,因此反应温度一般不宜超过70 ℃[10]。
2.3 无水AlCl3用量与苯酚转化率
保证基本实验操作,回流温度保持65 ℃左右,反应4 h,不同用量的催化剂AlCl3能够实现不同的反应效果。图5是催化剂用量与苯酚转化率α的动力学曲线,λ表示催化剂用量的当量值,λmol当量即表示1 mol苯酚使用了λmol的催化剂(以下所有有关当量的表述均为此含义)。
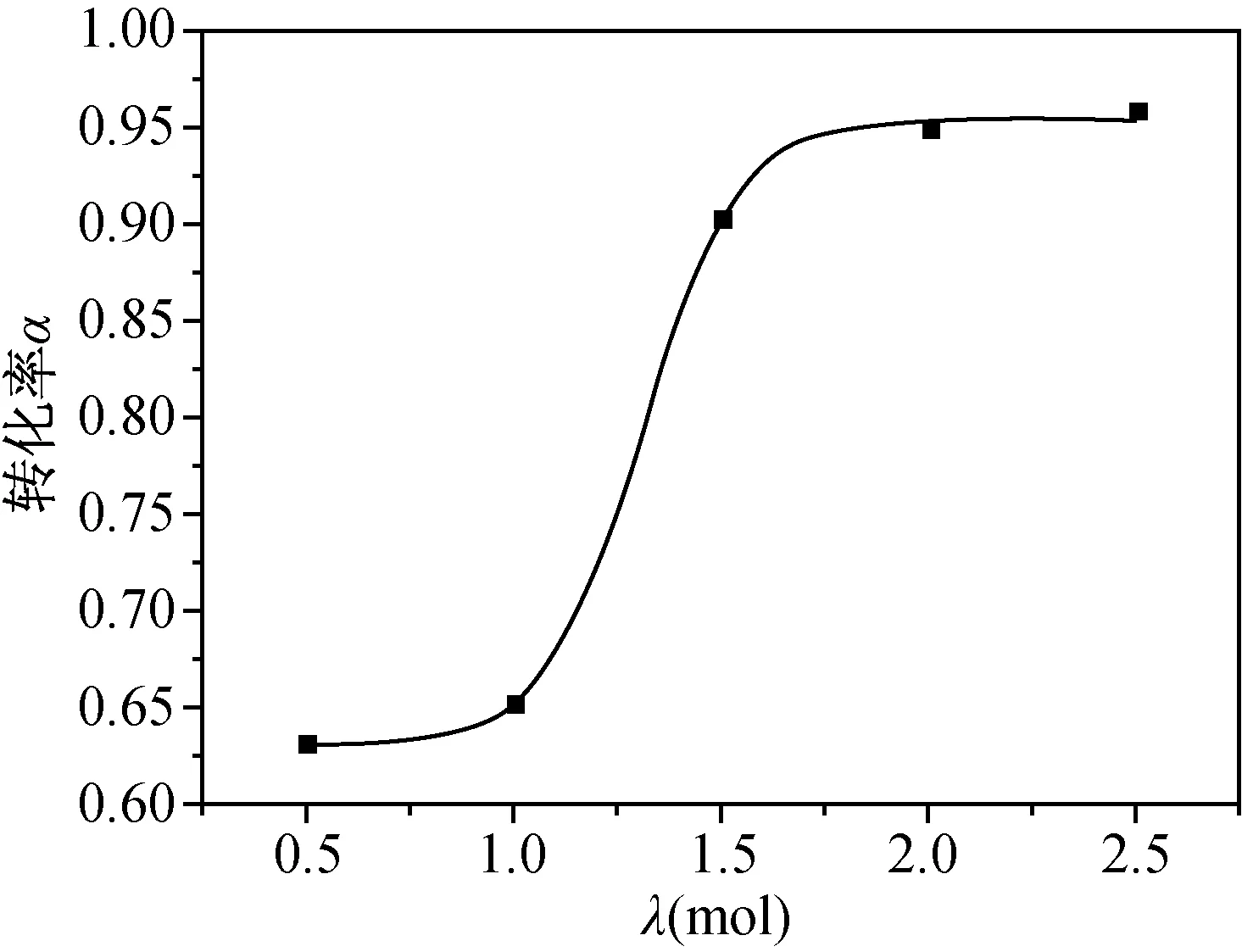
图5 催化剂用量与苯酚转化率的关系
由图5拟合出催化剂用量与苯酚转化率α关系的动力学方程:
嘉善田歌,作为我国一种原生态歌唱艺术和一项音乐类非物质文化遗产,也面临自然界“物种锐减濒危”的考验。在一份关于嘉善田歌认知度调查报告中显示,在当地虽被80%受访者所知,但只有不足4%会唱[1]。可见嘉善田歌在大众生活中已渐行渐远,面临着失传危机,保护它可谓是任重而道远。通过对田歌的活态现状、生存环境和价值进行调研和分析,就嘉善田歌如何在全球单一化、科技一体化、网络信息化和经济高速化大背景下传承发展进行了一些整理和思考。
当无水AlCl3用量为0.5 mol当量(λ=0.5)时,反应物能够伴随溶剂均匀搅动,经气相色谱面积归一化数据分析,苯酚转化率仅有63.1%,反应不完全;当AlCl3用量达到1 mol当量(λ=1)时,加热过程中,反应物会发生严重的聚合现象,搅拌后呈现出粘性较强的泥状物质,极易附着于反应瓶壁,无法伴随溶剂搅动,苯酚转化率受到影响;当AlCl3为1.5 mol当量(λ=1.5)时,常温下,反应物聚合现象不明显,但苯酚转化率仅27.9%,若反应温度直接升温至70 ℃左右,搅拌不当反应物依旧形成粘性泥状物质并附着于瓶壁无法搅动,导致催化效果不佳,苯酚转化率为61.6%,增大搅拌速率,防止反应物附着于瓶壁无法搅动,转化率能够增加到90.2%;当AlCl3用量为2~2.5 mol当量(λ=2~2.5)时,升温过程中,反应物不再出现聚合现象,始终保持细粉末态在溶剂中均匀搅动,此时的催化剂能够始终保持非结合态存在于体系,催化效果达到最大,4 h苯酚转化率达到95.9%,反应10 h时转化率高达96.1%。
反应过程中发生的聚合现象很可能是由于AlCl3、Zn(CN)2和HCl形成了络合物AlCl3·NH=CH-N=CHCl,在反应热以及游离AlCl3的共同作用下,发生解离形成中间体盐酸酰亚胺Ar-CH=NH·HCl,也存在于这种络合体系中[6,8],最终能够在10%的冰盐酸中水解生成醛。
2.4 溶剂对Gattermann反应的影响
有文献采用氯仿代替苯作为Gattermann反应的溶剂,也能够实现多种酚类较好的转化[5]。在其他条件不变的情况下,将反应溶剂由苯分别替换为氯仿、环己烷、氯苯,反应时间4 h,现象有明显不同。
以氯仿为溶剂时:体系保持快速回流,反应起始,原料快速集聚呈土黄色,漂浮在溶剂表面。反应4 h后,浮于液面的聚合物逐渐消失,溶剂底部呈现棕黄色颗粒状物质,部分颗粒变黑,考虑是产生了焦油等其他副产物。
以环己烷为溶剂时:由于苯酚在环己烷中的溶解度远不如在苯等溶剂中的溶解度,冷却体系通入HCl气体时,反应的固-液体系变成了浆糊状粘稠体系,考虑是苯酚在冷却下从环己烷中析出,与Zn(CN)2固体混合所致,经过充分搅拌,浆糊状态逐渐消失,加热反应后,浆糊状态彻底消失,3 h左右反应物开始出现少量集聚,并产生少量肉粉色泥状物质附着于瓶底。
以氯苯为溶剂时:反应物不溶于溶剂,前3 h能够均匀地在溶剂中搅拌,约3 h后,反应物在溶剂中出现聚合,搅拌不再均匀,伴随少量橙色的泥状物质产生,并附着在反应瓶底部。
对于不同溶剂的Gattermann反应,采用气相色谱面积归一化法,苯酚转化率情况见下表1。
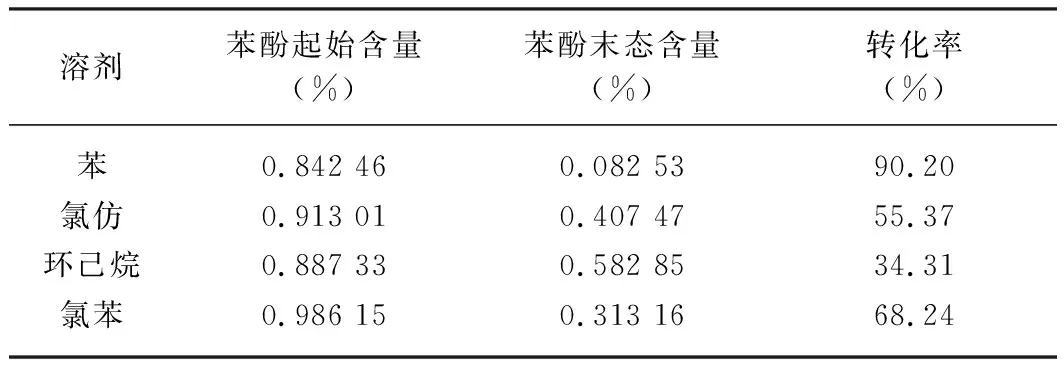
表1 溶剂对苯酚转化率的影响Tab. 1 Effect of solvent on phenol conversion
由表1能够看出,改用极性溶剂氯苯、弱极性溶剂氯仿或环己烷等作为Gattermann反应的溶剂时,苯酚的转化率明显都要低于以苯为溶剂。
现象对比:以苯为溶剂时,体系加热后1 h内反应物发生聚合,并完全形成泥状物质,充分反应4 h后,反应物呈棕色;以氯仿为溶剂时,聚合物状态不同,并产生较多的深色副产物;以环己烷或氯苯为溶剂时,反应3 h后才出现少量聚合的泥状物质,4 h后反应物颜色仍然较浅。
结果分析:以氯仿为溶剂时,苯酚的转化率低;以环己烷、氯苯为溶剂,反应物聚合现象出现较晚,加热4 h后的反应物颜色仅有微小变化。
综上所述,以苯作为Gattermann反应的溶剂是很有必要的,采用其他极性或弱极性溶剂均实现不了苯酚很好地转化。这主要是因为一元酚的活性远远不如多元酚等其他酚类物质,以一元酚和Zn(CN)2作为原料时,其反应环境和溶剂条件都比其他酚类严格[11],使用除苯以外的溶剂更易发生其他副反应。
3 结论
本文针对Gattermann反应单因素对原料苯酚转化率的影响进行研究,采用面积归一化法,得到不同条件变量与苯酚转化率之间的变化规律,结果表明:反应温度65 ℃,总反应时间10 h,苯作为溶剂,无水AlCl3为催化剂,用量为苯酚用量的2.5倍,在以上条件下进行Gattermann反应,苯酚转化率可达96.1%。
在严格的无水条件下,使用大量AlCl3作为催化剂时,反应物不会出现聚合现象,催化剂始终以非结合态存在于反应体系,可保持良好的催化效能,进而提高苯甲醛产率[12]。
对Gattermann反应的深入了解仍需进行大量的实验研究与数据支撑。目前,AlCl3在Gattermann反应中处于至关重要的地位,其用量的多少直接影响到苯酚的转化率。但是,AlCl3作为催化剂具有明显的缺陷,大量使用不利于回收和后处理,对环境造成巨大损害。因此,在研究Gattermann反应单因素影响与最佳工艺条件的同时,还需进一步探索可循环、更环保的催化剂,为最终确定出一条路线简捷、收率高、成本低、三废易于治理、更适合规模化生产的工艺路线奠定良好的基础。
