CDK4/6抑制剂在泌尿系肿瘤中的研究进展
2021-09-30申正超顾鹏柯坤彬
申正超 顾鹏 柯坤彬
膀胱癌(bladder cancer, BC)、前列腺癌(prostate cancer, PCa)和肾癌(renal cell carcinoma, RCC)是泌尿系统中最常见的恶性肿瘤,其发病率与死亡率逐年上升[1]。近年来,靶向治疗为癌症患者提供了新的治疗选择。细胞周期是大多数致癌信号通路的下游,因此靶向细胞周期蛋白颇具治疗前景。第1代细胞周期蛋白依赖性激酶(cyclin-dependent kinases, CDK)抑制剂是非选择性的,可以抑制多个CDK,这导致疗效有限以及毒副作用大。第2代周期蛋白依赖性激酶4和6(cyclin-dependent kinases4/6, CDK4/6)抑制剂帕博西尼、瑞博西尼和阿贝西尼,对CDK4/6具有较高的亲和性,可导致G1期阻滞和肿瘤生长抑制[2](图1)。在对第2代CDK4/6抑制剂的临床前研究中,发现其与雌激素拮抗剂具有协同抑制乳腺癌细胞系的作用[3]。这项工作促进了对CDK4/6抑制剂在乳腺癌中的广泛临床研究。迄今为止3种CDK4/6抑制剂皆获批准用于雌激素受体阳性、人表皮生长因子受体-2阴性进展期乳腺癌的一线、二线治疗,并逐渐取代传统化疗方案[4-7]。此外,CDK4/6抑制剂已经在肝癌、肺癌、PCa以及BC等多个实体肿瘤中进行临床试验。本文就细胞周期在各泌尿系肿瘤发病过程中的作用以及CDK4/6抑制剂治疗进展做一综述。
一、CDK4/6概述
CDK4/6是脯氨酸导向的丝氨酸/苏氨酸激酶的一个保守家族,两者在结构上有71%的同源性,并且大部分功能重叠。在细胞周期中,G1期是关键的调控检查点,决定细胞是否进入S期并继续进行有丝分裂,其进程受CDK4/6调控。CDK4/6通过与CyclinD结合,形成CyclinD-CDK4/6复合体,该复合体选择性地磷酸化视网膜母细胞瘤蛋白(retinoblastoma, RB),使其失去活性,导致转录因子E2F激活,以促进DNA复制和有丝分裂进程,从而介导静止细胞从G1期转变向S期[8](图1)。研究发现,在细胞周期中CDK4/6-CyclinD复合体活性升高与癌症的发病密切相关,其中包括多种机制,如p53失活与RB突变、CyclinD过表达、CDK4/6突变或扩增以及CDK4/6抑制基因(如p16INK4A)丢失[9-10]。最近的研究还表明,CDK4/6具有细胞周期以外的生物学作用,如CDK4和CDK6通过分别影响VEGF-B和VEGF-A,从而参与血管生成的调控[11]。还有学者证明CDK4/6通过激活NF-κB通路来调节炎症细胞因子的表达[12]。CDK4/6还与DNA修复[13]、衰老[14]和代谢[15]有关。
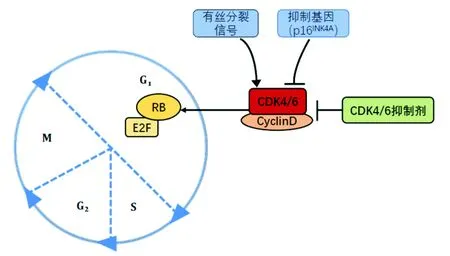
图1 细胞周期通路示意图
二、BC
1.细胞周期在BC发病中的作用及其机制:BC是最常见的泌尿系统恶性肿瘤之一,在全世界癌症发病率中排第9位,有75%的病例发生于男性,发病高峰50~70岁[16]。研究发现细胞周期失调在肌层浸润性膀胱癌患者中的发生率约为93%,在肿瘤的发生中起重要作用[9]。CDK4位于染色体12q13-q15区,通过荧光原位杂交筛选发现6.4%的BC单独扩增了CDK4[17]。并且在BC基因组筛查中发现,RB基因失活或其他基因的突变将导致RB蛋白功能缺失[9]。细胞周期蛋白的改变也与BC发病相关,CyclinD1在大约67%的BC中过表达,并且与疾病进展相关。而编码CyclinD1的CCND1基因扩增发生在大约10%的BC标本中,而其抑制基因p16INK4A在47%的标本中丢失,在41%的标本中基因扩增,并且与BC患者不良预后、总生存期缩短相关[18-19]。CyclinD1的亚型CyclinD1b在正常组织中几乎没有表达,但在BC、PCa和乳腺癌等肿瘤中高表达[20]。下调CyclinD1b能促进BC细胞凋亡,并且抑制裸鼠体内肿瘤生长[21]。Gennaro等[22]发现去泛素化酶USP22可直接去除CCND1基因(编码CyclinD1)赖氨酸残基端的泛素链,使其免受蛋白酶体介导的降解,因此USP22在BC中高表达而使CyclinD1积累,导致癌症发生。以上说明CDK4/6-RB通路是治疗BC的合理靶点。
2.CDK4/6抑制剂在BC中的研究:理论上CDK4/6抑制剂仅在RB阳性细胞中展现抗肿瘤活性,但最近研究显示,在多株BC细胞系中,无论其RB1表达状态如何,CDK4/6抑制剂在体内和体外都具有抗肿瘤活性[23],类似的现象也发现在卵巢癌中[24]。Zhang等[25]在T24膀胱癌细胞中发现帕博西尼阻断pRB后并没有导致细胞周期阻滞,而是通过激活CDK2,诱导线粒体靶向性的磷酸化Rad9积累,最终导致细胞凋亡。由此说明CDK4/6抑制剂在BC中的具体机制仍不清楚,仍需进行更深一步的研究。最近一项临床前研究发现帕博西尼联合免疫检查点抑制剂可有效抑制小鼠肿瘤生长,延长总体生存期,并且在肿瘤组织中诱导T细胞浸润[26]。在临床试验中,一项评估帕博西尼单独治疗转移性铂类耐药尿路上皮癌患者的Ⅱ期临床试验(NCT02334527)中,筛选了12例RB阳性、p16缺失的患者,其中只有2例(17%)无进展生存期(progression-free survival, PFS)达到4个月,中位PFS为1.9个月,中位总生存期为6.3个月。其主要副作用包括贫血、白细胞以及淋巴细胞减少。该试验因未能达到主要终点而终止研究[27]。另一项临床试验表明,新型抗叶酸药物普拉曲沙联合帕博西尼治疗BC可以减少患者恶心、呕吐等不良反应,其机制可能与抑制新血管形成有关[28]。以上结果表明,CDK4/6抑制剂作为单一药物可能在BC中不会诱导长期缓解,因此需要进一步研究CDK4/6抑制剂与其他药物联合的治疗模式。
三、PCa
1.细胞周期在PCa发病中的作用及其机制:PCa是老年男性最常见的肿瘤,2018年全世界约有130万确诊病例,导致近36万人死亡[29]。虽然约80%新确诊的前列腺肿瘤生长局限而缓慢,患者总生存率高,但晚期或转移性PCa生存率显著下降,5年生存率仅为26%~30%[30]。转移性PCa的主要治疗手段是雄激素剥夺疗法(androgen deprivation therapy, ADT),在使用该治疗方法后的2~3年内疗效很好,但随后由于雄激素受体信号通路变化,大多数患者将转变为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)[31]。针对此类患者,现有的治疗方法疗效有限。因此,了解PCa的发生以及耐药机制有助于提高对PCa治疗的研究。
雄激素与其受体可以通过直接影响关键细胞周期调控蛋白的基因表达水平,诱导细胞周期的进展,从而导致PCa发生。研究证实在PCa中,细胞周期突变与患者不良预后相关[32]。研究表明44%的PCa患者过表达CDK6[33]。Remo等[34]发现PCa组织中的p16基因表达高于正常组织,并且在前列腺穿刺活检中具有极高的诊断价值,预测阳性率近74%。CyclinD1在近20%的患者中表达升高,Pal等[35]研究CRPC患者血液中循环肿瘤细胞,发现CyclinD参与了CRPC患者对恩杂鲁胺治疗的耐药形成,靶向CDK4/6-RB通路将为雄激素耐药患者提供新的治疗选择。
2.CDK4/6抑制剂在PCa中的研究:考虑到CDK4/6抑制剂联合雌激素拮抗剂在乳腺癌中的成功应用,因此研究CDK4/6抑制剂与雄激素受体拮抗剂或化疗等药物的联合疗法在治疗PCa中极具前景。临床前研究发现CDK4/6抑制剂在激素敏感和去势抵抗的情况下可抑制PCa细胞株的增殖,并且与单独使用放疗相比,帕博西尼联合放射治疗将产生协同抗肿瘤效应[36]。加拿大正在进行一项帕博西尼治疗转移性CRPC的Ⅱ期单臂临床试验(NCT02905318),该临床试验将评估CyclinD扩增和RB1的状态,并研究两者与治疗反应之间的关系。一项Ⅱ期临床试验评估局部高风险PCa患者使用瑞博西尼的药效学,研究者预计在根治术前服用瑞博西尼将使30%以上的患者活检组织中Ki-67指数降低50%[37]。在RB阳性的PCa患者的临床试验中,正在评估瑞博西尼联合雄激素拮抗剂(NCT02059213)或化疗(NCT02555189)的疗效。此外,两种新型CDK4/6抑制剂G1T28和G1T38在CRPC相关动物模型中证明了其抗肿瘤作用,并且不会导致明显的骨髓抑制,该型新药物有待于临床试验中进一步评估其治疗晚期PCa患者的疗效[38]。
四、RCC
1.细胞周期在RCC发病中的作用及其机制:RCC在泌尿系肿瘤中发病率仅次于PCa和BC,在美国男性和女性新增癌症病例中分别排名第6和第8位[28]。随着影像学技术的提高及人们健康意识的提高,人群中早期的RCC患者更容易被发现,但仍有高达30%的患者在诊断时已经发生远处转移[39]。并且在早期局部肿瘤患者中,接受部分或全肾切除术后仍有20%~30%的患者最终会发展为转移性肾细胞癌[40],此类患者预后较差。因此迫切需要新的治疗手段。
CDK4/6是RCC的一个重要靶点。研究发现50%~75%的RCC组织中CyclinD1表达水平高于正常肾组织[41-42]。Wang等[43]发现在透明肾细胞癌中CyclinD1的mRNA和蛋白水平升高,并且与肿瘤不良预后及复发相关。并且p16INK4A抑癌基因在RCC中经常失活。p16INK4A基因失活最常见的机制是CpG岛区域的启动子高甲基化,导致基因发生显著的转录抑制。一项研究显示,p16INK4A基因高甲基化发生于20%的RCC中,并且是RCC预后的独立预测因子[44]。Hedberg等[45]使用免疫组化研究发现216例RCC患者中有95%的患者pRb表达呈阳性,并证实RB基因很少在肾细胞癌中发生突变。这表明在RCC中细胞周期进展仍依赖于RB,因此CDK4/6抑制剂是治疗RCC的可行候选药物。
2.CDK4/6抑制剂在RCC中的研究:Logan等[46]首次评估CDK4/6抑制剂帕博西尼在25种RCC细胞株中的抗增殖作用,研究发现帕博西尼在纳摩尔浓度范围内即可抑制细胞生长,在G0/G1期阻断细胞周期并诱导晚期细胞凋亡。另一项研究发现阿贝西尼可通过抑制CDK4/6与PIM1激酶导致RCC细胞发生自噬和凋亡,在动物模型实验中联合VEGF抑制剂舒尼替尼可抑制肿瘤生长[47]。Chen等[48]发现瑞博西尼可以显著抑制大部分RCC细胞系中RB的磷酸化,并发现瑞博西尼与化疗和免疫治疗药物在体内体外具有协同作用。一项Ⅰ期临床试验(NCT03905889)正在研究阿贝西尼联合舒尼替尼在转移性RCC患者中的疗效。以上研究证实第二代CDK4/6抑制剂在RCC中颇具前景,但与其他药物协同效应的具体机制及其运用于临床RCC患者中的实际疗效有待行进一步研究。
五、总结及展望
随着人们对细胞周期信号通路机制的不断探索,研究发现CDK4/6通路参与泌尿系肿瘤的发生和发展,其机制主要是通过上游分子突变或调控因子失活导致CDK4/6-CyclinD复合体过度活跃,使细胞不受调控的增殖,最终导致肿瘤形成[49]。因为CDK4/6-CyclinD位于大多数信号通路的下游,靶向该通路可能将防止肿瘤在治疗过程中产生耐药性。多项临床前研究表明CDK4/6抑制剂阻断CyclinD-CDK4/6-RB通路后,BC、PCa和RCC细胞的增殖受到抑制。尽管CDK4/6抑制剂在体外实验中取得不错的进展,但在临床试验中的结果表明单一使用并不能取得良好的疗效。鉴于CDK4/6抑制剂联合治疗模式成功应用于乳腺癌,在泌尿系肿瘤中联合使用CDK4/6抑制剂与现有药物最有可能产生满意的临床疗效。因此,需要更多的临床前研究深入探索CDK4/6抑制剂联合其他药物的效果及功能,并在临床试验中发现可靠的生物预测指标,从而筛选治疗敏感人群,制订个性化的治疗方案,为晚期泌尿系统肿瘤患者带来新希望。
