超高效液相色谱串联质谱法测定豆类食品中的游离神经递质类氨基酸
2021-09-29宋学英
罗 葵,宋学英
(首都医科大学中心实验室,北京 100069)
神经递质类氨基酸是人体内的重要组成物质,参与各种代谢途径,可通过调控中枢神经元的兴奋或抑制,参与神经元信息传递、认知、学习和记忆等过程[1−2]。据文献[3−7]报道,神经递质类氨基酸主要有甘氨酸、γ-氨基丁酸、谷氨酸、谷氨酰胺、天冬氨酸和天冬酰胺等,可分为兴奋性和抑制性两类,兴奋性神经递质类氨基酸包括谷氨酸和天冬氨酸等,抑制性神经递质类氨基酸包括γ-氨基丁酸和甘氨酸等。γ-氨基丁酸和谷氨酸参与调节学习和记忆过程[8−9],γ-氨基丁酸还能改善睡眠和预防抑郁[10−11],天冬氨酸与智能、情绪和警觉性有关[12],甘氨酸对传递痛觉信息、加工听觉信息和处理传感信号必不可少[13]。谷氨酰胺在神经传递中的主要作用是参与谷氨酸/γ-氨基丁酸-谷氨酰胺循环,可缓解疼痛和治疗抑郁等[14]。天冬酰胺可通过天冬酰胺合酶由天冬氨酸合成,该酶的缺陷会导致大脑结构异常和认知障碍[6]。
神经递质类氨基酸不仅在神经系统中发挥着重要的作用,在非神经系统中也有重要的生理意义。γ-氨基丁酸能调节免疫[15]、保护和改善胰岛功能[16−18]。谷氨酸在体内外调节肝细胞群的共同节律[19]。甘氨酸参与保护心血管功能[20]。谷氨酰胺参与免疫调节[21]。
人类饮食不仅直接影响身体状况,也会影响大脑功能和精神状态[22]。食品是神经递质类氨基酸的天然来源,饮食调整和补充在神经疾病等许多疾病的治疗中有积极的作用[23]。神经递质类氨基酸广泛存在于食品中,其中黄豆、黑豆、红小豆和绿豆等豆类食品不仅含有丰富的神经递质类氨基酸,同时也是人们膳食中普遍常见且不可缺少的部分[24]。因此,建立黄豆、黑豆、红小豆和绿豆这4种豆类食品中神经递质类氨基酸的检测方法非常有必要。
目前,氨基酸和神经递质的检测方法主要有高效液相色谱(HPLC)法[25−27]、液质联用(LC-MS)法[28−30]、电化学法[31]、氨基酸自动分析仪法[32−33]、离子色谱法[34]、气质联用(GC-MS)法[35−36]等。其中,液相色谱法和气质联用法检测氨基酸需要做柱前衍生化处理,前处理过程复杂,而氨基酸自动分析仪法耗时比较长。因此,本文在已有的文献研究基础上,简化前处理方法,优化仪器测定条件,建立豆类食品中神经递质类氨基酸的检测方法,以期为豆类食品的质量控制提供技术支持。
1 材料与方法
1.1 材料与仪器
黄豆、黑豆、红小豆和绿豆 产地均为山东,购于市场;乙酸铵、甘氨酸(glycine, Gly)、谷氨酸(glutamate, Glu)、谷氨酰胺(glutamine, Gln)、天冬氨酸(Aspartic acid, Asp)、天冬酰胺(Asparagine,Asn)和γ-氨基丁酸(Gamma aminobutyric acid,GABA)
美国Merck公司,纯度≥98%;甲醇、乙腈、甲酸
美国Fisher公司,色谱纯。
1290超高效液相色谱仪 美国Agilent公司;Qtrap 6500三重串联四极杆质谱仪 配有电喷雾离子源(ESI)、Analyst采集软件及Multi Quant数据处理软件,美国AB SCIEX公司;MS204型电子天平
梅特勒-托利多仪器(上海)公司;MS3 Digital涡旋混匀器 德国IKA公司;Fresco21离心机 美国Thermo Scientific公司;KQ-500E超声波清洗器(功率500 W,频率40 kHz,昆山市超声仪器有限公司;Milli-Q型超纯水机 美国Millipore公司。
1.2 实验方法
1.2.1 标准溶液的配制 分别称取适量的甘氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺和γ-氨基丁酸标准品用超纯水配制成1 mg/mL单标标准品储备液,储存于4 ℃冰箱中。取适量各标准储备液,用超纯水稀释成0.5 mg/mL混合标准溶液,用于绘制标准曲线。
1.2.2 液相色谱条件 色谱柱:Agilent Zorbax SBAq RRHT(3.0 mm×100 mm, 1.8 μm);柱温:25 ℃;流速:0.3 mL/min;进样量:1 μL。流动相为:A为0.5 mmol/L乙酸铵水溶液,B为甲醇;梯度洗脱程序:0~1 min, 30% B;1~2 min,30%~90% B;2~3 min,90% B;3~4 min,30% B。
1.2.2.1 色谱柱的选择 分别使用SB-C18(2.1 mm×100 mm, 1.8 μm)、Zorbax SB-Aq RRHT(3.0 mm×100 mm, 1.8 μm)和Eclipse Plus C18RRHD(2.1 mm×100 mm, 1.8 μm)三种不同的色谱柱对1 μg/mL的甘氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺和γ-氨基丁酸混合标准品溶液进行检测,考察色谱柱对目标化合物的分离效果及峰形的影响。
1.2.2.2 流动相的优化 首先分别使用水-甲醇和水-乙腈作为流动相进行检测,考察对目标化合物响应强度的影响,然后分别使用0.1%甲酸水溶液-甲醇、0.5 mmol/L乙酸铵水溶液-甲醇作为流动相进行检测,考察对目标化合物分离度和峰形的影响。
1.2.2.3 柱温的选择 分别使用20、25、30、35、40、45 ℃柱温进行检测,考察柱温对目标化合物响应强度的影响。
1.2.3 质谱条件 离子源:电喷雾电离源(ESI);扫描方式:正离子扫描;监测模式:多反应监测(MRM);离子源温度:550 ℃;离子化电压:4500 V;雾化气(N2)压力:55 psi;气帘气(N2)压力:35 psi;辅助加热气(N2)为55 psi;各目标化合物的质谱参数见表1。
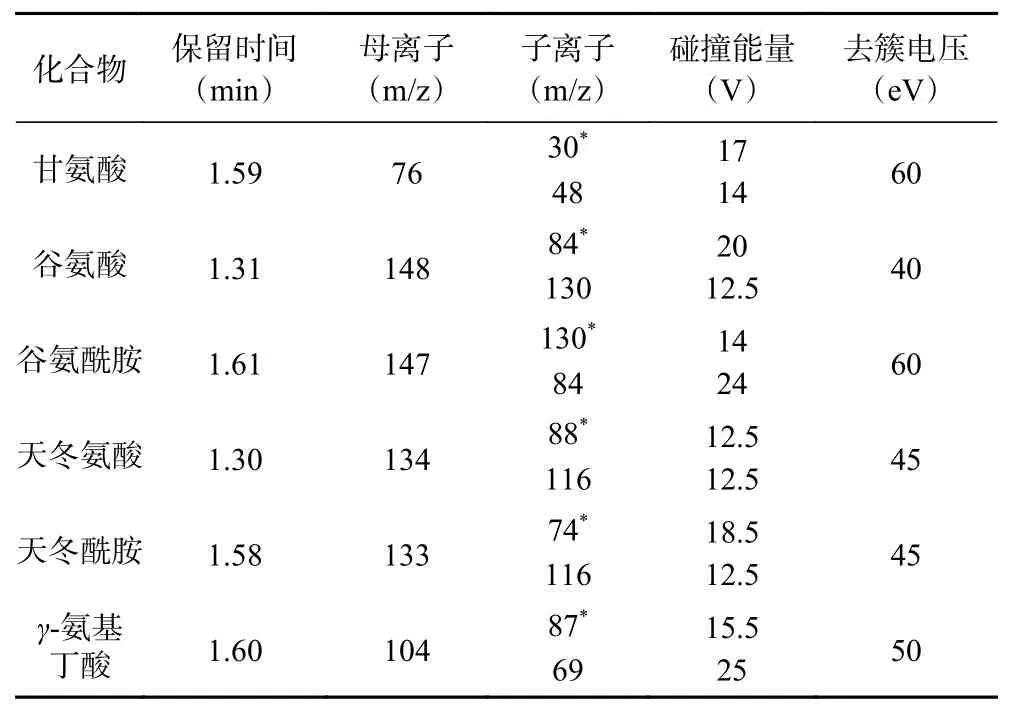
表 1 6种神经递质类氨基酸的质谱采集参数Table 1 MS acquisition parameters of 6 neurotransmitter amino acids
1.2.4 样品前处理 在相关文献的研究[37−39]基础上,采用水作为溶剂,超声提取目标化合物。分别称取粉碎后过60目筛的黄豆、黑豆、红小豆和绿豆粉末2.5 mg于1.5 mL离心管中,加入1 mL超纯水,涡旋混匀后,超声提取30 s,以13500 r/min离心10 min,取上清液经0.22 μm滤膜过滤,供UPLCMS/MS分析。
1.2.4.1 提取料液比的优化 分别称取2.5、5、10、20、50、80 mg豆类食品粉末,加入1 mL超纯水,混匀,超声提取30 s,过0.22 μm滤膜后,进样检测。
1.2.4.2 超声提取时间的优化 称取2.5 mg豆类食品粉末,加入1 mL超纯水,混匀,分别超声提取10、20、30、60、120、300、600、1200 s,过0.22 μm滤膜后,进样检测。
1.2.5 方法学验证
1.2.5.1 线性关系、检出限与定量限的测定 配制浓度为1、2、5、10、20、50、100、200、500、1000、2000 μg/L的6种神经递质类氨基酸混合标准工作溶液,进行测定,以质量浓度为横坐标,对应的定量离子峰面积为纵坐标绘制标准曲线,并计算信噪比,以3倍信噪比为检出限,10倍信噪比为定量限。
1.2.5.2 加标回收率实验 在已知含量的样品溶液中分别添加低、中、高3个浓度水平的混合标准溶液,各浓度水平6个平行样本分析,计算各目标化合物的平均回收率。
1.2.5.3 稳定性、精密度和重复性实验 取6份平行的样品按1.2.4方法处理后,分别在0、2、4、8、12、24、48、72 h测定,进行稳定性试验。取1份样品溶液连续进样测定6次,进行精密度试验。取6份平行的样品溶液进行测定,进行重复性试验。在上述试验中,记录各目标化合物的峰面积,并计算相对标准偏差(RSD)。
1.2.6 样品测定 用1.2.4方法对市售的黄豆、黑豆、红小豆和绿豆等4种豆类食品进行前处理,用1.2.2和1.2.3方法进行上样检测。
1.3 数据处理
采用Analyst 1.6.2软件控制仪器,采集数据,Multi Quant 3.0.1软件进行数据处理,Excel 2010软件进行数据汇总和分析,Origin 2021软件进行绘图。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择 使用SB-C18色谱柱和Eclipse Plus C18RRHD色谱柱对1 μg/mL混合标准品溶液进行检测时,分离度不如Zorbax SB-Aq RRHT色谱柱,且基线噪音较高,最终选择Zorbax SB-Aq RRHT(3.0 mm×100 mm, 1.8 μm)色谱柱(见图1)。
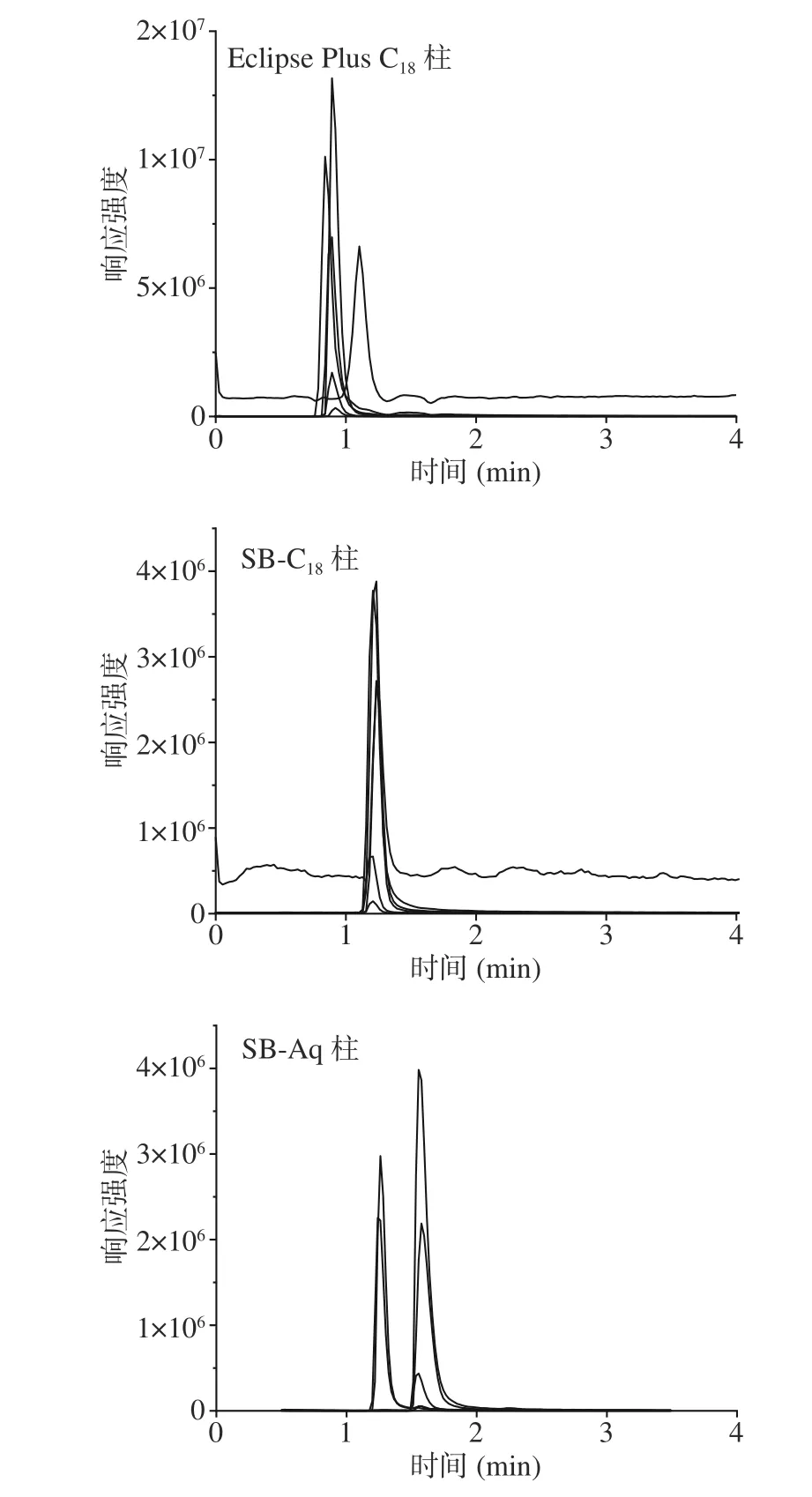
图 1 不同色谱柱对6种神经递质类氨基酸检测的影响Fig.1 Effect of different columns on the detection of 6 neurotransmitter amino acids
2.1.2 流动相的优化 使用水-甲醇作为流动相时,目标化合物的响应强度略高于使用水-乙腈作为流动相时的响应强度,但在水-甲醇和水-乙腈两种流动相体系里,目标化合物的分离度和峰形都有待改善,因此,考虑在流动相中加入甲酸、乙酸铵等改性剂。使用0.1%甲酸水溶液-甲醇做流动相时,响应强度低,分离度差且基线噪音高(见图2)。因此,最终选择0.5 mmol/L乙酸铵水溶液-甲醇体系作为流动相。
2.1.3 柱温的优化 柱温对目标化合物的响应强度没有明显的影响(见图3),最终选择接近于室温的25 ℃作为柱温。

图 2 不同流动相对6种神经递质类氨基酸检测的影响Fig.2 Effect of different mobile phases on the detection of 6 neurotransmitter amino acids
2.2 质谱条件优化
神经递质类氨基酸均属于极性化合物且化学结构中含有氨基,易结合H+,因此,采用正模式测定。分别配制浓度为1 μg/mL的各目标化合物单标溶液,使用针泵恒流进样的方式注入离子源,首先进行一级质谱扫描,确定各目标化合物的母离子为[M+H]+,然后进行产物离子扫描,确定2个响应强、干扰小的特征碎片离子,优化去簇电压(DP)和碰撞能量(CE),使得确定的两个子离子响应最佳。6种神经递质类氨基酸的总离子流图(TIC)见图4,提取离子谱图(XIC)见图5。
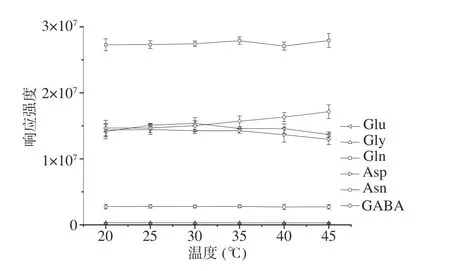
图 3 柱温对6种神经递质类氨基酸响应强度的影响Fig.3 Effect of column temperature on response intensity of 6 neurotransmitter amino acids

图 4 6种神经递质类氨基酸的总离子流图(TIC)Fig.4 Total ion chromatogram(TIC) of 6 neurotransmitter amino acids
2.3 样品前处理方法的优化
2.3.1 提取料液比的优化 随着豆类食品粉末在水溶液中的比例越来越小,基线噪音越来越小,同时目标化合物的响应也越来越高(见图6),最终选择2.5 mg豆类食品粉末加入1 mL超纯水的提取比例。
2.3.2 超声提取时间的优化 随着超声提取时间的延长,目标化合物的响应强度先小幅上升,在超声提取时间为30 s时达到最大,随后开始下降,在超声提取时间延长到600 s以上时,目标化合物的响应强度开始大幅下降(见图7),最终选择超声提取时间为

图 5 甘氨酸(Gly)、γ-氨基丁酸(GABA)、谷氨酸(Glu)、谷氨酰胺(Gln)、天冬氨酸(Asp)和天冬酰胺(Asn)的提取离子谱图(XIC)Fig.5 Extracted ion chromatogram(XIC) of Gly, γ-GABA, Glu, Gln, Asp and Asn
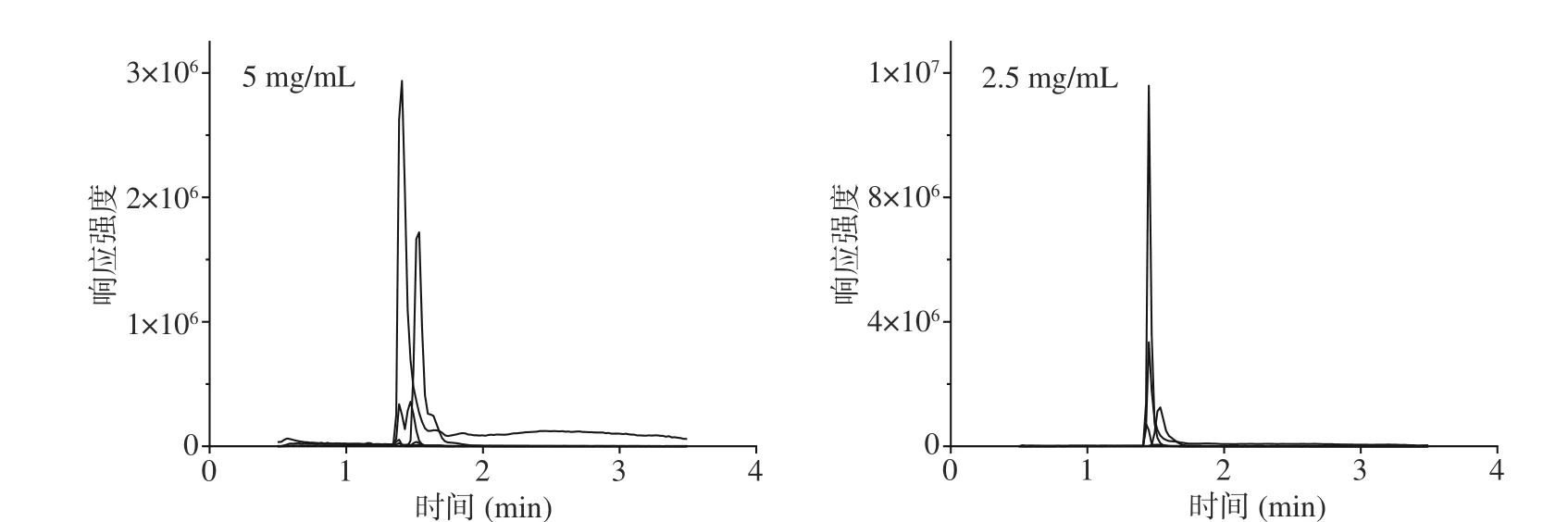
图 6 不同提取比例对6种神经递质类氨基酸检测的影响Fig.6 Effect of different extraction ratio on response intensity of 6 neurotransmitter amino acids
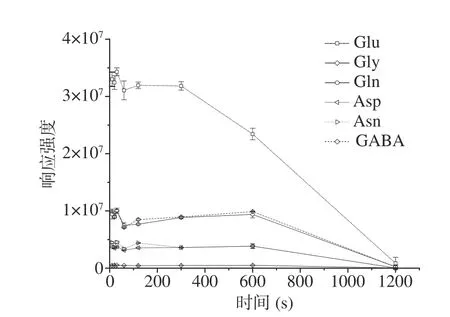
图 7 不同超声提取时间对6种神经递质类氨基酸响应强度的影响Fig.7 Effect of ultrasonic extraction time on response intensity of 6 neurotransmitter amino acids
30 s。
2.4 方法学验证
2.4.1 线性关系、检出限与定量限 6种目标化合物在各自范围内线性良好,相关系数(r)为0.991~0.999。以信噪比S/N≥3计算,检出限(LOD)为2~8 μg/kg,以信噪比S/N≥10计算,定量限(LOQ)为8~40 μg/kg(见表2)。
2.4.2 加标回收率 各目标化合物的平均回收率为80.30%~109.97%,相对标准偏差(RSD)为0.12%~7.20%(见表3)。
2.4.3 稳定性、精密度和重复性 稳定性实验的相对标准偏差(RSD)值为4.74%~6.98%,精密度实验的RSD值为0.63%~7.27%,重复性实验的RSD值为0.46%~5.17%(见表4)。

2.5 样品的测定
样品测定结果如表5所示,黄豆、黑豆、红小豆和绿豆四种豆类食品中的甘氨酸、γ-氨基丁酸、谷氨酸、谷氨酰胺、天冬氨酸和天冬酰胺的平均含量(n=6)分别为14.96~56.89、6.37~59.6、443.43~653.63、9.15~22.47、71.54~95.06和472.08~2880.17 μg/g。
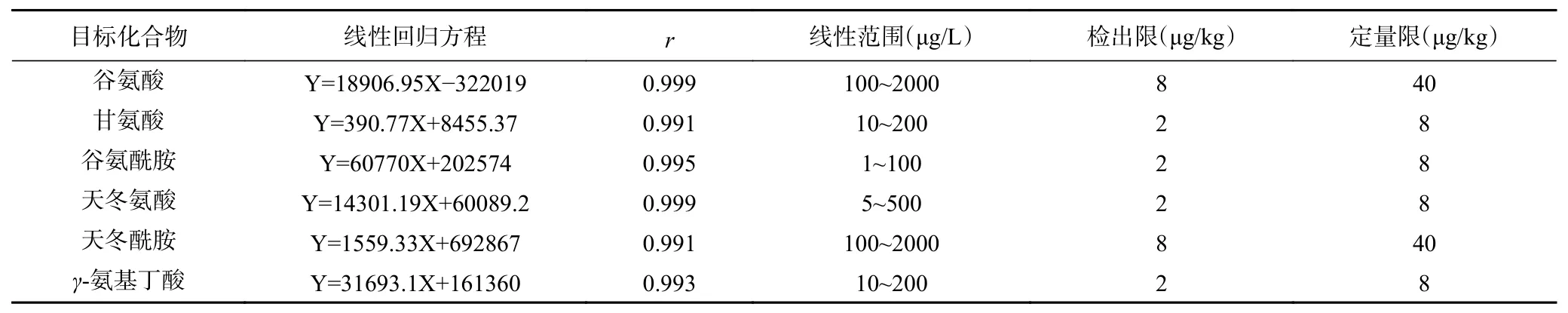
表 2 6种神经递质类氨基酸的线性关系、检出限与定量限Table 2 Liner relationships, LODs and LOQs of 6 neurotransmitter amino acids
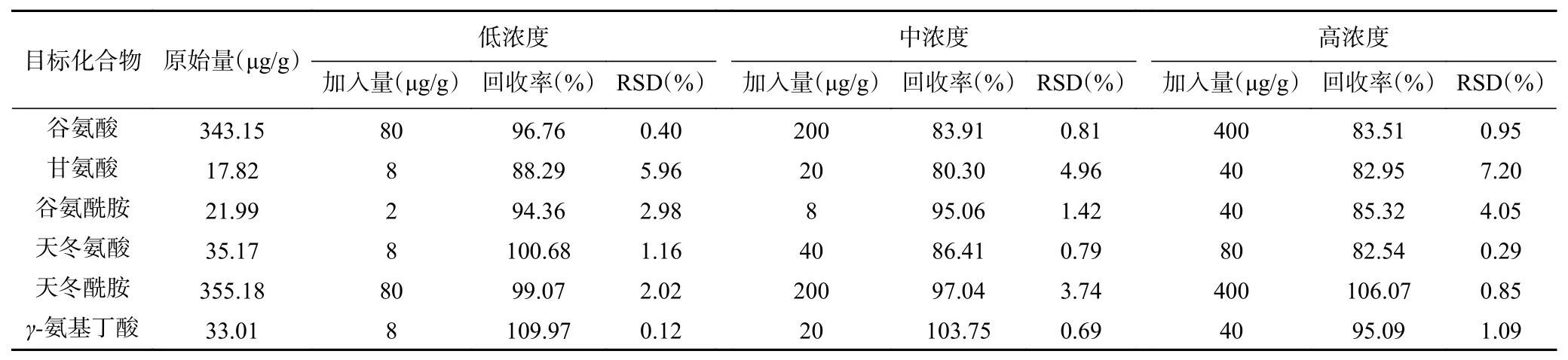
表 3 6种神经递质类氨基酸的加标回收率和相对标准偏差RSD(n=6)Table 3 Spiked recoveries and RSDs of 6 neurotransmitter amino acids(n=6)

表 4 稳定性、精密度和重复性试验的相对标准偏差RSD(n=6)Table 4 The RSDs of stability, precision and repeatability tests (n=6)

表 5 豆类食品中6种神经递质类氨基酸的含量Table 5 Content of 6 neurotransmitter amino acids in legume foods
3 结论与讨论
神经递质类氨基酸是极性化合物,而黄豆、黑豆、红小豆和绿豆都是固体食品,本文在相关文献[30,40−43]的研究基础上,采用超声辅助水提取法,提取豆类食品中的神经递质类氨基酸,通过优化前处理方法、色谱条件和质谱参数,建立了4种豆类食品中同时检测6种神经递质类氨基酸的UPLCMS/MS分析方法。谷氨酰胺在1~100 μg/L范围内,天冬氨酸在5~500 μg/L范围内,甘氨酸和γ-氨基丁酸在10~200 μg/L,谷氨酸和天冬酰胺在100~2000 μg/L范围内,线性关系良好,相关系数(r)在0.991~0.999之间,在低、中、高三个不同加标浓度下的回收率为80.30%~109.97%,相对标准偏差(RSD)为0.12%~7.20%,检出限和定量限分别为2~8、8~40 μg/kg。用该方法测得的黄豆、黑豆、红小豆和绿豆等四种豆类食品中甘氨酸、谷氨酸和天冬氨酸的含量低于文献[44−47]中所报道的含量,原因在于该方法检测的是游离态神经递质类氨基酸,而文献报道的是游离态和水解之后的结合态神经递质类氨基酸的总含量。黄豆、黑豆、红小豆和绿豆等四种豆类食品中的天冬酰胺、谷氨酰胺和γ-氨基丁酸的含量尚未见文献报道。
本文所建立的方法前处理简单、分析时间短、灵敏度和准确度高,适用于黄豆、黑豆、红小豆和绿豆4种豆类食品的检测,可推广应用于固体豆类食品中神经递质类氨基酸的检测分析,也为固体食品中氨基酸的测定提供参考,为我国的食品安全和质量控制提供技术支持。
