基于化学计量学的枸杞多糖部分酸水解产物PMP-HPLC指纹图谱
2021-09-29席璟睿张懿琳吴梦琪张文清徐志珍
席璟睿,张懿琳,吴梦琪,张文清,徐志珍,夏 玮
(华东理工大学化学与分子工程学院,上海市功能性材料化学重点实验室,上海 200237)
枸杞(Lycium barbarumL.),又名枸杞子,是一种茄科落叶灌木的成熟果实,是我国传统药食同源的中药材。其味甘性平,归肝、肾经,具有滋补肝肾,益精明目的功效。现代药理学研究表明,枸杞具有抗氧化、降血糖、抗肿瘤、保护神经和增强免疫能力等多种活性[1−4]。枸杞子中含有多糖、黄酮、类胡萝卜素、氨基酸、甜菜碱、脑苷脂、谷甾醇、微量元素和维生素等成分。在这些成分中,多糖被认为是枸杞的主要活性成分。枸杞多糖(LBPs)具有多种药理活性,在预防和治疗某些慢性疾病中起着重要作用,如糖尿病、炎症、癌症和免疫缺陷等[5−7]。目前市场上存在大量的枸杞多糖产品如营养保健品和膳食补充剂等[8],因此判定枸杞多糖产品的质量好坏及原料真伪极为重要。一般采用蒽酮-硫酸法和苯酚-硫酸法[9]测定多糖含量来控制枸杞多糖产品的质量,但此类方法选择性较差,无法得到多糖的单糖组成以及糖残基连接方式等结构信息,所以不能有效地鉴别出掺假品。因此,迫切需要制定有效可靠的评价标准,以便科学地评价枸杞多糖的质量。
随着现代分析技术的发展,指纹图谱已成为国际公认的质量检测技术[10−11]。多糖的活性与其单糖组成、糖残基连接方式、相对分子质量及空间结构等有着密切的联系,因此建立基于多糖结构信息的指纹图谱可以有效、科学地评价多糖产品的质量。关于枸杞多糖的指纹图谱目前已有相关报道。符梦凡[12]通过柱前衍生化HPLC法,以葡萄糖为基准物质,建立了枸杞多糖的HPLC特征图谱,并将该方法应用于不同来源及不同厂家枸杞多糖的质量评价。蒋梅等[13]以三氟乙酸水解枸杞子多糖,采用PMP柱前衍生化HPLC方法测定枸杞子多糖的单糖组成,构建了枸杞子多糖的HPLC指纹图谱。徐金楠等[14]采用中药指纹图谱技术结合化学计量学方法对三个产地红果及黑果枸杞多糖样品的IR、HPGPC、基于单糖组成的柱前衍生化HPLC图谱进行比较分析,以便用于枸杞及相关产品的多糖的质量控制。Liu等[15]建立了基于IR、UV、HPGFC以及PMP柱前衍生化HPLC的枸杞多糖多维指纹图谱,采用化学计量学的手段进行评价分析。目前关于枸杞多糖指纹图谱的大多数研究只关注完全酸水解产生的单糖,但能够提供更多信息的寡糖片段则未受到重视[16]。因此可采用部分酸水解的方法将多糖降解为单糖和特征寡糖片段,然后经1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化后通过高效液相色谱(HPLC)分析[17],获得与多糖组成和结构相关的独特指纹信息[18]。
本研究采用水提醇沉法从16 批不同产地的枸杞中提取多糖,采用三氟乙酸(TFA)进行部分酸水解,水解产物采用PMP柱前衍生化HPLC方法进行测定,构建枸杞多糖的部分酸水解产物指纹图谱。采用相似度评价(SA)、聚类分析(HCA)、主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)[19]等化学计量学手段对指纹图谱进行分析,揭示不同产地枸杞多糖样品的差异,筛选影响产地差异的标志性成分,并对枸杞多糖市售产品进行真伪鉴别,为枸杞多糖产品的质量控制提供科学依据。
1 材料与方法
1.1 材料与仪器
16批枸杞样品(100 g) 分别购于宁夏、甘肃、河北、青海、内蒙古、新疆和云南等地,见表1。该16批样品经上海市中药研究所叶愈青高级工程师鉴定为茄科植物宁夏枸杞Lycium barbarumL.(S1~S4、S6~S16)和河北血杞Lycium chinenseMiller var.potaninii(Pojarkova) A.M.Lu(S5)的干燥成熟果实[20]。乙腈、甲醇(色谱纯)、三氟乙酸(TFA)、1-苯基-3-甲基-5-吡唑啉酮(PMP) Adamas公司;无水乙醇、无水甲醇、三氯甲烷 均为分析纯,国药集团药业股份有限公司;D-甘露糖(Man)、L-阿拉伯糖(Ara)、D-半乳糖(Gal)、L-鼠李糖(Rha)和D-木糖(Xyl) 上海源聚生物科技有限公司;D-葡萄糖(Glc) 上海化学试剂公司;D-半乳糖醛酸(GalA)、D-葡萄糖醛酸(GlcA) Aladdin公司(中国)。

表 1 原材料批次与产地Table 1 16 batches of LBPs sample source
WKZ-4型中药粉碎机 青州市精诚医药装备制造有限公司;R-201型旋转蒸发仪 上海申生科技有限公司;SHB-IIIA 型循环水式多用真空泵 上海豫康科教仪器设备有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;Agilent 1260高效液相色谱仪、Agilent 1290超高效液相色谱仪-6530四级杆飞行时间质谱仪 UHPLC-6530 QTOF-MS/MS,美国Agilent公司;AE24型分析天平 瑞士Mettler Toledo公司。
1.2 实验方法
1.2.1 供试品溶液的制备 称取枸杞50 g,60 ℃干燥5 h 后粉碎,取10 g枸杞粉末60 ℃ 下用95%乙醇脱脂2 h。收集滤渣并干燥。以 1:20料液比90 ℃热水浸提2 h,重复两次,收集上清液减压浓缩至1/4体积,加入4倍体积的95%乙醇静置过夜。过滤后将沉淀加5倍体积的丙酮-石油醚混合液(体积比1:1)室温下洗涤20 min,于65 ℃真空干燥1 h,即得固形物枸杞多糖。
称取10.0 mg干燥的枸杞多糖样品于安瓿瓶中,加入2 mL 1.5 mol/L的三氟乙酸(TFA),封口,于100 ℃水解2 h。水解完毕,冷却后于40 ℃旋干,加适量甲醇旋干以除尽三氟乙酸,残渣溶于2 mL超纯水待衍生化。移取100 μL枸杞多糖水解样品溶液,加入50 μL的0.6 mol/L NaOH和100 μL PMP-甲醇溶液,混匀后70 ℃反应100 min,冷却至室温。再加入0.3 mol/L HCl 100 μL 和超纯水750 μL,三氯甲烷重复萃取3次,静置后取水层,0.45 μm滤膜过滤后待色谱分析。
1.2.2 对照品溶液的制备 精密称定L-阿拉伯糖,D-甘露糖,D-葡萄糖,D-葡萄糖醛酸,D-半乳糖,D-半乳糖醛酸,D-木糖和L-鼠李糖等8种单糖标准品各5 mg定溶于10 mL,配制0.5 mg·mL−1的单糖混合对照品溶液。移取100 μL混合单糖对照品溶液,加入50 μL的0.6 mol/L NaOH和100 μL PMP-甲醇溶液,混匀后70 ℃反应100 min,冷却至室温。再加入100 μL的0.3 mol/L HCl和750 μL超纯水,三氯甲烷重复萃取3次,静置后取水层,0.45 μm滤膜过滤后待色谱分析。
1.2.3 色谱条件 采用Agilent 1260高效液相色谱仪进行分析,色谱柱:Agilent Eclipse XDB-C18 柱(4.6 mm×250 mm,5 μm);流动相:0.1 mol/L磷酸盐缓冲液(pH6.7)-乙腈(体积比84:16);DAD检测波长:250 nm;柱温:30 ℃;流速:1.0 mL·min−1;进样量:20 μL。
1.2.4 液质联用条件 采用Agilent 1290超高效液相色谱仪联合Q-TOF质谱仪以及DAD检测器对枸杞多糖的部分酸水解产物进行分析,色谱柱:Agilent UHPLC XDB-C18 柱(2.1 mm×150 mm,1.8 μm);流动相:A 20 mmol/L pH 5.5 乙酸铵缓冲液:B 乙腈=84:16(v/v);流速:0.1 mL/min;柱温:30 ℃;DAD检测波长:250 nm;进样量:3 μL;干燥气体流速为10 L/min;喷雾器压力为50 psi,毛细管电压为4.0 kV;干燥气体温度:300 ℃; 离子源温度:100 ℃;正离子模式;MS/MS碰撞能量设定为20 V;质量扫描范围为m/z 100~2000。
1.2.5 数据处理与分析 采用《中药色谱指纹图谱相似度评价系统》(2012 A版)进行相似度分析。采用SPSS 23.0软件进行聚类分析和主成分分析,采用SIMCA 14.1软件进行主成分分析和偏最小二乘判别分析。
2 结果与分析
2.1 LBPs部分酸水解产物的PMP-HPLC指纹图谱构建
16批枸杞多糖部分酸水解产物的PMP-HPLC图谱如图1所示,不同产地样品的图谱相似度较高,有13个共有峰。将16批LBPs部分酸水解产物的色谱数据(图1)导入《中药色谱指纹图谱相似度评价系统》(2012 A版),S7号样品色谱图色谱峰峰形好、分离度良好、基线平整,故以S7枸杞多糖的图谱作为参照谱[21],选择中位数法生成对照指纹图谱如图2所示。以对照指纹图谱计算各批次LBPs的相似度,相似度评价结果见表2。各产地LBPs相似度在0.911~0.997之间,表明各产地枸杞多糖的差异较小,所建立的指纹图谱可用来对枸杞多糖的质量进行评价。

表 2 枸杞多糖部分酸水解产物的PMP-HPLC色谱图的相似度评价结果Table 2 Similarity of PMP-HPLC-DAD fingerprint of LBPs partial acid hydrolyzate
2.2 LBPs部分酸水解产物中单糖及寡糖的定性鉴定
2.2.1 LBPs部分酸水解产物中单糖的HPLC定性鉴定 混合单糖标准品的PMP-HPLC色谱图如图3所示,将LBPs部分酸水解产物指纹图谱中共有峰的保留时间与混合单糖标准品的保留时间比对,LBPs部分酸水解产物中共有7种单糖,5、7、9、10、11、12、13号峰分别为Man、Rha、GalA、Glc、Gal、Xyl和Ara。

图 1 枸杞多糖部分酸水解产物的PMP-HPLC色谱图Fig.1 PMP-HPLC fingerprints of LBPs partial acid hydrolyzate

图 2 枸杞多糖部分酸水解产物的PMP-HPLC对照指纹图谱Fig.2 PMP-HPLC control fingerprint of LBPs partial acid hydrolysate
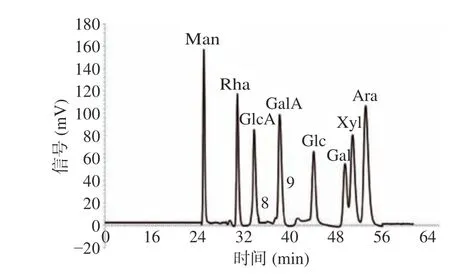
图 3 混合单糖标准品的PMP-HPLC色谱图Fig.3 PMP- HPLC chromatogram of the mixed standards
2.2.2 LBPs部分酸水解产物中单糖和寡糖的UHPLCQ-TOF-MS2定性鉴定 以样品S7为例,对枸杞多糖部分酸水解产物中的单糖和寡糖采用UHPLC-QTOF-MS2进行鉴定,按“1.2.1”项下方法制备供试品溶液,按“1.2.4”项下条件进行测定,总离子流图如图4所示。由于实验所使用的超高效液相色谱仪同时配备了Q-TOF质谱仪和DAD检测器,所以总离子流图可以同时采用DAD图(图5)进行参照,这样有利于对部分酸水解产物中的单糖和寡糖进行鉴定。正离子模式下,1~13号峰的一级质谱显示其准分子离子[M+H]+分别为m/z 1053.2797、877.2561、701.2947、687.2448、511.2187、673.2687、495.2236、671.2581、525.1979、511.2187、511.2184、481.2067和481.2073。其中5、7、9、10、11、12、13号峰分别为Man、Rha、GalA、Glc、Gal、Xyl和Ara与两分子PMP脱去两分子H2O形成的衍生物,验证了单糖组成的结果。1,2,3,4,6,8等未知峰进一步采用二级质谱鉴定,结果如图6所示,由准分离子质荷比以及碎片离子信息[22−23]可以推知寡糖的组成信息,如表3所示。综上,LBPs部分酸水解产物的对照PMPHPLC指纹图谱(图2)中1~13号峰分别为聚合度(DP)2~4的半乳糖醛酸聚糖、六碳糖+GalA、Man、DP 2的六碳糖、Rha、GalA+Rha、GalA、Glc、Gal、Xyl和Ara。

图 4 LBPs部分酸水解产物在负离子模式下的总离子流图Fig.4 Total ion chromatogram of LBPs in negative mod

图 5 LBPs部分酸水解产物的PMP-UHPLC-DAD色谱图Fig.5 PMP-HPLC-DAD fingerprints of LBPs partial acid hydrolyzate

图 6 LBPs部分酸水解产物中寡糖的二级质谱图Fig.6 MS / MS spectrums of LBPs partial acid hydrolysate
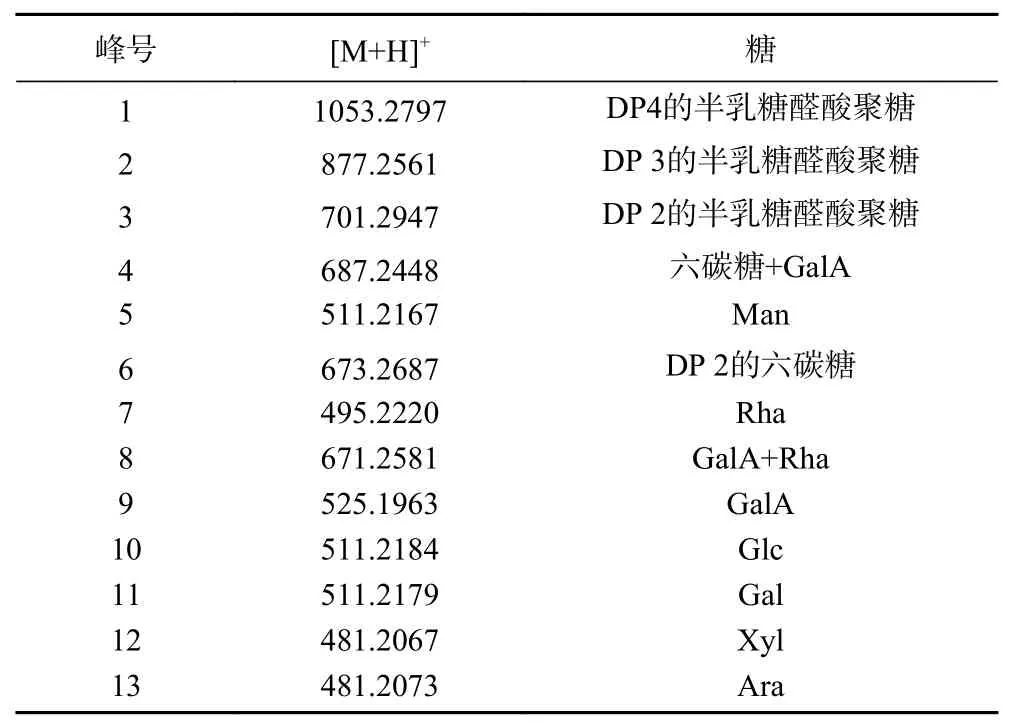
表 3 枸杞多糖部分酸水解物中单糖和寡糖的鉴定Table 3 Identification of monosaccharides and oligosaccharides of LBPs partial acid hydrolyzate
2.3 方法学考察
2.3.1 重复性试验 按“1.2”项下方法制备和测定6份LBPs样品(S7)溶液,以10号峰为参照峰,各共有峰相对保留时间的RSD值均小于0.15%,相对峰面积的RSD值均小于2.03%,表明该方法重复性良好。
2.3.2 稳定性试验 取S7供试品溶液,分别在0、2、4、8、12、24 h进样,各共有峰相对保留时间的RSD值均小于0.12%,相对峰面积的RSD值均小于1.98%,表明样品溶液24 h内有足够的稳定性。
2.3.3 精密度试验 精密吸取批次S7溶液25 μL,连续进样6次,各共有峰相对保留时间的RSD值均小于0.14%,相对峰面积的RSD值均小于2.12%,表明该仪器具有良好的精密度。
2.4 市售样品真伪鉴别
S17~S21为5批市售LBPs样品,市售样品按“1.2.1”项方法制备供试品溶液,按“1.2.3”项HPLC条件进样分析,所得色谱图见图7。S19、S21与LBPs部分酸水解产物的对照指纹图谱的相似度分别为0.933和0.956,且图谱信息与LBPs对照指纹图谱相一致,说明这2份市售样品为真品;而S17、S18和S20仅含有较高含量的Glc和微量的Man、Rha和Gal,且不含有寡糖,与对照指纹图谱的相似度仅在0.498~0.683之间,为掺假品,推测可能在枸杞多糖掺入了大量的麦芽糊精[24]。麦芽糊精是淀粉的水解产物,添加了大量麦芽糊精的枸杞多糖经三氟乙酸部分水解后,主要单糖为葡萄糖,寡糖由于含量太低没有被检测出来。上述结果表明建立的指纹图谱可以很好地用于枸杞多糖产品的真伪鉴别和质量控制。
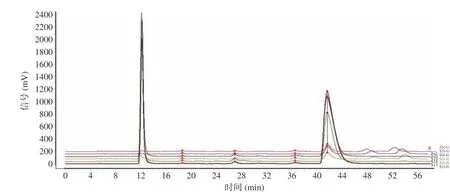
图 7 5批市售枸杞多糖样品部分酸水解产物的PMP-HPLC色谱图Fig.7 PMP-HPLC spectrum of 5 commercially available samples partial acid hydrolysate
2.5 化学计量学分析
2.5.1 聚类分析 聚类分析是按照个体的特征将其进行分类,将数据集中的样本聚集成一类,同一个类别中的个体间具有较高的相似度。将16批枸杞样品部分酸水解产物色谱图中各共有峰相对于参比峰(Glc)的峰面积量化后,得到16×13阶数据矩阵,导入SPSS 23.0版软件,采用瓦尔德法(Ward)作为聚类方法[25]。聚类结果如图8所示,当判别距离为10时,16批枸杞样品被分为3大类:第1类包括4个产地的样品,分别是河北巨鹿、青海格尔木、内蒙古和新疆楼兰;第2类包括8个产地的样品,分别是宁夏银川(6个)、宁夏中宁和甘肃景泰;第3类包括4个产地的样品,分别是宁夏中宁(2个)、青海柴达木和云南。结果表明,样品分类存在产地交叉现象,但与产地有一定的相关性,分成3 类的原因可能是各化学组成成分的相对比例具有一定的差异所致。
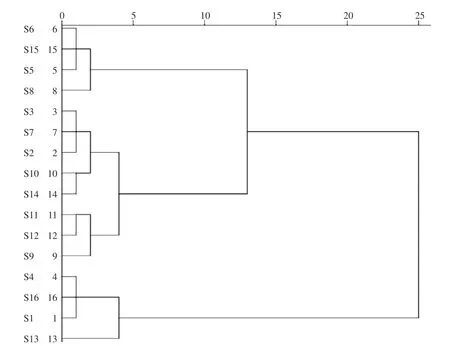
图 8 LBPs的聚类分析树状图Fig.8 Cluster analysis of LBPs
2.5.2 主成分分析 PCA主要体现了降维的思想,选取贡献率较大的成分进行分析,既简化了分析过程,又尽可能多的展现了原始信息。将16批次样品的13个共有峰峰面积导入SPSS 23.0软件,进行PCA分析,主成分分析的特征值和方差贡献率如表4所示。以特征值>1为提取标准[26],前3个主成分累积贡献率为79.264%(>70%),其中第一个主成分贡献率为33.897%,第二个主成分贡献率为23.110%,第

表 4 特征值和方差贡献率Table 4 Characteristic value and variance contribution rate
三个主成分贡献率为22.257%。故选取前3个主成分进行评价,它代表枸杞多糖中13个成分量的79.264%的信息量,足以评价枸杞多糖的品质。将数据矩阵导入SIMCA统计软件中,提取了3个主成分,分析结果如图9所示。与HCA类似,PCA将16批LBPs样品分成3类。PCA结果与HCA的结果相互得以印证。

图 9 LBPs主成分分析图Fig.9 PCA results of LBPs
2.5.3 偏最小二乘判别分析 PLS-DA常用于多变量体系样本的判别分析,适用于自变量之间存在共线性或样本数量较少的情况。将数据矩阵导入SIMCA统计软件中通过PLS-DA进行分析,该模型中,R2X(cum)=0.902,R2Y(cum)=0.763,Q2(cum)=0.556,R2Y和Q2的值以大于0.5为宜,且R2Y和Q2的值越趋近于1,说明该PLS-DA模型的预测能力越好。分析结果如图10所示,分类结果与HCA和PCA相一致。图11反映了该模型的 VIP值,VIP值的大小表示的是每个自变量贡献的大小,以VIP>1为筛选标准,得出导致产地间差异的标志性成分。从VIP值可知,色谱峰10、色谱峰13和色谱峰11的VIP值都大于1,三个色谱峰对应的分别是Glc、Ara和Gal。上述结果说明Glc、Ara和Gal对PLS-DA模型的判别分析具有较大的贡献。
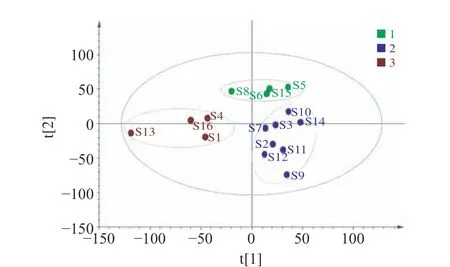
图 10 LBPs偏最小二乘判别分析图Fig.10 PLS-DA results of LBPs

图 11 LBPs偏最小二乘判别分析的VIP值Fig.11 VIP of PLS-DA of LBPs
3 结论
本文建立了16批不同产地LBPs部分酸水解产物的PMP-HPLC指纹图谱,结合SA、HCA、PCA和PLS-DA对指纹图谱进行综合评价。通过混合单糖标准品比对和 UPLC-Q-TOF-MS2定性鉴定,确定各产地枸杞多糖部分酸水解产物中均含有7种单糖、DP 2~4的半乳糖醛酸聚糖以及3种其它类型的2糖。HCA、PCA和PLS-DA均将不同产地的枸杞多糖分为三类,分类结果与产地具有一定的相关性。PLS-DA进一步筛选出3个影响产地间差异的标志性成分,分别为葡萄糖(Glc)、阿拉伯糖(Ara)和半乳糖(Gal)。根据建立的指纹图谱对5份市售LBPs进行真伪鉴别,其中2份市售样品与对照图谱的相似度为0.933~0.956,说明其为真品;另外3份市售样品与对照图谱的相似度仅为0.498~0.683,为掺假品,推测添加了大量的麦芽糊精。本研究建立的指纹图谱与枸杞多糖的化学组成与结构特征相关,因此在枸杞多糖产品的质量控制方面具有较大的实用价值。
