产ACE抑制肽菌株的筛选及其在模拟消化道环境中的活性分析
2021-09-29邵伯悦马春丽余鹏飞王家栩贾丽丽
邵伯悦,马春丽,余鹏飞,王家栩,贾丽丽
(东北农业大学食品学院,黑龙江哈尔滨 150030)
我国高血压患者的人数持续走高,2019年约有2.45亿高血压患者,且患者越来越年轻化[1],由于高血压是引起心脑血管疾病和中风的危险因素[2],因此很多学者就高血压问题进行了长期且深入的研究。肾素-血管紧张素-醛固酮系统参与调节血压的一部分,主要是由血管紧张素转换酶(ACE)将血管紧张素I转化为血管紧张素II,是系统的主要组成部分之一[3];此外,缓激肽也会被ACE所降解,从而达到舒张血管的作用。因此,通过抑制ACE活性并防止血管紧张素转化为有效形式化合物的方法,可以减轻高血压症状[4]。尽管降压药在调节血压中起着基本作用,但它们通常会出现多种副作用,因此,许多研究人员在食品中寻求诸如生物肽之类的ACE抑制物质,以使此类肽可用于高血压的预防和治疗[5−6]。
ACE抑制肽是蛋白质水解生成的一种小分子肽,通过抑制ACE活性,让血管紧张素不能转化,从而达到缓解高血压的作用[7]。有研究报道,一些乳酸菌Lb. helveticus、Lb. delbrueckiisubsp.bulgaricus、Lc. lactissubsp.cremoris、Lc. lactissubsp.lactisbiovar.diacetylactis在发酵过程中通过水解牛奶中的蛋白可以释放ACE抑制肽[8−9],且已有几种ACE抑制肽在发酵乳[10]和干酪[11]中被鉴定出来,此外,通过模拟计算的方法还探究ACE抑制肽的作用机制[12−13]。Solanki等[14]用Lb. rhamnosusMTCC 5945制备发酵驼奶,分析其ACE抑制活性,并分离鉴定了新的ACE抑制肽。
本试验目的是从27株乳酸菌中,筛选出一株发酵牛乳富产ACE抑制肽且具有益生菌潜力的菌株,为抗高血压发酵乳的研发提供科学的数据。
1 材料与方法
1.1 材料与仪器
实验室保存的27株乳酸菌 11株菌C2、C5~C13、Q6分离自干酪,13株菌M1~M13分离自生牛乳,另外3种为双歧杆菌(Bifidobacterium)、鼠李糖乳杆菌(Lb. rhamnosus)、植物乳杆菌(Lb. plantarum);MRS液体培养基 青岛海博生物;脱脂乳粉 纽仕兰新云电子商务有限公司;马尿酰-组胺酰-亮氨酸(HHL)、ACE(来自兔肺,酶活0.1 UN) 上海源叶;胃蛋白酶(1:3000)、胰蛋白酶(1:250) 大连美仑生物技术公司;邻苯二甲醛 Biotopped公司;乙酸乙酯 天津市富宇精细化工有限公司;其他试剂 均为国产分析纯。
GL-21M高速冷冻离心机 湖南湘仪实验仪器开发有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;数显搅拌水浴锅 常州赛普实验仪器厂;雷磁PHS-3C pH计 上海仪电科学仪器股份有限公司。
1.2 产ACE抑制肽乳酸菌的初筛
1.2.1 发酵乳制备 从−80 ℃冰箱中取出保藏的27株乳酸菌,在MRS液体培养基中37 ℃活化12 h,将活化的菌株,按照2%(v/v)的接种量接种到灭菌复原脱脂乳(10%,w/v)中,37 ℃培养至乳凝固后,转移至4 ℃冰箱,以停止进一步酸化。取样测定pH、滴定酸度、蛋白水解活力和ACE抑制率。
1.2.2 pH测定 将凝固的发酵乳漩涡震荡后取5 mL进行pH测定。
1.2.3 滴定酸度的测定 酸度值以吉尔涅尔度(°T)表示,方法参照GB 5009.239-2016。
1.2.4 蛋白水解活性测定 采用OPA法对蛋白水解度进行测定[15]。以亮氨酸为标准溶液,样品的蛋白水解活力以μg/mL亮氨酸为单位。
取2.5 g样品,加入1 mL去离子水,5 mL 1.0%的三氯乙酸,振荡混匀后静置,3000×g离心5 min,取0.4 mL上清液与3 mL OPA溶液混匀后静置2 min,在340 nm测吸光值。
1.2.5 发酵乳ACE抑制活性的测定 发酵乳清的制备:测定样品pH,将pH调至4.6后,5000 r/min离心15 min,保留上清液,再将pH调节至8.3后,5000 r/min离心15 min,保留上清液。
方法参照Cushman等[16]、张秋红[17]并略作修改。取5 mL离心管,加入5 mmol/L HHL底物为0.05 mol/L的硼酸钠缓冲液200 μL,再加入100 μL待测乳清,混合,在37 ℃水浴中预热3 min,加入20 μL ACE酶液,在37 ℃水浴中等待30 min,再加入250 μL 1 mol/L盐酸终止反应。加入1.7 mL乙酸乙酯,振荡15 s,4000 r/min离心10 min,取上层的1 mL乙酸乙酯,加热挥发去除有机溶剂,再加入3 mL去离子水,并振荡摇匀,用紫外分光光度计在228 nm测定样品吸光值。按照以下公式计算ACE抑制率:
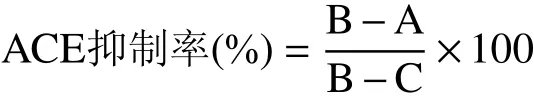
式中,A为样品组吸光度值;B为对照组吸光度值;C为空白组吸光度值。
1.2.6 体外模拟人工胃肠消化 人工胃液、肠液参照药典[18]进行配制。参照陈仪婷等[19]方法并略作修改。取样品5 mL,测定其乳清样品的ACE抑制率;将剩余发酵乳以10%添加到人工胃液中,然后37 ℃水浴消化3 h,沸水浴加热10 min以终止反应,取样测定其ACE抑制率;再将其以10%添加到人工肠液中,然后37 ℃水浴消化3 h,沸水浴加热10 min以终止反应,再取样测定其ACE抑制率。
1.3 产ACE抑制肽乳酸菌的复筛
1.3.1 菌株的酸耐受性试验 参照黄燕燕等[20]方法并略作修改。将MRS培养基的pH分别调整为3.0、4.0、5.0,pH为6.0的MRS培养基为对照组,分装至各试管。以2%接种量分别接种至上述MRS培养基中,37 ℃培养3 h后取菌液,进行菌落计数,计算酸耐受性,即:
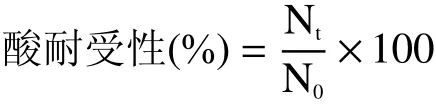
其中:Nt、N0分别为试验组样品和对照组样品中的活菌数(CFU mL−1)。
1.3.2 菌株的胆盐耐受性试验 参照陈大卫等[21]方法并略作修改。将乳酸菌以2%量接种于含有0.3%胆盐的MRS液体培养基中,于37 ℃培养3 h,以不加胆盐的MRS肉汤培养基为对照组,进行菌落计数。按下列公式计算菌株的胆盐耐受性:

其中:Nt、N0分别为试验组样品和对照组样品中的活菌数(CFU mL−1)。
1.3.3 菌株的盐耐受性试验 参照孙杰等[22]方法并略作修改。将乳酸菌以2%量接种于含NaCl质量浓度为4 g/100 mL的MRS培养基中,37 ℃培养24 h后取菌液,进行菌落计数,以不加NaCl的MRS培养基中的菌落数为对照,计算盐耐受性,即:

其中:Nt、N0分别为试验组样品和对照组样品中的活菌数(CFU·mL−1)。
1.4 菌株16S rDNA鉴定
将筛选的菌株送至吉林省库美生物科技有限公司进行16S rDNA鉴定,并将鉴定结果经RDP数据库[23−24]比对后,使用MEGA 7.0软件[25]进行系统发育树的构建。
1.5 数据处理
采用SPSS22.0统计软件进行统计学分析,数据均采用X ±SD表示,并采用方差分析,相关性比较模块,采用Origin8.0进行作图,每个试验重复3次。
2 结果与分析
2.1 产ACE抑制肽乳酸菌的初筛
对实验室保藏的27株乳酸菌进行发酵实验,测定pH、滴定酸度、蛋白水解活力及ACE抑制率,所得结果见表1。

表 1 发酵乳pH、滴定酸度、蛋白水解活力、ACE抑制活性结果Table 1 Results of fermented milk pH, titration acidity, protein hydrolysis activity, and ACE inhibition activity
结果显示,不同菌株间的这些性能存在很大差异,由不同乳酸菌发酵酸乳的ACE抑制活性在60%以上的有6株,它们是M11、M3、M10、Bifidobacterium、M12、M6,抑制活性最高的是菌株M11,抑制率为76.84%±1.98%,其次是M3,抑制率为71.94%±1.39%。ACE抑制率小于30%的有11株乳酸菌,最低的只有3.79%±1.79%。样品的pH在4.40~5.10之间,滴定酸度在45~85 °T之间,菌株M10、M5、M11、M2、M6、M3、C7具有相对较高的产酸性能。蛋白水解活性在100 μg/mL亮氨酸以上的菌株有6株,它们是C11、M10、C7、M9、M12、M13。
乳酸菌发酵脱脂乳的ACE抑制活性作为筛选菌株的直接指标,筛选出发酵乳ACE抑制活性在60%以上的菌株6株。乳酸菌M11、M3、M10、M12和M6的蛋白水解能力都在80 μg/mL亮氨酸以上,具有相对较高的蛋白水解能力;乳酸菌M11、M3、M10和M6的滴定酸度都在70 °T以上,具有较好的产酸能力,因此选择M3、M6、M10和M11进行接下来的试验。
2.2 乳酸菌在模拟胃肠液中ACE抑制活性的变化
如图1所示,不同乳酸菌的发酵乳经人工胃液和肠液作用后,所得ACE抑制活性变化有很大差异。菌株M3在胃液和肠液作用后,ACE抑制活性先升高后降低,但仍显著高于消化前(P<0.05),为74.96%±1.73%,且显著高于其他菌株(P<0.05);M6、M10、M11在胃液和肠液作用后均逐渐降低,分别为49.21%±2.20%、58.80%±3.67%、62.66%±2.68%。菌株M3先上升的原因可能是因为在胃蛋白酶的作用下,一些大的氨基酸残基被水解成小分子的多肽,使得ACE抑制肽的浓度变大,抑制活性增强;而在胰蛋白酶的作用下,一些小分子多肽被进一步分解成无活性的游离氨基酸或者是氨基酸残基,使得ACE抑制活性下降。对于另外3株乳酸菌,在胃蛋白酶及胰蛋白酶作用下ACE抑制活性逐渐下降,可能是因为原有的具有ACE抑制活性的肽被分解,无活性的肽或者游离氨基酸比例增大造成的[26−27]。

图 1 人工模拟胃液肠液对ACE抑制活性的影响Fig.1 Effect of artificial simulated gastric and intestinal fluids on ACE inhibitory activity
2.3 菌株酸耐受性
益生菌在人体中发挥益生菌功能的前提是能够顺利通过胃酸构成的生物屏障,稳定粘附于肠上皮细胞,实现定植[28]。食物在胃中存留的时间大约为1~3 h[29],因此选择3 h作为耐受时间。在食用乳制品后,胃液的pH一般在3左右[30],因此,能够在胃肠道中发挥作用的乳酸菌必须对酸有很强的耐受性。试验菌株酸耐受性结果如图2所示,在pH为3.0~5.0的范围内,随着酸度的增加,菌株的酸耐受性在逐渐下降,在pH3时,菌株的酸耐受性降至10%~30%,菌落数大约为7 lg CFU mL−1,依然满足益生菌的推荐摄入量大于6 lg CFU mL−1剂量[30]。因此,菌株M3、M6、M10、M11均能耐受胃酸环境且保持一定的活菌数。

图 2 菌株的酸耐受性Fig.2 Acid tolerance of the strains

图 3 菌株系统发育树Fig.3 Phylogenetic tree of strains
2.4 菌株胆盐耐受性
人体小肠内的胆盐含量约为0.3%,食物通过一般需要1~4 h。因此,乳酸菌应具有一定的胆盐抗性,并在经过小肠时仍能维持活力,发挥益生菌作用[31]。试验菌株的胆盐耐受性如表2所示,菌株M3经0.3%胆盐作用3 h后,胆盐的耐受性为37.50%±2.47%,显著高于其他菌株(P<0.05),M10最低为24.09%±0.31%。根据菌落计数的结果,经0.3%胆盐作用3 h后,4株试验菌株活菌数均高于益生菌推荐摄入量。因此,4株乳酸菌均具有胆盐耐受性。
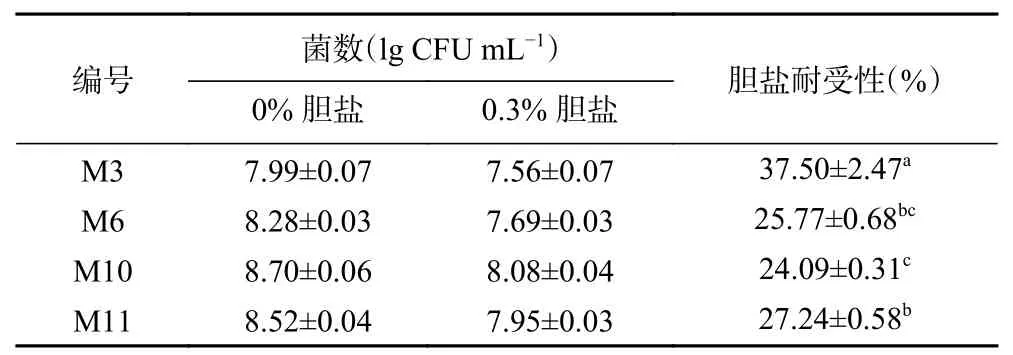
表 2 菌株的胆盐耐受性Table 2 Bile salt tolerance of the strains
2.5 菌株盐耐受性
乳酸菌的耐盐性也是评价乳酸菌品质的一个重要指标。NaCl在人体内的质量浓度为1~4 g/mL[32]。高盐会导致高渗透压,细胞失水造成胞质分离[33]。表3所示为试验菌株的盐耐受性结果,添加4% NaCl后,菌株的耐盐性大约在20%~40%,其中M3的盐耐受性是最高的,为37.32%±1.84%,说明高盐抑制了菌株的存活率,而乳酸菌有一定的盐耐受性,使得菌落计数的结果在7 lg CFU mL−1以上,依然满足推荐益生菌摄入的最低摄入量。因此,四株乳酸菌均具有一定的盐耐受性,其中M3的盐耐受性更强。

表 3 菌株的盐耐受性Table 3 Salt tolerance of the strains
2.6 菌株16S rDNA鉴定
经筛选后发现,菌株M3的ACE抑制活性为71.94%±1.39%,能耐受人工胃肠液环境,且该菌具有较好的产酸性能和蛋白水解活性,能耐受模拟消化环境,保持活菌数量。送样测定M3菌株的16S rDNA序列,并经RDP数据库比对并构建系统发育树(图3)后发现,M3菌株与Lactobacillus paracaseisubsp.paracasei的同源性在99%以上,因此乳酸菌菌株M3是Lb. paracaseisubsp.paracasei。
3 结论
本研究显示,试验菌株间的ACE抑制活性存在较大差异,经初筛获得菌株M3、M6、M10和M11有较高的ACE抑制活性,同时具有较好的产酸或蛋白水解性能,经模拟胃肠消化后,菌株M3的ACE抑制活性呈现先上升后下降的趋势并保持较高活性,另外3株乳酸菌的ACE抑制活性都呈现逐渐下降的趋势。在环境耐受性的试验中,4株乳酸菌都呈现出对酸、胆盐、盐的良好耐受性,菌落计数结果显示,都能满足推荐益生菌摄入量的最低量(6 lg CFU mL−1),尤其是M3菌株,呈现出更高的环境耐受性。M3菌株经16S rDNA菌株鉴定为Lb. paracaseisubsp.paracasei。此外,该菌株如何抑制ACE活性以及在体内是否具有抗高血压能力,还需要进一步研究。
