Illumina Miseq高通量测序方法对袋装番茄酱微生物多样性分析
2021-09-29张双虹刘孟涛陆婉瑶赵抒娜闫金萍
张双虹,刘孟涛,陆婉瑶,赵抒娜,, ,王 婧,闫金萍
(1.中粮营养健康研究院有限公司,老年营养食品研究北京市工程实验室,营养健康与食品安全北京市重点实验室,北京 102209;2.中粮糖业控股股份有限公司,农业部糖料与番茄质量安全控制重点实验室,新疆昌吉 831100)
番茄是一年生茄科草本植物[1],酸甜可口,含有可溶性糖[2]、有机酸、维生素[3−4]、蛋白质、番茄红素[5−6]、多酚类物质[7]、黄酮类[8−9]和矿物质等多种营养物质和功能活性成分[10−11],具有控制高血压、抗癌治癌、降低动脉硬化、抗衰老等功能[12],食用番茄及其制品能有效降低乳腺癌、前列腺癌、心血管疾病、肥胖等慢性疾病的发病风险[13]。全球的加工番茄种植地区集中在美国的加州河谷、地中海沿岸和中国的新疆、甘肃、内蒙古等地[14−15]。新疆地区气候干燥、昼夜温差大,这一独特的地理环境造就了优质的原料,其生产的番茄番茄色素和干物质含量更高[16],生产的番茄酱以大包装为主[17],主要出口日本、俄罗斯、欧盟等国家和地区[18]。与新鲜番茄相比,番茄酱的营养成分更易被人体吸收[19]。
番茄酱是成熟番茄经一系列加工工艺制成[20],番茄酱的生产包括原料流送、提升、破碎、预热、打浆精制、过滤、蒸发、杀菌、无菌灌装等多个过程[21−22]。番茄酱的生产过程经过严格的原料筛选和加工过程控制,最终得到的成品以钢桶、木桶、袋装等多种形式进行包装,成品的番茄酱一般在保质期内符合商业无菌的要求[23−24]。事实上,杀菌不彻底、灌装后二次污染等容易导致番茄酱成品感染腐败微生物,出现变酸、酱体形态改变、产气胀袋等现象,因此研究番茄酱成品中的微生物的种类和数量非常重要。针对这类变质问题,众多学者一直开展相关研究,提供适宜的解决方案。目前鉴定出的引起番茄酱产气变质的微生物主要有细菌、酵母菌和霉菌。如黄玲等[25]从胀袋番茄酱中分离出季也蒙假丝酵母和丛生胞丝酵母;黄忠梅等[26]利用全自动微生物生化分析仪鉴定从番茄酱中分离得到的微生物,包括埃希氏菌属、棒状杆菌属、芽胞杆菌属、葡萄球菌属等;曾献春等分离得到了枯草芽孢杆菌和栖稻黄色单胞菌[27];吴彩兰研究表明,在新疆番茄中分离得到的内生细菌中芽孢灰枣杆菌分离频率最高、数目最多,是加工番茄内生细菌的主要优势种群[28];李慧等对胀桶番茄酱中的腐败微生物进行分离鉴定,利用形态特征观察、序列分析和生理生化性质鉴定的方法,表明主要腐败微生物为厚壁类芽胞杆菌、蜡样芽胞杆菌、蕈状芽胞杆菌和奥默毕氏酵母[29]。巴哈提古丽等对感官异常番茄酱分离的菌株进行鉴定,得到分离的9株细菌分别为芽孢灰枣杆菌类和肠球菌类[30]。对于胀气番茄酱的研究,学者们大多通过选择性培养基对微生物进行培养和分离,进一步对菌株进行鉴定,但由于微生物的可培养性和培养条件的不同,在微生物的数量及种类上可能产生不同的结论,无法全面反映菌群的结构组成。
高通量测序技术的发展为全面反映不同样品中的微生物群落的组成提供了可行的技术手段[31],可以鉴定一些不易培养的微生物,通过微生物的多样性和相对丰度实现准确定性和定量分析[32−33]。本研究针对番茄酱产品的产气胀袋问题,通过高通量测序技术对不同番茄酱产品中的微生物多样性进行分析,深入了解番茄酱产品中的微生物群落结构及其差异,从微生物分类学方向确认引起番茄酱胀气的微生物类型,以期为生产企业控制微生物污染风险、降低经济损失、保证食品质量安全提供理论依据。
1 材料与方法
1.1 材料与仪器
袋装番茄酱样品 新疆地区市场采购及工厂内控产品收集,包括正常的袋装番茄酱A1、A2和已胀袋番茄酱A3、A4;MRS培养基、琼脂 北京陆桥技术股份有限公司;细菌基因组提取试剂盒 OMEGA公司。
恒温培养箱 上海精密科学仪器有限公司;超净工作台 上海智城分析仪器制造有限公司;立式压力蒸汽灭菌器 日本YAMATO公司;电泳槽 北京市六一仪器厂;凝胶成像系统 上海复日科技有限公司;PCR仪 北京东胜创新生物科技有限公司。
1.2 实验方法
1.2.1 样品处理及总DNA的提取 取适量番茄酱样品放入2 mL样品管,在组织破碎仪中进行破碎后提取。按照OMEGA公司细菌基因组DNA提取试剂盒的说明提取基因组DNA,用Qubit3.0DNA检测试剂盒检测基因组DNA的浓度。
1.2.2 PCR扩增及其测序 以获得的基因组DNA为模板对细菌16S rDNA进行PCR扩增。16S rDNA序列扩增所用引物扩增16S rDNA的V3-V4区域:上游引物341F:5'-CCTACGGGNGGCWGCAG-3',下游引物805R:5'-GACTACHVGGGTATCTAAT CC-3'。
PCR反应条件:94 ℃预变性3 min,进入循环程序,94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,循环5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,循环20个循环,再72 ℃终延伸5 min。第二轮PCR扩增,引入Illumina桥式PCR兼容引物,95 ℃预变性3 min,进入循环程序,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,循环5个循环,再72 ℃终延伸5 min。PCR反应完成后将PCR产物通过2%琼脂糖凝胶电泳检测。测序由生工生物工程(上海)股份有限公司完成,使用Illumina Miseq测序平台进行测序。
1.2.3 番茄酱指标的测定 乳酸菌计数按照食品安全国家标准GB 4789.35-2016《食品微生物学检验乳酸菌检验》进行检测[34]。以无菌操作称取25 g番茄酱样品,置于装有225 mL生理盐水的均质袋内,混匀制成1:10样品匀液,并依次制备10倍梯度样品匀液稀释备用。取各梯度稀释样品匀液1 mL于无菌平皿中,每个稀释度2个平皿。将15~20 mL冷却至48 ℃的MRS培养基倾注平皿,并转动平皿使其混合均匀。冷却后翻转平板,置于37 ℃恒温培养箱中,厌氧条件下培养。72 h后计数乳杆菌属细菌数目。pH的测定:取适量番茄酱样品,用pH计进行测定。
1.3 数据处理
基于Illumina Miseq平台测序得到的样品文库,根据Barcode序列和PCR扩增引物序列区分各样本数据,对样本数据的质量进行质控过滤,得到各样本有效数据。使用Usearch软件按照97%相似性对非重复序列进行OTU聚类分析,筛选出代表序列。利用RDP 16S数据库和NCBI 16S数据库进行分类学研究,统计每个样品在门、属分类水平上的序列数目。利用Shannon指数、Chao指数等方法完成多样性指数分析,使用R软件绘制稀释性曲线、Rank abundance曲线、样本相关性热图。
2 结果与分析
2.1 高通量测序数据统计与质量分析
4份样品共产生350344条有效序列,平均长度约为421bp,由稀释性曲线(图1)可见,测序序列数大于25000时,曲线上升缓慢,表明测序数据量继续增加,新增OTU数有限,本次测序的测序量能够覆盖样本中的绝大部分物种,数据量足够。Rank abundance曲线表明(图2),样品微生物的丰富程度和均匀程度存在差异,其中番茄酱样品A1、A2曲线较平缓,水平跨度大,物种的组成丰富,均匀程度高;番茄酱异常样品A3、A4曲线较陡峭,水平跨度小,微生物丰度较低,某一类或几类微生物占了大部分比例,具有数量优势。

图 1 高通量测序样本的稀释性曲线Fig.1 Rarefaction curves of the tested samples based on high-throughput sequencing

图 2 高通量测序样本的Rank-abundance曲线Fig.2 Rank abundance curves of the tested samples based on high-throughput sequencing
2.2 番茄酱样品的Alpha多样性指数分析
由表1可知,四个样品来看,四个样品的Coverage指数相同,均为1.00,表明测序能反映样品的真实情况。番茄酱正常样品A1、A2的OTUs、Shannon、

表 1 番茄酱样品中细菌Alpha多样性Table 1 Alpha diversity indexes of bacterial communities in tomato sauce samples
Chao、Ace、Shannoneven指数都高于胀袋样品A3、A4,说明样品A1、A2的Alpha多样性高,样品中的微生物丰富度和均匀度比较高。样品A1和A2的Shannoneven指数相近,样品A3和A4的Shannoneven指数相近,说明两两之间的微生物群落多样性和分配均匀程度相似,而A1、A2和A3、A4之间存在差异性;同时说明两个番茄酱胀袋样品之间的微生物多样性相似。样本相关性热图(图3),样品A1和A2的样本相似性较高,样品A3和A4的样本相似性较高,而正常样品与异常样品之间微生物群落差异较大。

图 3 不同番茄酱样本相关性热图Fig.3 Heatmaps of corrlation between tomato sauce samples
2.3 门水平菌群结构
图4 为各样品门水平丰度分布的柱形图。番茄酱正常样品A1中,优势物种为变形菌门(Proteobacteria),平均占比为83.2%,其余包括厚壁菌门(Firmicutes)平均占比7.32%、拟杆菌门(Bacteroidetes)平均占比3.3%、放线菌门(Actinobacteria)平均占比2.58%以及其他分类。番茄酱正常样品A2中,优势物种为变形菌门(Proteobacteria)平均占比87.4%,其余包括厚壁菌门(Firmicutes)平均占比4.86%、拟杆菌门(Bacteroidetes)平均占比4.8%、放线菌门(Actinobacteria)平均占比0.86%以及其他分类。番茄酱异常样品A3中,优势物种为厚壁菌门(Firmicutes)平均占比96.96%,其余包括变形菌门(Proteobacteria)平均占比2.93%,拟杆菌门(Bacteroidetes)平均占比0.07%、放线菌门(Actinobacteria)平均占比0.01%以及其他分类。番茄酱异常样品A4中,优势物种为厚壁菌门(Firmicutes)平均占比97.45%,其余包括变形菌门(Proteobacteria)平均占比2.46%,拟杆菌门(Bacteroidetes)平均占比0.04%、放线菌门(Actinobacteria)平均占比0.01%以及其他分类。样品A1和A2之间主要优势菌门相同,相对丰度差异不大。样品A3和A4之间情况相同。各样本门水平分布情况表明,番茄酱正常样品与异常样品之间微生物组成存在明显差异。

表 2 番茄酱样品中菌属相对丰度表Table 2 Relative abundance of bacteria genera in the tomato sauce samples
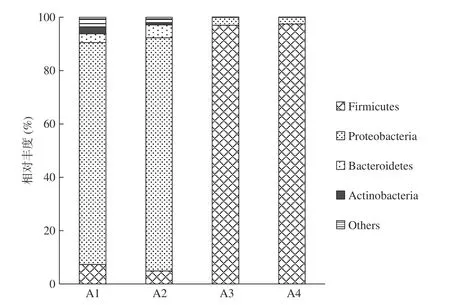
图 4 门水平不同番茄酱样品物种分布相对丰度Fig.4 Distribution of microbial communities in different tomato sauce samples at the phylum level
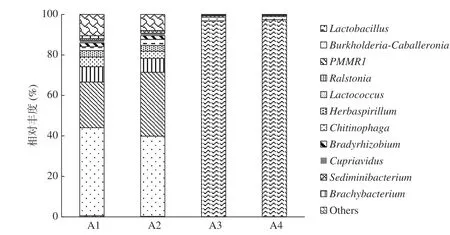
图 5 属水平不同番茄酱样品物种分布相对丰度Fig.5 Disttibution of microbial communities in tomato sauce samples at the genus level
2.4 属水平菌群结构
在属的水平上统计显示(图5),不同番茄酱样品中微生物的群落结构组成和相对丰度不同。番茄酱异常样品菌相较为单一,乳杆菌属比例在样品A3和A4中分别达到96.89%和97.38%(表2),表明乳杆菌属是主要的污染微生物。而番茄酱正常样品的菌落组成较为丰富,但与异常样品相比微生物群落结构差异较大,主要为植物和土壤中的一些微生物类别,包括存在于土壤中的伯克氏菌属(Burkholderiaspp.)、存在于土壤和水中的柄杆菌科某属PMMR1spp.、存在于植物中的劳尔氏菌属(Ralstoniaspp.)、存在于植物内的固氮菌草螺菌属(Herbaspirillumspp.)、存在于土壤和环境中的鞘氨醇杆菌科某属Chitinophagaspp.以及存在于植物中的慢生根瘤菌(Bradyrhizobiumspp.)等。番茄酱样品中的微生物种类可能受原料、生产地点、生产工艺等多种因素的影响。在以往番茄酱胀罐样品的相关报道中,发现的微生物包括芽胞杆菌、酵母菌、埃希氏菌属等。如杨红红等[35]对新疆胡阳河番茄制品有限公司提供的胀罐番茄酱中微生物进行分离研究,发现导致番茄酱胀袋的主要微生物是芽孢杆菌、酵母菌和霉菌;丁生林等[36]报道了中粮屯河食品分析检测研究中心从番茄酱中分离出乳球菌和芽孢杆菌;黄忠梅等[26]对胀袋及正常罐装的番茄酱进行培养得到的20株菌株进行鉴定,结果表明所检出的20株菌株分别为埃希氏菌属、棒状杆菌属、芽胞杆菌属、葡萄球菌属等。而本研究通过客观测序结果提出了不同的观点,在本研究所筛查的样品中多见于报道的酵母菌和芽胞杆菌并不是主要优势菌种,反而是耐热能力较差的乳酸菌是主要菌种,与以往人们认为杀菌温度偏低导致某些耐热菌种不能被彻底杀灭的印象并不吻合。
番茄酱是酸性罐装食品,其生产过程中的杀菌和无菌过滤能够彻底杀菌。但是如果在加工过程中杀菌不彻底,容易因微生物的残留而引起腐败[37]。产芽胞细菌的耐热性和鲁棒性较好,芽胞杆菌引起的腐败可能由于密封不良、杀菌温度不足,容易导致兼性厌氧菌的持续存活而引起腐败。本研究发现番茄酱异常样品中乳杆菌属大量存在,可能是由于运行过程中物料控制存在波动,造成局部杀菌不彻底或杀菌后在过滤工段及密封环境存在的二次污染,造成乳杆菌的大量繁殖,乳酸菌能够耐受酸度较低的条件,乳酸菌将碳水化合物转化为乳酸,降低番茄酱产品的pH,产气使样品出现胀袋现象,造成番茄酱腐败变质。以往通过后期培养得到芽孢杆菌等耐热性好的菌种为主要优势菌种,从治理的角度上去考虑,可能需要在生产环节提高杀菌温度以保证耐热菌种被杀灭,由此造成局部过热,反而产生一些焦糊的不良风味,番茄酱的颜色也会加深,影响番茄酱的整体品质。
而通过本研究发现,并不耐热的乳杆菌也有可能是造成品质劣变的主要原因,因此在加工环节需要侧重的重点可能并不是全程过度提升加热温度,而是在加工环节维持比较稳定的物料生产,并且规范管理好生产环境,也可以满足实际生产的灭菌需求,并且还不会因过热造成不良风味和色值加深等影响番茄酱感官品质的问题。
2.5 乳杆菌属计数及理化指标测定
对番茄酱样品依据GB 4789.35-2016乳杆菌属测定方法进行检测,并观察番茄酱酱体形态,结果如表3所示。与正常样品相比较,番茄酱胀袋样品中乳杆菌属微生物大量繁殖,这与高通量测序的结果相一致。番茄酱胀袋样品的酱体pH降低,带来酱体酸度的改变,呈现酸腐气味。这说明乳杆菌属微生物是造成番茄酱产气胀袋的原因,在生产过程中应注意预防和控制,消除产品潜在的安全隐患。

表 3 不同番茄酱样品的理化指标Table 3 Physicochemical properties of different tomato sauce
3 讨论与结论
研究采用高通量测序技术,获得了350344条有效序列数,更好地揭示了番茄酱制品微生物群落的多样性。以往研究以微生物培养和分离为主,鉴定出的微生物主要包括酵母菌、霉菌、埃希氏菌属以及芽孢杆菌。本实验首次从整体水平上详述了番茄酱制品中属分类水平的细菌微生物群落结构,异常样品中鉴定出的主要为乳杆菌属,正常样品中鉴定出的细菌包括乳杆菌属、伯克氏菌属、劳尔氏菌属、草螺菌属、慢生根瘤菌等,在以往研究中未见报道,为可能造成番茄酱胀袋的原因提供了新的视角。
高通量测序可以快速准确全面地反映检测样品中微生物的群落组成,对于低丰度、难以培养甚至不可培养的微生物也能很好的鉴别。但是高通量测序的方法基于基因组的抽提和扩增测序,无法对样品中的存活微生物的情况作出判断。本实验采用测序方法结合计数方法来研究引起番茄酱胀袋的主要微生物,通过实验可以得出,番茄酱正常样品与胀袋样品之间菌群结构存在明显的差异,胀袋番茄酱样品中的主要微生物是乳杆菌属,说明乳杆菌属是引起番茄酱腐败的主要微生物,在生产中应引起重视。实验结果对番茄酱生产工艺优化与控制起到一定的指导作用,对推进解决番茄酱变质腐败这一行业问题具有重要的意义。
此外,本实验首次通过测定16S V3~V4可变区域来研究番茄酱制品中的细菌微生物,通过高通量测序技术来研究番茄酱制品的微生物群落组成和丰度结构,并且对快速诊断生产中可能存在的问题提供依据,做到有的放矢地解决产业运行过程中的实际问题。通过对某一生产厂家或某段生产时期的数据采集,可以有针对性地为番茄酱胀袋问题进行数据收集及分析,为控制产品生产风险、保证产品质量安全提供良好的技术支持和精准的解决方案。
