陈山红心杉SCoT反应体系建立及引物筛选
2021-09-29娄永峰宋晓琛冷春晖陈兴彬朱新传肖复明
娄永峰,宋晓琛,冷春晖,陈兴彬,朱新传,肖复明★
(1.江西省林业科学院·江西省植物生物技术重点实验室,江西 南昌330013;2.安福县陈山林场,江西 安福343214)
杉木(Cunninghamia lanceolata)是我国重要的乡土针叶用材树种,主要分布种植在长江以南各省区。由于广泛的种植区域和悠久的栽培历史,杉木形成了一些优良的变异类型,例如红心杉、罗田垂枝杉等,其中红心杉材质坚硬、色泽独特,历来受人们青睐。陈山红心杉是红心杉的典型代表,是江西地方特色杉木优良种源,原产于江西省安福县陈山林区,因其心材红褐色且心材比例大而得名。目前有关陈山红心杉的研究主要侧重在良种选育、种苗繁育等方面,其种质资源评价、遗传结构分析等的相关研究较少。随着陈山红心杉种质资源日益减少,对陈山红心杉种质资源的收集和保存工作就显得极为重要,但迄今为止仍对陈山红心杉种质资源的基因遗传结构等知之甚少,以至于无法实施针对性保护策略。近年来,DNA分子标记发展迅速,已广泛应用于杉木等林木种质资源遗传多样性分析、种质资源评价等方面,例如,Chen等通过ISSR标记分析了福建和台湾两地的杉木遗传多样性和变异[1],Duan等利用SSR分子标记分析了南方6省700份杉木优树种质的遗传结构,并构建了核心种质[2]。
目标起始密码子多态性标记(Start codon targeted polymorphism,SCoT)是一种基于植物基因ATG起始密码子两侧的保守区域设计单引物并对基因组进行扩增,且扩增产物可用简便的琼脂糖凝胶电泳分离检测新型分子标记[3],其具有适用性广、扩增位点多态性高、获得遗传信息丰富,同时操作简单方便等优点[4-5],可用于物种的遗传多样性分析、种质资源的鉴定等方面,目前在五角枫(Acer mono)、柿(Diospyros kaki)、猕猴桃(Actinidia chinensis)、罗汉松(Podocarpus macrophyllus)等多种植物中应用[6-9]。
本研究以陈山红心杉为材料,建立并优化陈山红心杉SCoT-PCR的反应体系,筛选适合红心杉的最佳PCR反应体系,并进行引物筛选,为今后SCoT分子标记在陈山红心杉种质资源评价等研究奠定基础。
1 材料和方法
1.1 材料
供试陈山红心杉种质材料均来自江西安福县陈山林区,在前期单株选优的工作基础上,采集优树新叶,于-80℃保存备用。
采用Collard和Mackill设计的SCoT分子标记引物SCoT-01~SCoT-36,由生工生物工程(上海)股份有限公司合成。即用型常规PCR预混合溶液2×Hieff PCR Master Mix(以下简称PCR Mix)、DL5000 DNA Marker、Agarose琼脂糖等购自翌圣生物科技(上海)有限公司。
1.2 基因组DNA提取和检测
利用改良的CTAB法提取陈山红心杉新叶DNA,同时琼脂糖凝胶电泳(0.8%)进行质量分析,用微量分光光度计(Eppendorf BioSpectrometer basic)检测其浓度,并将其定量至20.0 ng·μL-1,-20℃储存备用。
1.3 SCoT-PCR体系正交设计和PCR扩增
以SCoT-17为引物,陈山红心杉DNA为模板,对影响陈山红心杉SCoT-PCR反应体系的模板DNA、PCR Mix和引物浓度等3个因素进行优化,每个因素设置4个水平,采用L16(43)正交试验(表1)。按比例将各试剂加入PCR管,然后用ddH2O补足至20.0μL。PCR扩增程序为:95℃5 min的预变性;95℃30 s的变性,55℃1 min的退火,72℃2 min的延伸,35个循环;72℃10 min的总延伸,8℃保存。PCR扩增产物经2.0%琼脂糖凝胶电泳分离检测,并在凝胶成像系统中观察、拍摄以备后续分析。体系优化试验进行3次重复。
1.4 陈山红心杉SCoT-PCR体系的单因素优化
在正交试验结果的基础上,对模板DNA、PCR Mix和引物浓度等3个因素进行进一步的单因素优化,以确定陈山红心杉SCoT-PCR的最优体系。
1.5 陈山红心杉SCoT引物的筛选
根据体系优化的结果,在最优反应体系基础上,进行陈山红心杉SCoT引物筛选。首先随机选取1个陈山红心杉DNA对36条SCoT引物进行初筛,选择保留PCR扩增条带丰富、清晰的引物,然后随机选取4个陈山红心杉DNA对初筛获得的引物进行复筛,选择保留多态性较高的引物。
1.6 数据分析
正交试验采用直观分析法进行分析,先根据PCR扩增条带数量、清晰度等进行评分,然后通过评分结果,计算出各个因素在各个水平的平均值Ki和极差R。
2 结果和分析
2.1 陈山红心杉DNA质量分析
利用改良CTAB法,提取陈山红心杉基因组DNA,经检测其OD260/OD280值在1.8~2.0之间,0.8%琼脂糖凝胶电泳分析显示(图1),其主带清晰,没有明显弥散、拖尾现象。这说明DNA质量好,纯度高,可以用于后续分析。
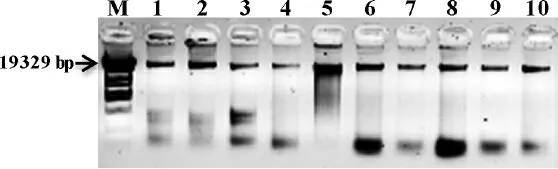
图1 DNA电泳分析Fig.1 The result of DNA electrophoresis
2.2 陈山红心杉SCoT-PCR体系正交优化分析
如图2所示,在正交设计的16个组合中不同组合扩增得到的条带数量、条带清晰度等差异较大,其中,组合9、10和13等扩增较好,条带数量丰富,且清晰亮度高,而组合4、8和16等扩增条带数量较少,且条带清晰度较弱,效果不好。依据扩增条带的数量、亮度和清晰度等指标对3次重复分别进行评分,评分范围在1~16之间,16个组合的3次重复的平均分值依次为:5.7、5.3、5.0、3.7、11.7、7.0、10.3、3.3、15.7、16.0、5.3、3.7、15.7、12.0、9.0、2.3,其中组合10获得的分值最高,其PCR扩增获得的条带数量、亮度和清晰度等均最佳,其相应体系为:PCR Mix 10.0μL,模板DNA 3.0μL(60.0 ng),引物2.5μL(1.25μmol·L-1)。
直观分析结果表明(表1),3个因素对陈山红心杉SCoT-PCR的影响依次为PCR Mix>引物浓度>模板DNA。根据K值得出的最优反应体系为:PCR Mix 9.0μL,模板DNA 3.0μL(60.0 ng),引物2.5μL(1.25μmol·L-1),其与得分最高的组合10体系基本一致,仅PCR Mix用量上存在差异。

图2陈山红心杉SCoT-PCR体系正交优化试验Fig.2 The Orthogonal test results of Red-heart C.lanceolata SCoT-PCR
2.3 陈山红心杉SCoT-PCR体系单因素优化分析
为了进一步优化反应体系,对模板DNA、PCR Mix和引物浓度这3个影响因素进行单因素分析。
模板DNA量是影响特异性扩增效率和扩增产物量的一个重要因子。结果表明(图3):当模板DNA量为10.0 ng时,扩增条带数量少,同时条带亮度较低,当模板DNA量在20.0~80.0 ng之间时,其扩增条带数量均比较丰富,且亮度高清晰,说明模板DNA量对反应体系影响较小,这与正交设计试验直观分析的结果相符。因此模板DNA量在20.0~80.0 ng均可。
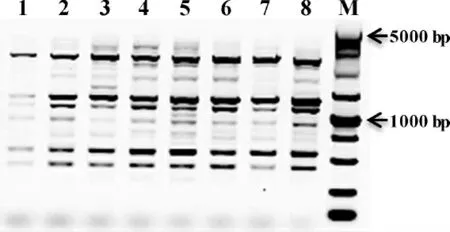
图3模板DNA量对陈山红心杉SCoT-PCR体系的影响Fig.3 The effect of DNA concentration on Red-heart C.lanceolata SCoT-PCR reaction system
PCR Mix含有dNTP、Mg2+、Taq酶等,这3种试剂对PCR反应体系的影响较大,因此对PCR Mix用量进行优化十分必要。结果显示:随着用量的增加,扩增条带数量、亮度等的综合表现呈现先升后降的趋势,当用量为8.0~11.0μL时,其扩增条带数目较多且清晰明亮,其中PCR Mix用量为9.0μL时最佳(图4)。
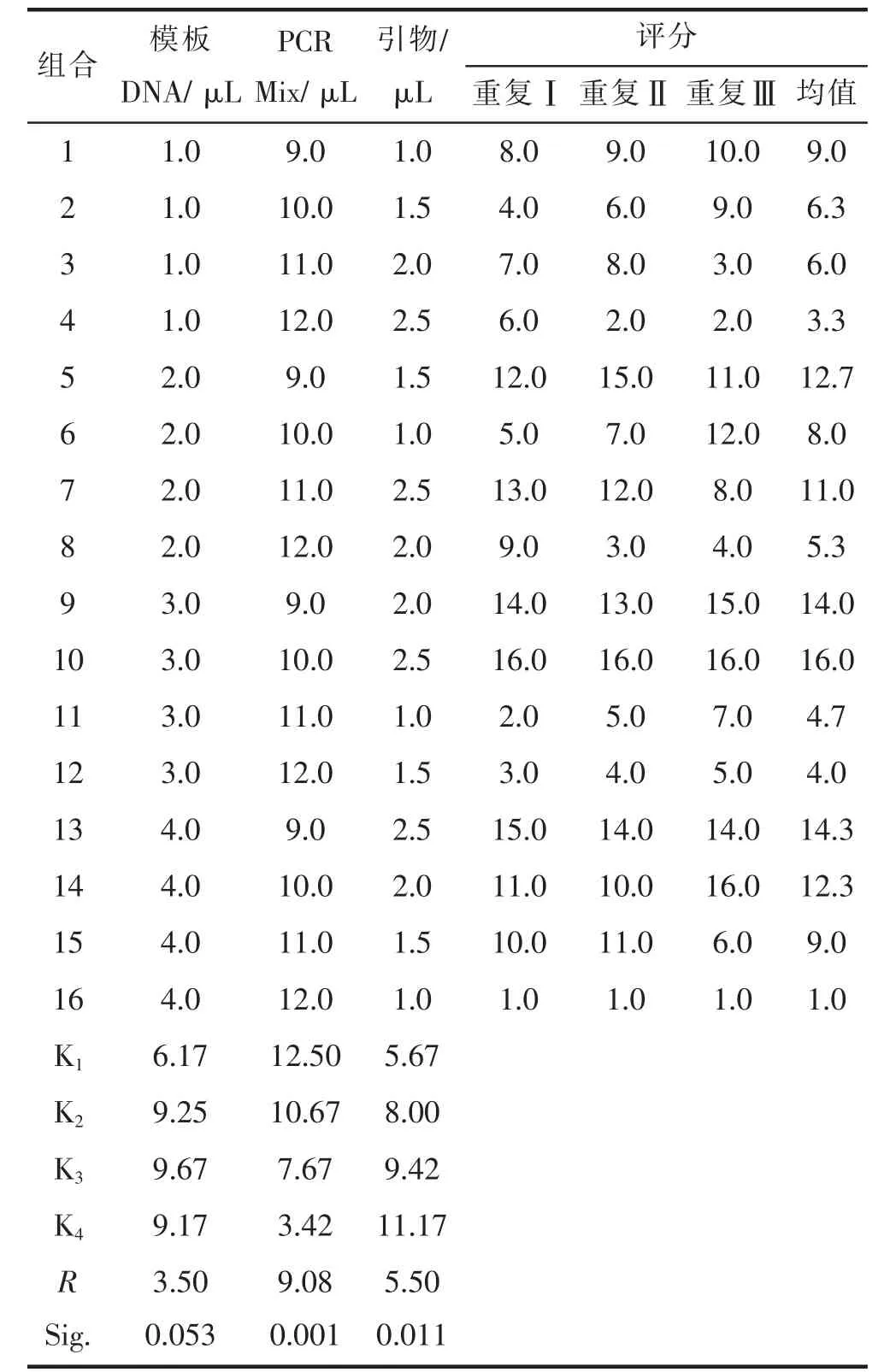
表1陈山红心杉SCoT-PCR体系优化正交设计及分析Tab.1 The Orthogonal design L 16(43)and analysis of Redheart C.lanceolata SCoT-PCR reaction system

图4 PCR Mix用量对陈山红心杉SCoT-PCR体系的影响Fig.4 The effect of the amount of PCR Mix on Red-heart C.lanceolata SCoT-PCR reaction system
此外,引物浓度也是直接影响SCoT-PCR扩增结果的一个重要因素。在8个不同的水平中,随着引物浓度的增加,其扩增效果也呈现出先扬后抑的形式,当引物浓度为0.25~0.50μmol·L-1时,PCR扩增条带较少,且部分条带暗淡不清晰;当其浓度增加至0.75~1.50μmol·L-1时,PCR扩增条明显带增多,且条带的明亮和清晰度也相应提高;而引物浓度持续增加至1.75~2.00μmol·L-1时,PCR扩增条带又出现缺失,因此确定1.50μmol·L-1为引物的最佳浓度(图5)。

图5引物浓度对陈山红心杉SCoT-PCR体系的影响Fig.5 The effect of the concentration primer on Red-heart C.lanceolata SCoT-PCR reaction system
综合考虑正交设计和单因素优化结果,结合得出SCoT-PCR反应的最优体系为:模板DNA 2.5μL(50.0 ng),PCR Mix 9.0μL,引物3.0μL(即浓度1.5 μmol·L-1),ddH2O补足至20.0μL。以随机选择的20个陈山红心杉DNA为模板,同时随机选取SCoT引物对优化获得的SCoT-PCR反应体系进行检验,结果如图6所示:在该体系下,PCR扩增条带清晰明了,易于判断,多态性较高,这表明该体系稳定性好,通用性强,适用陈山红心杉SCoT分子标记分析。
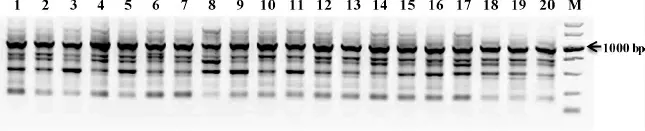
图6陈山红心杉SCoT-PCR最优体系验证(引物SCoT-35)Fig.6 Verification of the optimal Red-heart C.lanceolata SCoT-PCR reaction system(SCoT-35)
2.4 陈山红心杉SCoT引物筛选
利用优化的SCoT-PCR反应体系进行SCoT引物筛选,经过初筛和复筛,从36条SCoT引物中共筛选获得14条扩增条带丰富明亮且多态性较强的引物,可用于后续陈山红心杉SCoT标记分析(图7)。
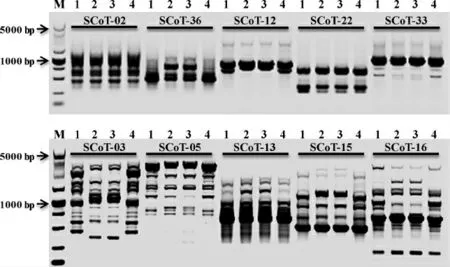
图7 SCoT引物的复筛Fig.7 The screening of SCoT primer
3 结论与讨论
SCoT是由Collard和Mackill开发的一种简单新颖的DNA分子标记[3]。本试验采用正交设计与单因素设计相结合的方法对陈山红心杉SCoT-PCR反应体系进行建立和优化,结果获得了适合于陈山红心杉的SCoT-PCR反应体系:模板DNA 2.5μL(50.0 ng),PCR Mix 9.0μL,引物3.0μL(即浓度1.5μmol·L-1),ddH2O补足至20.0μL;而各因素对陈山红心杉SCoT-PCR体系影响顺序为PCR Mix>引物浓度>模板DNA,这和耿睿曼等[10]的研究结果类似。PCR Mix含有Taq酶、Mg2+、dNTP等,在PCR反应中,Taq酶是最关键的因素,其浓度过高会引起PCR的非特异性扩增,而过低则会影响PCR扩增效果[11];Mg2+直接影响Taq酶活性,并且能影响引物与模板DNA的结合,其浓度过高可能会降低PCR扩增的特异性,而过低则影响PCR扩增产量[12];dNTPs作为PCR反应的底物,当其浓度过高,会影响碱基错配,浓度过低则影响PCR扩增效果[13]。在引物浓度和模板DNA这两个因素中,引物浓度对陈山红心杉SCoT-PCR反应体系的影响较模板DNA对其的影响大。一般PCR反应体系中引物浓度过高则会促使PCR发生非特异性扩增,而浓度过低则影响PCR扩增产量,而模板DNA在其质量得到保障的前提下其对反应的影响较小[14]。
本研究初步建立及优化获得了陈山红心杉SCoT-PCR反应体系,并在其有效的验证基础上利用该反应体系筛选了14条适合于陈山红心杉SCoT标记分析的引物,这为今后利用SCoT分子标记研究陈山红心杉遗传多样性、种质资源鉴定等研究奠定了基础。
