模拟溃疡性结肠炎实验模型大鼠TXNDC5基因表达的变化
2021-09-29侯艳红刘浩润
张 林,侯艳红,杨 汨,刘浩润
中国人民解放军总医院第八医学中心消化科,北京 100091
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不明确的慢性非特异性炎症性肠病,目前认为可能与免疫、感染、菌群失调等多种因素有关。但越来越多的研究提示,一些炎症相关基因可能在疾病发生、发展及转归中发挥着重要的作用[1-3]。硫氧还蛋白5(TXNDC5)基因是近年来新发现的蛋白分子,为上皮PDI家族成员,是由324个氨基酸残基组成的蛋白质。国外研究者于2003年首次在肝组织细胞内质网中确认该蛋白分子的存在[4],目前国内外有关该蛋白分子的研究较少,其功能意义尚未完全明确。但最近越来越多的研究[5]提示,在类风湿性关节炎、自身免疫性疾病及宫颈癌、肺癌等肿瘤及多种人类疾病发生、发展中可能具有一定的意义。本研究组在前期的胃癌癌前炎症性疾病研究中与周围正常胃黏膜组织差异蛋白检测证实TXNDC5在这类癌前炎症病变中表达显著上升[6]。该分子属于炎症反应密切相关的分子,关于其与UC的关系目前尚无研究报道,本研究旨在通过实验证实TXNDC5在UC中的表达情况,继而为下一步在疾病中功能意义的研究打下基础。
1 材料与方法
1.1 实验动物健康成年SPF级雄性SD大鼠41只,体质量195~215 g,由解放军第八医学中心动物实验室提供,为一级动物,合格证号:H00117。动物实验室温度保持22~26 ℃,相对湿度(50±5)%,保持通风换气(气流速度10~25 cm/s,换气频率8~15次/h)。在此条件下完成实验动物造模。
1.2 药品与试剂2,4,6-三硝基苯磺酸由中国人民解放军第八医学中心制剂室提供。柳氮磺胺吡啶由上海三维制药有限公司生产(批号:200811C12);TNBS(Sigma);DEPC(Sigma);RT Reagents,PCR Reagents,DNA Marker(TaKaRa);Trizol(Invitrogen);TXNDC5单克隆抗体(北京博奥森生物工程开发有限公司);SP免疫组化染色试剂盒、DAB染色试剂盒(北京中山生物技术有限公司)。
1.3 研究方法
1.3.1 模拟UC实验性结肠炎动物模型建立:参考王皓等[7]的造模方法,实验动物为SD大鼠,雄性,6~8周龄,体质量195~215 g。随机选取29只大鼠用2,4,6-三硝基苯磺酸/乙醇灌肠制备拟UC实验性结肠炎模型,另选取12只为空白对照,共计41只实验大鼠。如有死亡及其他情况造模失败退出实验,取同等数量同条件大鼠替代完成实验。进入实验前禁食24 h,可饮水,使用特制固定器固定大鼠后,用直径2 mm的硅胶软管轻插至结肠8 cm处,缓慢推入0.5 ml含TNBS 30 mg的30%乙醇溶液,动作要轻柔,灌入后持续倒置10 min。随后观察大鼠一般情况,4 d后,随机抽取5只造模鼠处死,取其结肠标本,大体及组织病理观察确认类似人类UC的溃疡形成等病理变化可判定造模成功。
1.3.2 动物模型观察治疗:造模成功后的24只大鼠随机分为2组,每组12只,分别为模型组(生理盐水2 ml灌胃)、柳氮磺胺吡啶组(0.50 g/kg 2 ml药物灌胃)和12只空白对照大鼠为空白对照组(生理盐水2 ml灌胃),各组灌胃1次/d,共持续4周。
1.3.3 标本获取及检测:各组完成灌胃实验4周后,2%乌巴比妥钠腹腔麻醉(3 ml/kg),行开腹手术留取距肛门以上8 cm处结肠标本,取完整结肠组织,生理盐洗净肠内容物,部分结肠组织置于-70 ℃的液氮中保存,另取部分结肠组织用10%福尔马林溶液固定。
1.3.4 TNXDC5基因表达免疫组化检测:10%福尔马林溶液固定的组织块按照常规切片制片处理,参照免疫试剂盒说明书进行免疫组化检测TNXDC5基因表达。TXNDC5蛋白阳性主要为黏膜细胞胞质棕色颗粒,采用免疫组化阳性细胞计数法分析,在40倍光镜下随机选择10个不重叠视野,计数阳性着色细胞数,每只大鼠选3张切片,每组12只大鼠全部计数,而后求出每张切片平均阳性细胞数进行组间比较。
1.3.5 TNXDC5基因表达RT-PCR检测:取大鼠结肠组织150 mg左右,使用异硫氰酸胍一步法提取总RNA(Code:D9108,TaKaRa大连宝生物有限公司),所提取总RNA液经紫外分光光度计测定A260/A280值,计算RNA的纯度。使用PrimeScriptTMRT reagent Kit(Code:DRR037A,TaKaRa大连宝生物有限公司)反转录合成cDNA,所有操作均严格按照说明书进行,将所得25 μl产物冻存于-20 ℃冰箱以备进行PCR。采用常规PCR法检测,扩增标本以β-actin作为内参对照,计算检测结果以正常标本作为对照。TNXDC5 PCR扩增引物由北京塞百盛基因技术有限公司合成,上游引物(5′-3′):CTCTGGGCCTTGAACATT;下游引物(3′-5′):CCCTCAGTGACTCCAAA,扩增片段为413 bp。以DNA Marker(DL2000)作为标准分子量标记,以相应的内参电泳条带作为参照,结果以两者的积分吸光度的比值表示,后求各组平均值进行组间比较。
1.3.6 TNXDC5基因表达的Western blotting检测:Bradford法测定蛋白质含量。常规制备10%分离胶和5%积层胶,按每孔50 μg的蛋白量加样,样品加等体积的5×蛋白上样缓冲液,上样前将样品在沸水中加热10 min,进行SDS-PAGE电泳。电泳后进行转膜,将分离蛋白质转移至PVDF膜上。PVDF膜于质量浓度为50 g/L的脱脂奶粉TBS中室温孵育2 h封闭非特异性抗原。而后加1∶1 000 PBS稀释的一抗4 ℃孵育过夜。用TBS液洗膜3次,10 min/次,滴加二抗工作液室温下孵育2 h,再TBS洗膜3次,10 min/次。随后滤纸吸干残液,完成显色及显影定影。Western blotting检测以β-actin为内参对照,用图像分析软件IPP 6.0对图像进行灰度分析,结果以目的条带与内参条带灰度的比值表示,而后求各组平均值进行组间比较。
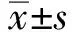
2 结果
2.1 模拟UC大鼠模型建立情况建模大鼠结肠标本大体表现可见肠管轻度肿胀,浆膜面光整,结肠组织与周围组织无明显粘连,肠黏膜充血、水肿较明显。可见明显溃疡形成,溃疡呈散在分布,部分可见融合呈片状,可见脓血性分泌物附着。结肠组织HE染色显微镜下可见黏膜、黏膜下层溃疡形成及炎性渗出物,淋巴组织增生,大量中性粒细胞浸润,杯状细胞减少,黏膜下层出血、水肿,毛细血管扩张等改变。空白对照组大鼠结肠黏膜完整,光滑,腺体层次清楚、清晰可见,未见溃疡形成(见图1)。
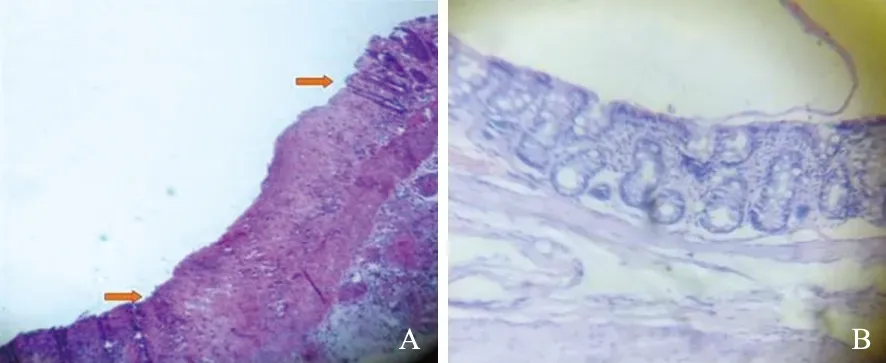
注:A:模型组大鼠结肠组织可见明显溃疡形成,两箭头之间可见黏膜上皮消失,炎症渗出明显可见炎症细胞浸润,但黏膜下层仍较为完整。B:空白对照组大鼠结肠组织可见黏膜层上皮完整无溃疡形成,无炎性细胞浸润。
2.2 TNXDC5基因表达免疫组化检测结果模型组大鼠结肠阳性细胞可见细胞质出现均匀一致棕黄色颗粒(见图2)。与空白对照组比较,模型组和柳氮磺胺吡啶组大鼠结肠组织TNXDC5基因表达明显升高(P<0.05);与模型组比较,柳氮磺吡啶组TNXDC5基因表达显著降低(P<0.05,见表1)。
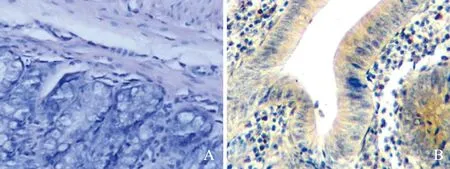
注:A:免疫组化阴性对照;B:模型组TXNDC5免疫组化染色情况,可见棕黄色颗粒主要定位于上皮及部分间质细胞胞浆中。
表1 免疫组化检测各组结肠黏膜TNXDC5基因表达
2.3 TNXDC5基因表达RT-PCR检测结果与空白对照组比较,模型组大鼠TNXDC5 mRNA表达显著升高(P<0.05)。与模型组比较,柳氮磺胺吡啶组TNXDC5 mRNA表达显著降低(P<0.05)。与空白对照组比较,柳氮磺胺吡啶组TNXDC5 mRNA表达显著升高(P<0.05,见表2、图3)。
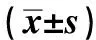
表2 各组大鼠结肠组织TNXDC5 mRNA表达Tab 2 The expression of TNXDC5 mRNA in colon tissue of rats in each group

图3 各组大鼠结肠组织TNXDC5 mRNA表达RT-PCR检测
2.4 TNXDC5基因表达Western blotting检测结果与空白对照组比较,模型组大鼠TNXDC5蛋白质表达显著升高(P<0.05)。与模型组比较,柳氮磺胺吡啶组TNXDC5蛋白质表达显著降低(P<0.05)。与空白对照组比较,柳氮磺胺吡啶组TNXDC5 蛋白质表达也有所升高,但差异无统计学意义(P>0.05,见表3、图4)。
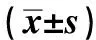
表3 各组大鼠结肠组织TNXDC5蛋白质表达Tab 3 The expression of TNXDC5 protein in colon tissue of rats in each group

图4 各组大鼠结肠组织TNXDC5蛋白质表达Western blot-ting检测
3 讨论
UC是一种原因尚未完全明确的结肠非特异性炎症性疾病,长期以来在欧美等西方国家高发。但随着饮食等生活习惯的西化,亚洲地区UC发病率由20世纪末的0.6/10万迅速升至2013年的3.44/10万[8],近年来仍有快速上升的趋势,目前已经成为消化系统的常见疾病。UC的发病机制目前尚未完全明确,众多的研究结果提示,免疫、感染、血管病变、神经内分泌等因素均可能参与疾病的发生及发展。但各类因素最终的结果是促发了结肠黏膜广泛的炎症反应,诸多的炎症调节因子表达异常,最终引发肠道黏膜的病理改变。炎症调节因子参与免疫反应和炎症过程,是当前研究UC发病机制的热点之一[9-11]。因此,目前这些炎症调节因子成为了控制炎症反应的关键,以此类分子为靶点的药物已表现出了很好的治疗效果。TNXDC5是新近研究发现的一个具有促进炎症反应功能的分子,关于该分子在UC中的意义目前未见报道,本研究组在该项研究中先行探讨了其在UC中的表达情况。
TXNDC5(thioredoxin domain containing protein 5)也称为ERP46(endoplasmic reticuium 46)或endoPDI(endothelial protein-disulfide isomerase),是2003年发现的新蛋白质二硫键异构酶(protein disulfide isomerase,PDI)家族成员。基因定位染色体6p24.3区。综合目前的研究认为,该基因表达产物具有调节蛋白质合成、细胞抗氧化、参与TNF-α介导的血管形成过、参与细胞代谢、促进炎症反应、促进组织纤维化等功能[12-14]。关于TXNDC5的促炎作用机制,国内外可以见到部分报道,Charlton等[15]研究认为,TXNDC5通过与脂联素受体1结合,激活其下游的信号传导途径进而促进多种炎症因子的表达参与细胞炎症过程。Li等[16-17]研究认为,TXNDC5可能通过抑制胰岛素信号通路IGFBPI表达调节下游各类促炎因子的表达参与类风湿性关节炎(rheumatoid arthritis,RA)病变过程。本研究组的前期结果表明,TXNDC5在胃癌细胞中表达显著升高[18],但在消化系统重要的炎症性疾病UC中的表达情况国内外未见报道。本研究通过免疫组化法、RT-PCR法、Western blotting法等对实验性UC模型大鼠结肠组织TXNDC5的表达情况进行了检测,结果提示模型组表达显著升高,而经过临床常用的抗炎药物柳氮磺胺吡啶治疗后表达可显著降低。这一结果提示在UC这种疾病炎症发生、发展的过程中TXNDC5可能起到了一定的作用。TXNDC5在UC发生、发展中的作用机制及干预其表达对于UC的治疗意义将是我们下一步研究的重点。
本研究中也存在一定的缺陷,首先实验是基于动物模型的研究,人体研究由于病例选择及组织标本收集困难,将在下一步研究组逐步开展。研究中在使用Western blotting法检测组织TNXDC5蛋白表达情况时,柳氮磺胺吡啶治疗组与空白对照组之间差异无统计学意义,出现这一情况的原因可能在于本身该基因表达量较低,差异不易显现,另外Western blotting法检测中样本处理与操作可能也影响结果。后续的实验中将改进方法进一步验证。
