CalliSpheres载药微球栓塞介入与甲磺酸阿帕替尼联合治疗晚期肝癌的疗效及预后观察
2021-09-29刘震坤张建磊尹朝晟全凌峰
刘震坤,张建磊,尹朝晟,刘 固,全凌峰
湖南省郴州市第一人民医院 1.介入科; 2.普外科; 3.放疗中心,湖南 郴州 423000
肝癌是世界最常见的5种恶性肿瘤之一,起病较为隐匿,出现临床症状时已进展至中晚期,甚至出现肝外转移,具有较高病死率[1-2]。因晚期肝癌已存在肿瘤细胞扩散、远处转移现象,丧失手术切除机会,临床应用较为广泛的治疗手段为肝动脉化疗栓塞,CalliSpheres载药栓塞微球为国内研发的新型栓塞物,相对于传统碘油动脉化疗栓塞,具有更高安全性、效价比[3]。但栓塞介入术后缺血、缺氧所致的肿瘤新生血管形成,为肿瘤复发并导致栓塞介入治疗失效重要因素。甲磺酸阿帕替尼为酪氨酸激酶抑制剂,可抑制肿瘤血管生成,已有研究将其用于胃癌、食管癌治疗,并取得良好干预效果[4-5]。鉴于此,本研究尝试分析CalliSpheres载药微球栓塞介入与甲磺酸阿帕替尼联合治疗晚期肝癌的效果及对患者生存状况的影响。具体分析如下。
1 资料与方法
1.1 一般资料选取2017年2月至2019年12月我院晚期肝癌患者82例,以随机单盲法分为观察组(n=41)、对照组(n=41)。两组患者年龄、体质量、性别、病因、肝功能Child分级及卡氏评分均衡可比(P>0.05)(见表1)。

表1 一般资料比较Tab 1 Comparison of general information
1.2 纳入及排除标准纳入标准:符合《原发性肝癌诊疗规范(2017年版)》晚期肝癌诊断标准[6];经病理学确诊为原发性肝癌;无化疗禁忌证;巴塞罗那临床肝癌分期为C期;卡氏评分>60分;无法进行外科手术切除,且术前未接受其他治疗;知情本研究并签署同意书。排除标准:存在远处转移病灶;合并门静脉或胆管癌栓;存在肝动脉化疗栓塞术禁忌者;经临床或病理确诊为转移性肝癌;肝腺癌、混合型肝癌;合并严重心脑血管疾病、肾脏疾病;伴有肝昏迷、肝性脑病及意识障碍者;伴有凝血功能异常者;大量腹腔积液或顽固性腹腔积液者。
1.3 方法对照组予以CalliSpheres载药微球栓塞介入治疗,于患者大腿根部实施Seldinger改良血管穿刺术,穿刺皮肤,将导管插入股动脉、腹主动脉,最后进入肝动脉,尽量插入肝癌组织供血血管,开展肝动脉造影,经微导管向肝癌组织供血靶动脉注入CalliSpheres载药栓塞微球(加载表柔比星60~80 mg),闭塞靶动脉,阻断肿瘤组织血供,缓慢释放化疗药物持续攻击肿瘤。栓塞终点为:栓塞剂于导管尖端停滞或反流、肿瘤门静脉小分支显影、术后造影肿瘤染色消失及主干血管保留。1次/月,共计3次。
观察组在对照组基础上联合甲磺酸阿帕替尼(江苏恒瑞医药股份有限公司,国药准字:H20140103)治疗,250 mg/次,1次/d,餐后30 min温开水送服,均治疗3个月。
1.4 疗效评估标准参照改良实体瘤疗效评价标准[7]评定两组患者近期疗效。完全缓解:动脉增强期所有靶病灶显影均消失,且持续时间>4周;部分缓解:肿瘤靶病灶最大径较基线缩小≥30%,无新病灶出现,且持续时间>4周;疾病稳定:肿瘤靶病灶最大径较基线缩小<30%或增加<20%,无新病灶出现,且持续时间>4周;疾病进展:肿瘤靶病灶最大径较基线增加≥20%或有新病灶出现。总有效率=(部分缓解例数+完全缓解例数)/总例数×100%。
1.5 观察指标(1)治疗总有效率。(2)肿瘤恶性生物学行为指标水平。分别于治疗前、治疗2个月、3个月后通过穿刺活检获取肝癌病灶,加入蛋白裂解液后提取病灶内总蛋白,采用酶联免疫吸附试剂盒测定亮氨酸拉链EF-hand结构域跨膜蛋白1(LETM1)(武汉博士德生物工程有限公司,试剂盒目录号:EK5097)、磷脂酰肌醇3激酶(PI3K)(上海邦景实业有限公司,试剂盒目录号:BJ-H64511)、细胞周期蛋白D1(CyclinD1)(上海西格生物科技有限公司,试剂盒目录号:XG-E102298)、波形蛋白(Vimentin)(上海西格生物科技有限公司,试剂盒目录号:XG-E102982)、N-钙黏蛋白(N-cadherin)(上海西格生物科技有限公司,试剂盒目录号:XG-E198927)水平。(3)血管生成指标。分别于治疗前、治疗2个月、3个月后采集患者肘正中静脉血3 ml,以3 500 r/min转速离心10 min,取上清液,保存于-20 ℃冰箱内待检。采用酶联免疫吸附测定法进行血清碱性成纤维细胞生长因子(bFGF)(试剂盒目录号:XG-E99094)、血管内皮细胞生长因子(VEGF)(试剂盒目录号:XG-E99107)测定,以上试剂盒均由上海西格生物科技有限公司提供。采用微血管密度(MVD)测定方法:在40倍光学显微镜下选取肿瘤微血管密度聚集区3个,在200倍光学显微镜下,对所选取的3个区域染成棕色微血管数目进行计数,统计最后结果,取平均值。(4)肿瘤标志物指标水平。取血清标本,采用电化学发光免疫法检测血清甲胎蛋白(AFP)水平,采用亲和吸附离心管分离化学发光法测定甲胎蛋白异质体3(AFP-L3)(试剂盒目录号:XG-H102639)水平,采用碘苯酚增强化学发光酶免疫法检测血清高尔基蛋白73(GP73)(试剂盒目录号:XG-E101384),试剂盒均购自上海西格生物科技有限公司。(5)不良反应(血液学毒性、声音嘶哑、血压升高、心脏毒性、上消化道出血、手足综合征)。(6)随访统计治疗后6个月、9个月、12个月生存率等。
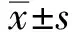
2 结果
2.1 临床疗效观察组治疗3个月后总有效率(65.85%)较对照组(41.46%)高,差异有统计学意义(χ2=4.904,P=0.027)(见表2)。

表2 两组治疗3个月后临床疗效比较[例数(%)]Tab 2 Comparison of clinical efficacy between the two groups after 3 months of treatment [n(%)]
2.2 肿瘤恶性生物学行为指标水平整体分析显示,两组肝癌组织中LETM1、PI3K、CyclinD1、Vimentin、N-cadherin水平组间、不同时间点及交互作用相比,差异有统计学意义(P<0.05),观察组肝癌组织中LETM1、PI3K、CyclinD1、Vimentin、N-cadherin水平降低幅度更明显。进一步两两比较,组间比较,两组治疗前上述肝癌组织中各指标水平相比,差异无统计学意义(P>0.05),观察组治疗2个月、3个月后上述肝癌组织中各指标水平均低于对照组,差异有统计学意义(P<0.05);组内比较,两组治疗2个月、3个月后上述肝癌组织中各指标水平均较本组治疗前降低,差异有统计学意义(P<0.05)(见表3)。
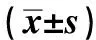
表3 两组治疗前后肿瘤恶性生物学行为指标水平比较Tab 3 Comparison of malignant biological behavior indexes between the two groups before and after treatment
2.3 血管生成指标整体分析显示,两组血清bFGF、VEGF与MVD水平组间、不同时间点及交互作用相比,差异有统计学意义(P<0.05),观察组血清bFGF、VEGF与MVD水平降低幅度更明显。进一步两两比较,组间比较,两组治疗前上述指标水平相比,差异无统计学意义(P>0.05),观察组治疗2个月、3个月后上述指标水平均低于对照组,差异有统计学意义(P<0.05);组内比较,两组治疗2个月、3个月后上述指标水平均较本组治疗前降低,差异有统计学意义(P<0.05)(见表4)。
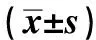
表4 两组治疗前后血管生成指标比较Tab 4 Comparison of angiogenesis indexes between the two groups before and after
2.4 肿瘤标志物指标水平整体分析显示,两组血清AFP、GP73、AFP-L3水平组间、不同时间点及交互作用相比,差异有统计学意义(P<0.05),观察组血清AFP、GP73、AFP-L3水平降低幅度更明显。进一步两两比较,组间比较,两组治疗前上述血清指标水平相比,差异无统计学意义(P>0.05),观察组治疗2个月、3个月后上述血清指标水平均低于对照组,差异有统计学意义(P<0.05);组内比较,两组治疗2个月、3个月后上述血清指标水平均较本组治疗前降低,差异有统计学意义(P<0.05)(见表5)。
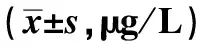
表5 两组治疗前后肿瘤标志物指标水平比较Tab 5 Comparison of tumor markers between the two groups before and after treatment
2.5 不良反应发生率观察组血压升高、心脏毒性、上消化道出血、手足综合征发生率(21.95%、24.39%、19.51%、14.63%)较对照组高(4.88%、7.32%、2.44%、0),差异有统计学意义(P<0.05);观察组血液学毒性、声音嘶哑发生率(73.17%、4.88%)与对照组(65.85%、2.44%)比较,差异无统计学意义(P>0.05)(见表6)。

表6 两组不良反应发生率比较[例数(%)]Tab 6 Comparison of adverse reaction rates between the two groups [n(%)]
2.6 生存情况经治疗后1年随访,共有4例患者脱落,观察组、对照组各脱落2例。两组治疗后6个月生存率相比,差异无统计学意义(P>0.05);观察组治疗后9个月、12个月生存率(64.10%、51.28%)较对照组(41.03%、28.21%)高,差异有统计学意义(P<0.05)(见表7、图1)。
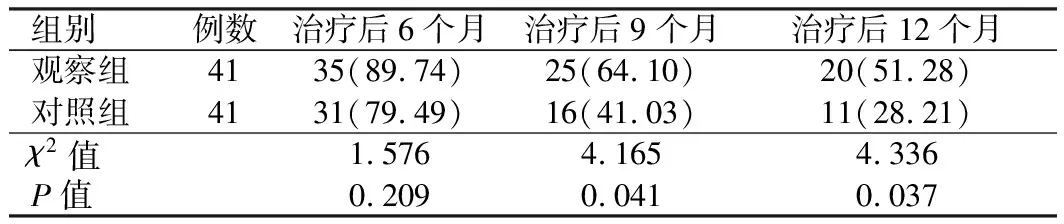
表7 两组生存情况比较[例数(%)]Tab 7 Comparison of survival between the two groups [n(%)]
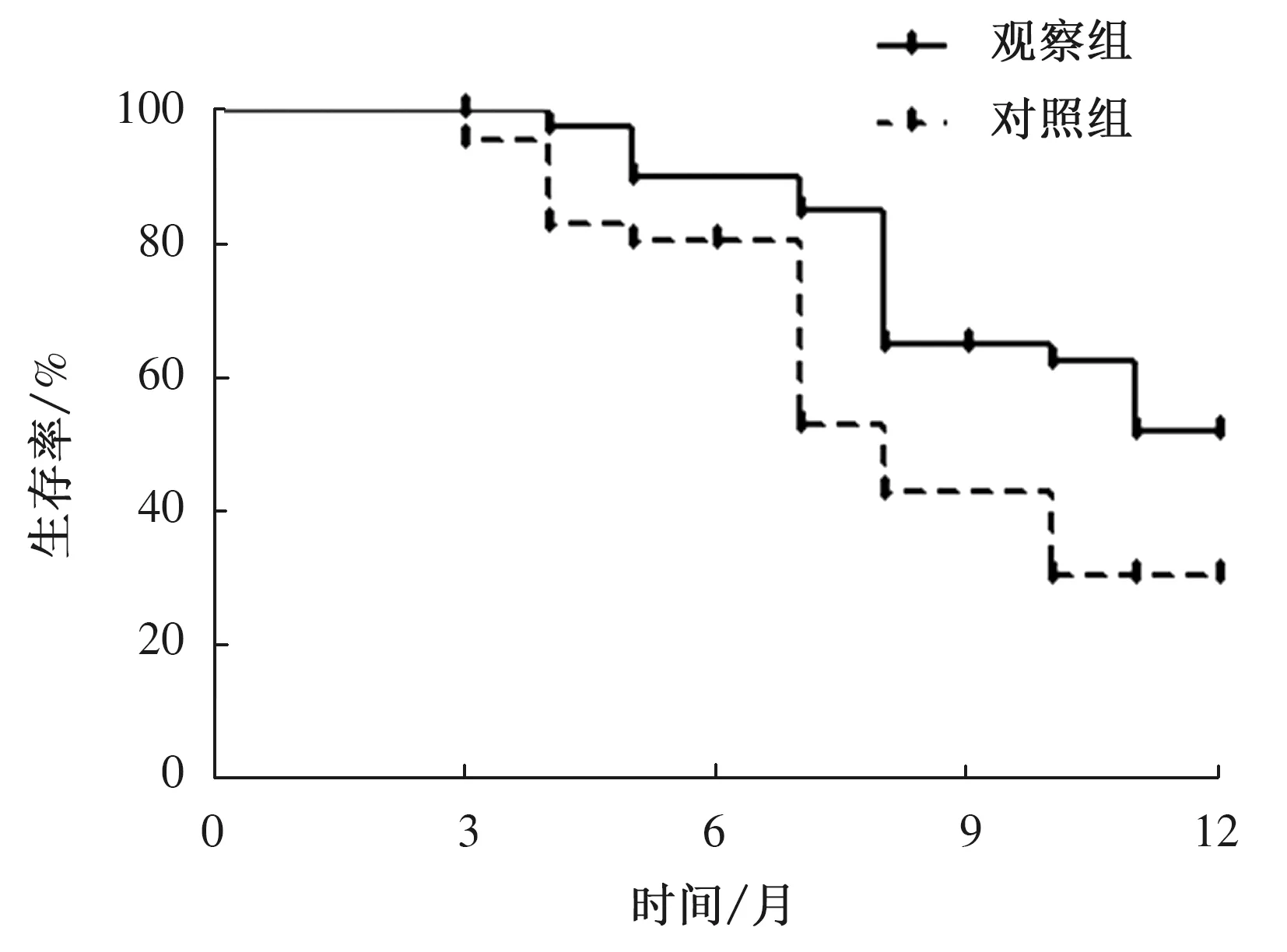
图1 两组生存曲线Fig 1 Survival curves of two groups
3 讨论
随着社会发展、生活方式转变等,我国肝癌发病率逐渐升高,约90%以上患者存在病毒性肝炎、酒精性脂肪肝等既往病史[8]。报道显示,我国肝癌患者死亡人数占世界肝癌死亡人数的50%,巨大疾病负担已构成我国公共卫生问题[9]。因此,选择恰当有效的治疗方案,延长晚期肝癌患者生存周期,已成为临床亟需解决问题。
CalliSpheres载药微球是中国首款自主研发用于肝癌治疗的栓塞微球,其材质由聚乙烯醇构成,形态为球形,结构稳定,主要特点为可变弹性,微球在微导管内可压缩变小,释放至靶血管后可恢复本身形态,且微球之间可相互聚积,永久性栓塞远端分支血管[10]。动物实验表明[11],载药微球注入兔子肝脏血管内1个月后,血管周围200 μm处仍可检测到化疗药物浓度,表明微球可长期释放化疗药物于肿瘤组织,以达到更佳疗效。近年来,甲磺酸阿帕替尼逐渐应用于肝细胞癌患者,廖景升等[12]对晚期原发性肝癌患者甲磺酸阿帕替尼治疗效果进行探讨,发现中位生存期为7.2个月、总缓解率达60.0%均明显高于支持治疗。本研究尝试将CalliSpheres载药微球栓塞介入与甲磺酸阿帕替尼联合用于晚期肝癌,发现与对照组比较,治疗3个月后总有效率显著提高,血清bFGF、VEGF与MVD水平降低幅度明显,治疗后9个月、12个月生存率显著提高,与上述研究结果具有相似性。甲磺酸阿帕替尼于2014年在我国自主研发上市,是一种高度选择性地小分子血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂,具有较高靶向结合率,其作用机制为高度选择性竞争细胞内VEGFR2的ATP结合位点,有效阻断下游信号传导,有利于体内VEGF水平在CalliSpheres载药微球栓塞介入术后更快地得到控制,抑制肿瘤组织新血管生成,进而获得较佳联合治疗效果,延长患者生存周期[13]。因化疗药物不良反应较大,本案研究对比两组不良反应发生情况,发现两组在血液学毒性、声音嘶哑上无差异,但CalliSpheres载药微球栓塞介入、甲磺酸阿帕替尼联合治疗在其他不良反应,如血压升高、心脏毒性、上消化道出血、手足综合征上发生率明显升高,故联合治疗期间,需及时评估不良反应发生情况,并予以对症处理,以确保治疗安全性。
肝癌相关病理研究证实,肝癌病理进展中,癌细胞侵袭、增殖可造成多种肿瘤标志物合成分泌增多[14]。GP73为跨膜蛋白,在细胞增殖过程中转运至细胞外并经剪切过程分泌进入血液循环[15];AFP为肝癌诊断标志物,在病程中表达显著增多,AFP-L3为AFP糖基化侧链修饰后产物之一,在肝癌细胞中呈特异性高表达[16]。由本研究数据可知,观察组血清AFP、GP73、AFP-L3表达明显降低,考虑这一结果可能与二者联合能够有效促进肿瘤凋亡及抗肿瘤血管生成有关。侵袭、增殖是包括肝癌在内所有恶性肿瘤共同生物学特点,血清肿瘤标志物虽可反映肝癌细胞增殖、侵袭活跃程度,但无法直观反映病灶内癌细胞恶性生物学行为[17]。LETM1为肝癌病灶内调节癌细胞增殖关键基因,高表达的LETM1可造成ATP生成增多、下游信号通路PI3K/AKT处于持续激活状态,与多种细胞异常增殖密切相关[18];Vimentin、N-cadherin为上皮间质标志物,可参与上皮间质转化过程,呈高表达水平时可降低细胞间极性、促进细胞侵袭[19];CyclinD1可介导细胞周期由G1期向S期转换、促进细胞增殖,加速细胞周期进程,利于细胞恶性转化[20]。为明确CalliSpheres载药微球栓塞介入与甲磺酸阿帕替尼联合治疗对晚期肝癌患者肿瘤恶性生物学行为的影响,作者对上述增殖基因表达量进行分析,发现观察组肝癌组织中LETM1、PI3K、CyclinD1、Vimentin、N-cadherin水平明显低于对照组,说明采用CalliSpheres载药微球栓塞介入治疗杀灭肿瘤细胞同时,应用甲磺酸阿帕替尼可在一定程度上限制肿瘤恶性生物学行为,具体表现为抑制促增殖基因表达,有助于预防肝癌转移、复发,但其作用机制还需进一步深入探究。
综上可知,CalliSpheres载药微球栓塞介入与甲磺酸阿帕替尼联合治疗晚期肝癌效果显著,可抑制血管生成,通过降低血清AFP、GP73、AFP-L3水平,抑制癌细胞侵袭、增殖,降低肿瘤恶性生物学行为,明显提高生存率,但不良反应较多。还需开展大样本及长期随访研究,以便进一步验证本研究结论。
