粪菌移植对肠易激综合征模型大鼠内脏敏感性及免疫功能的影响
2021-09-29韩棉梅宋雨鸿王蔚琳梁嘉恺
韩棉梅,马 军,宋雨鸿,张 洁,王蔚琳,梁嘉恺
1.广州市第一人民医院中医科,广东 广州 510180;2.广州医科大学附属第二医院中医科
肠易激综合征(irritable bowel syndrome,IBS)是一种发作性的腹痛、腹胀并伴随排便习惯以及大便性质发生改变的胃肠功能紊乱性疾病。流行病学调查显示,IBS的患病率为11.2%,然而仅有30%明显腹部不适的患者得到确切的治疗,大部分症状并未得到重视[1-2]。IBS患者的发病机制目前尚不清楚,主要认为与患者的焦虑或抑郁等心理状态导致的内脏敏感性增高有关,内脏敏感性增高常可导致患者对生理性刺激感受的阈值大大降低,反应性增强[3]。有关研究表明,以腹泻为主的IBS患者进行直肠扩张试验的耐受性显著低于正常患者,内脏的高敏性可能参与了该过程,同时肥大细胞也发挥了重要作用[4]。粪菌移植(fecal microbiota transplantation,FMT)是指将健康人群的粪便以混悬液的形式输入到患者体内以改善患者肠道微生物环境[5]。FMT治疗艰难梭菌性肠炎的有效率高达90%,可调节肠道代谢产物,显著改善肠道菌群失调症状[6]。一项对13例溃疡性结肠炎患者行FMT治疗的研究表明,70%的患者肠道炎症得以改善,临床症状缓解[7]。另有研究发现,纳入研究的83例IBS患者FMT治疗3个月后,症状缓解率为65%,明显高于对照组(43%)[8]。然而目前对于FMT治疗IBS的具体机制报道较少见。为此,本研究选取SD大鼠为研究对象,构建IBS动物模型并初步探讨FMT对IBS大鼠的内脏敏感性及免疫功能的具体作用。
1 材料与方法
1.1 实验动物选取6~8周龄SPF级SD大鼠60只,雌性,体质量200~220 g,购自广东省实验动物中心,购进后适应性饲养1周,12 h光照/12 h黑暗,自由给食物和水。
1.2 仪器与试剂气囊导尿管购自上海生工生物有限公司,石蜡切片机购自德国徕卡公司,离心机、全自动酶标仪购自美国伯乐公司,光学显微镜购自日本奥林巴斯公司,电子天平购自北京赛多力斯科有限公司,ELISA试剂盒购自北京中杉金桥试剂公司。
1.3 动物模型的构建将60只SD大鼠根据体质量及整体状态均匀分为正常组、IBS组和FMT组,每组各20只,并采用化学刺激的方法对IBS组和FMT组大鼠构建IBS动物模型。具体方法为:将购进的芥末油用食用油稀释至5%浓度后,以5 cm长度套管针吸取0.5 ml,于每天上午大鼠排便后进行灌肠,至大鼠直肠5 cm长度时注入,1次/d,连续灌肠14 d停止灌肠。
1.4 粪便滤液的制备以及FMT的方法粪便滤液的制备参照相关文献[9]进行。在造模完成后次日将制备好的健康SD大鼠粪便滤液(15 g/kg)给予FMT组大鼠进行灌肠治疗,2次/d,每次0.5 ml,隔日进行,共灌肠治疗6次;正常组和IBS组给予等量生理盐水平行操作。
1.5 检测指标
1.5.1 一般情况检查:观察各组大鼠造模及进行FMT治疗前后整体状态,如饮水、饮食、体质量、大便、有无死亡等情况,计算疾病活动指数(disease activity index,DAI)。
1.5.2 粪便标本菌群分析:治疗后次日早晨8∶00收集2 g左右大鼠自然排出的粪便,并迅速放置-80 ℃冻存,利用指纹图谱技术分析各组大鼠粪便中的肠道菌群差异性。
1.5.3 内脏敏感性评估与反射次数:于检测前将SD大鼠禁食物和水24 h,实验前触动大鼠肛门促使其排便后进行实验;首先以乙醚麻醉大鼠,随后将导尿管插于石蜡油涂抹后的肛门,固定导尿管气囊使得与肛门距离1 cm左右,并用白色布胶带将其固定于大鼠尾部;待大鼠麻醉苏醒后将其置于笼内并限制其运动,只能上下活动,不可前后活动,适应30 min后向气囊内注入22~28 ℃的生理盐水以扩张肠道,仔细观察大鼠抬起腹部和背部拱起所需的注射的生理盐水量,重复操作3次取其平均值。根据腹壁撤离反射(abdominal wall withdrawal reflex score,AWR)评分评估SD大鼠的内脏敏感性,具体标准[10]为:大鼠对结直肠扩张无行为学反应记为0分;大鼠头部运动减少但身体仍静止不动记为1分;大鼠腹肌出现收缩并且腹部离开桌面记为3分;大鼠骨盆抬起并伴有身体弓形记为4分。此外,检测注水量为1.5 ml时,记录3 min内大鼠腹部收缩反射次数。
1.5.4 HE染色评估大鼠结肠组织病理情况:内脏敏感性实验结束第2天,采用5%的水合氯醛麻醉大鼠,选取大鼠结肠病变明显的节段,依次进行4%多聚甲醛固定、冲洗、脱水、包埋、石蜡切片并进行HE染色评估病理节段结肠组织病理学。
1.5.5 ELISA法检测大鼠结肠及外周血中组胺与5-HT水平:上述病理组织取出后眼球取血,静置数小时后离心(3 000 r/min,离心20 min),严格按照ELISA试剂盒检测步骤进行操作。
1.5.6 RT-PCR检测大鼠结肠黏膜TLR2基因的表达:取100 g肠黏膜组织,依次进行RNA的提取、反转录、PCR扩增(94 ℃变性、58 ℃退火、72 ℃延伸)、琼脂糖凝胶电泳完成TLR2基因的表达检测。
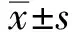
2 结果
2.1 一般情况检查正常组大鼠整体状态较好,活动度较高,未出现腹泻等表现;IBS组大鼠造模后出现饮食、饮水量以及活动量均减少,毛色稀疏变黄,精神萎靡,同时出现不同程度的腹泻,大便为黄色稀便,粪便含水量明显增加(P<0.01),DAI明显提高(P<0.01);治疗后FMT组大鼠整体状态有所好转,活动量明显增加,腹泻明显好转(P<0.01),DAI显著下降。期间未出现死亡现象(见表1)。
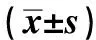
表1 各组大鼠粪便含水量及DAI结果Tab 1 Results of fecal water content and DAI of rats in each group
2.2 粪便标本菌群分析粪便标本菌群分析结果显示,与正常组相比,IBS组大鼠粪便菌群条带数显著降低(P<0.01),FMT治疗后显著增加了大鼠粪便菌群条带数(P<0.01)(见表2)。
2.3 AWR评分与反射次数结果本研究选取AWR为4分时大鼠结直肠注水量的容量阈值作为内脏敏感性评分标准,结果显示,IBS组大鼠容量阈值与反射次数均显著低于正常组(P<0.01),FMT治疗后大鼠的容量阈值显著增加(P<0.01),但治疗后的反射次数与IBS组相比,差异无统计学意义(P>0.05)(见表2)。
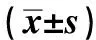
表2 各组大鼠菌群条带数、AWR评分及反射次数结果Tab 2 Results of bacterial flora, AWR score and reflex times of rats in each group
2.4 大鼠结肠组织病理评估结果各组大鼠结肠病理评估结果显示,正常组大鼠结肠上皮细胞排列规整,无明显的淋巴细胞浸润;IBS组大鼠结肠上皮出现少许损伤,出现了大量的淋巴细胞浸润,间质出现轻度水肿;FMT组淋巴细胞浸润出现一定程度的改善(见图1)。

图1 大鼠结肠组织病理图(HE染色,放大40倍) A:正常组;B:IBS组;C:FMT组Fig 1 Histopathological diagram of rat colon tissues A: normal group; B: IBS group; C: FMT group
2.5 大鼠结肠及外周血中组胺与5-HT表达水平ELISA结果显示,IBS组大鼠结肠及外周血组胺与5-HT水平均显著提高,FMT治疗后二者水平均显著下降(见表3)。

表3 各组大鼠结肠及外周血中组胺与5-HT表达水平Tab 3 Expression levels of histamine and 5-HT in the colon and peripheral blood of rats in each group pg/ml)
2.6 结肠黏膜组织TLR2基因的表达PCR结果显示,IBS组大鼠TLR2基因的表达量(1.13±0.19)显著高于正常组(0.42±0.12)(P<0.01);治疗后,FMT可显著使大鼠TLR2基因的表达量降至正常水平(0.76±0.17)(见图2)。

图2 结肠黏膜组织TLR2基因的表达水平
3 讨论
虽然现今医学认为IBS并不属于炎症性疾病,但许多研究均发现在IBS患者结肠黏膜中确实存在炎症性改变,因此,在IBS患者体内存在一定的免疫功能紊乱现象[10-11]。另有研究发现,IBS患者肠黏膜肥大细胞由于与内脏慢性疼痛传导的神经毗邻,因此肠黏膜低度炎症时可刺激神经元释放组胺和5-HT等过敏性物质,导致机体神经-内分泌-免疫轴紊乱,内脏敏感性异常[12]。AWR评分以及内脏反射次数是反映内脏敏感性的重要指标,有关研究发现,向大鼠体内注射刺激物时,可发现大鼠致敏的结肠节段扩张时机体对疼痛的刺激阈值显著下降,腹壁收缩活动明显增加,内脏对各类刺激的敏感性出现异常[13]。
TLR2是表达在肥大细胞表面的一种常见的模式识别受体,在肥大细胞参与的过敏反应中具有重要作用。人体在接受外界抗原刺激时,常可导致肥大细胞致敏后释放大量的组胺、5-HT等物质,同时促进其分泌大量的炎性细胞因子如白介素(interleukin,IL)-1β、肿瘤坏死因子-α等[14]。5-HT作为一种参与内脏感觉和胃肠动力的重要肽类物质,广泛存在于胃肠平滑肌系统,可通过调节肠胃蠕动参与机体内分泌,影响胃肠及内脏敏感性[15]。TLR2、组胺、5-HT等表达量的增加可提示患者机体处于高致敏状态,进而导致机体内脏对各类刺激极度敏感[16]。有关研究表明,益生菌可通过拮抗肥大细胞表面的TLR2表达,抑制免疫球蛋白E(immunoglobulin E,IgE)介导的相关信号传导,阻断肥大细胞活化,进而抑制过敏反应及炎症的发生[17]。已有的研究表明,FMT对肠道疾病的治疗作用可能是通过改善肠道菌群种类及数量,改善细菌对肠道系统的调节作用[18],但具体的治疗机制仍不清楚。
基于以上报道,本研究选取雌性的SD大鼠为研究对象,主要是与IBS患病人群以女性为主有关[19]。通过化学刺激构建IBS动物模型,结果显示,IBS组大鼠造模后出现不同程度的腹泻,DAI明显提高,粪便菌群条带数、结肠容量阈值与反射次数显著降低,结肠上皮出现少许损伤,出现了大量的淋巴细胞浸润,间质出现轻度水肿,结肠及外周血组胺与5-HT、结肠组织TLR2表达水平均显著提高,提示IBS组大鼠模型构建成功。FMT治疗后,上述指标均得到了显著改善,因此推测FMT治疗IBS的机制可能是通过拮抗肥大细胞表面TLR2表达,抑制组胺与5-HT的释放,进而改善机体内脏敏感性及增强免疫功能。
综上所述,本研究中FMT改善了IBS大鼠的疾病症状可能是通过拮抗TLR2的表达进而改善大鼠的内脏敏感性和调节机体内免疫机能。
