结核分枝杆菌来源翻译延伸因子EF-G的蛋白纯化、表征分析及蛋白晶体学研究*
2021-09-28张彦生姚中达何润嘉葛春坡
杨 妍 张彦生 姚中达 何润嘉 葛春坡 杨 赟
(新乡医学院基础医学院生物化学与分子生物学系 河南新乡 453003)
蛋白质合成途径中存在着许多潜在的抗生素靶点,其中包括翻译延伸因子(elongation factor,EF-G)[1-2]。作为GTPases 翻译因子家族中的一员,EF-G 具有常见的GTP 酶激活机制及核糖体结合模式[3-4]。 结核病(tuberculosis,TB)是一种由结核分支杆菌(Mycobacterium tuberculosis)引起的世界性传染性疾病[5]。结核分支杆菌主要攻击人体肺部,同时也会损害身体的其他部位。此外,携带人类免疫缺陷病毒(human immunodeficiency virus,HIV)的人群患结核病的可能性要高出15~22 倍。
夫西地酸(fusidic acid,FA)是一种应用于临床的抗生素。GTP 水解和易位后,夫西地酸将性糖反应,产生砖红色沉淀。本尼迪特试剂在储藏方面优于斐林试剂,在本实验中也可体现。观察比较未加葡萄糖的斐林试剂组1 号管和本尼迪特试剂组1 号管颜色变化。斐林试剂组1 号管实验开始时含Cu(OH)2蓝色絮状沉淀,之后在高温下逐渐分解产生黑色的CuO 沉淀。而本尼迪特试剂组1 号管在整个实验过程中均呈现蓝色澄清溶液,未发生明显变化。从侧面证明,斐林试剂不耐储藏,EF-G 固定在核糖体复合物上[6]。已有研究表明,夫西地酸对结核病具有抑制作用[5]。因此,结核分支杆菌对夫西地酸的敏感性一直是研究热点。
来源于结核分支杆菌的EF-G 基因与大肠杆菌(Escherichia coli)、嗜热杆菌(Thermus thermcphilus)和金黄色葡萄球菌(Staphylcoccus aureus)的同源物的序列一致性较高,分别为59.2%、61.2%和61.3%。目前已对大肠杆菌(PDB:1JQM)、嗜热菌(PDB:1PN6)和金黄色葡萄球菌(PDB:3ZZ0)来源的EF-G 进行了相应的结构分析。然而,有关结核分枝杆菌来源于EF-G 的结构研究报道却很少。对结核分枝杆菌来源的EF-G 的结构分析将有助于在FA 的基础上研发治疗结核病的新型药物。
在本研究中,报道了EF-G 的蛋白纯化、结晶和表征分析,为利用基于结构的药物设计开发新型抗结核药物提供帮助,并阐明分离出的耐FA结核分枝杆菌中关键氨基酸的精确定位。
1 材料与方法
1.1 质粒构建、蛋白表达及纯化 利用Genewiz密码子优化技术合成编码结核分枝杆菌EF-G 的核苷酸序列(UniProt Access Number P9WNM7),并将其插入到pSMT28 载体(改良的6×His-SUMO pET28b+载体)中构建成质粒,将该质粒转化到大肠杆菌BL21(DE3)pLysS 中。使用含50 μg/mL 氯霉素、100 μg/mL 卡那霉素的LB 培养基,37°C、200 r/min 培养细胞。在37℃培养条件下,待LB 培养基中细胞培养物的OD600达到0.6~0.8 时,加入IPTG 使其终浓度为0.5 mmol/L,在20 ℃条件下作用20 h 以诱导蛋白表达。
以8 000 r/min、离心15 min 后收集细胞。随后加入裂解液30 mL 重悬细胞,该裂解液含有:50 mmol/L Tris(pH=8.0)、500 mmol/L NaCl、10 mmol/L咪唑、2 mmol/L BME。使用高压匀浆机(1 000 bar)破碎细胞壁后,在4℃、18 000 r/min 条件下离心1 h 以清除细胞碎片。将上清液装入HisTrap HP柱上,分别添加50 mmol/L 咪唑和250 mmol/L 咪唑的裂解缓冲液中洗脱蛋白。经SDS-PAGE 电泳分析后,使用Ulp1 酶对洗脱蛋白进行酶切,去除6×His-SUMO 标签。
使用Superdex 200 16/600 色谱柱浓缩样品后,将样品再次装入HisTrap HP 柱,用分别添加50 mmol/L 咪唑和250 mmol/L 咪唑的裂解缓冲液洗脱蛋白后,采用分子筛纯化后用超滤管对蛋白进行浓缩。使用Bradford 法测定蛋白浓度,并利用12% SDS-PAGE 分析样品纯度。
1.2 蛋白结晶 将蛋白质浓缩至约20 mg/mL。在晶体筛选实验前,将样品在4℃、12 000 r/min,条件下离心10 min 澄清样品。采用坐滴式蒸汽扩散法在96 孔板上进行初筛,通过蛋白质浓度、pH 值或沉淀剂浓度的变化对初始条件进行修正。
1.3 X 射线衍射数据采集与处理 通过上海同步辐射装置(Shanghai Synchrotron Radiation Facility,SSRF)的BL17U 光束线采集得到X 射线衍射数据,波长为0.09793 nm。晶体到探测器的距离为350 mm,曝光时间为1 s/帧,振荡范围为1.0°。晶体采集分辨率为0.32 nm。使用HKL-2000 对原始衍射数据进行索引、整合、缩放和合并。
1.4 小角X 射线散射数据采集与处理 在4℃、12 000 r/min 条件下离心10 min 以澄清样品。在上海同步辐射装置(SSRF)的BL19U2 光束线上采集得到小角X 射线散射(small-angle X-ray scattering,SAXS)数据。在20 mmol/L Tris-HCl(pH=7.4)、100 mmol/L NaCl 缓冲液中制备样品,浓度为0.75~3 mg/mL。从3 组20 张图像中整合并平均得到结果数据,并使用缓冲帧以消除背景。采用间接傅里叶变换方法估算颗粒的回转半径(Rg),由最大维数Dmax计算颗粒P(r)的对分布。
2 实验结果与分析
2.1 重组EF-G 的纯化 使用SUMO 标签蛋白增加蛋白质的可溶性表达[7-8]。将EF-G 基因插入到pSMT28 载体中。随后,将该质粒转化至大肠杆菌BL21(DE3)细胞内,以获得高表达的6×His-SUMO标签融合蛋白,分子量约为91 kDa(图1A)。
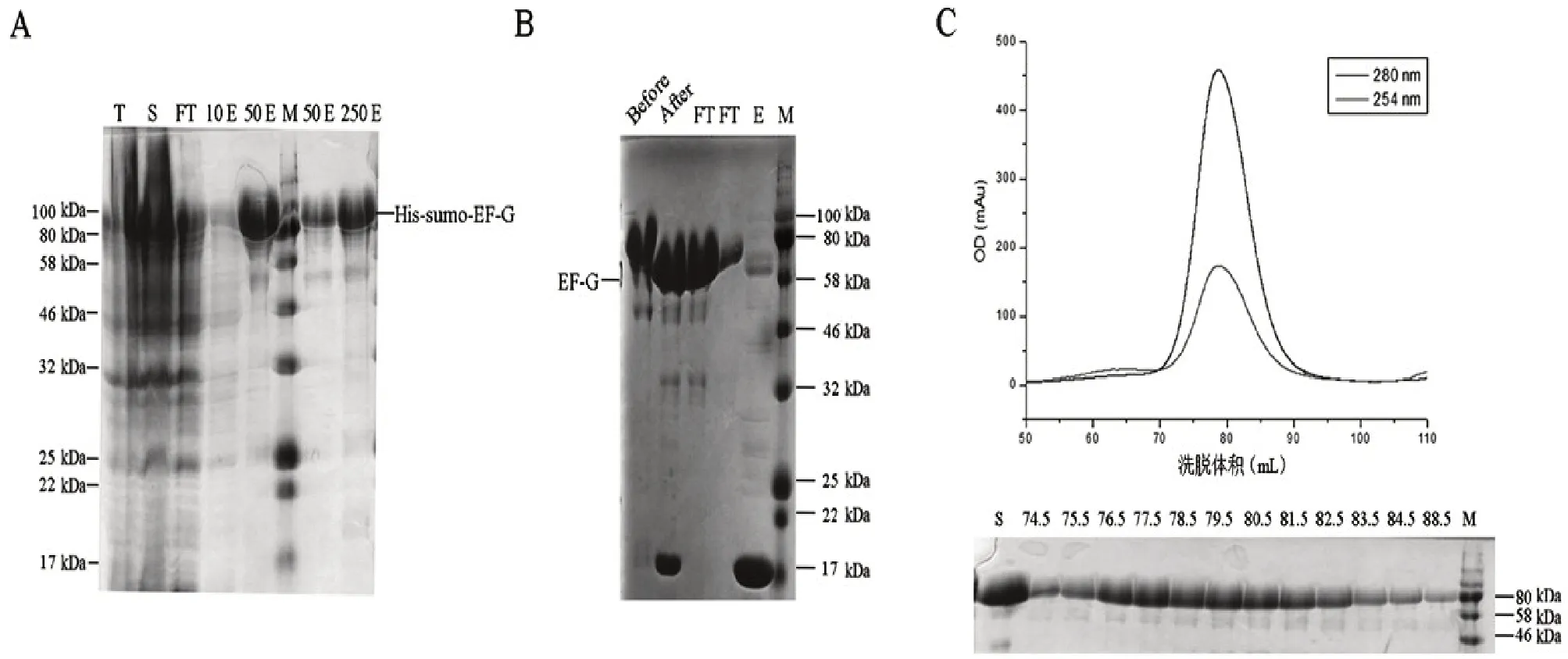
图1 蛋白表达及纯化
经镍亲和层析获得大量的可溶性重组蛋白。使用SUMO 特异性蛋白酶Ulp1,去除6×His-SUMO 标签[9]。经第2次Ni-NTA 层析得到的无标记蛋白的分子量约为77 kDa,与理论分子一致(图1B)。然后,用凝胶渗透色谱法对纯度较高的EF-G 进行纯化,在79 mL 处出现一个峰洗脱(图1C)。所有纯化步骤用12 % SDS-PAGE 检测。
2.2 结晶和X 射线的初步分析 在不同的结晶条件下(表1),EF-G 在3~4 周内出现小晶体(图2)。

表1 结晶条件
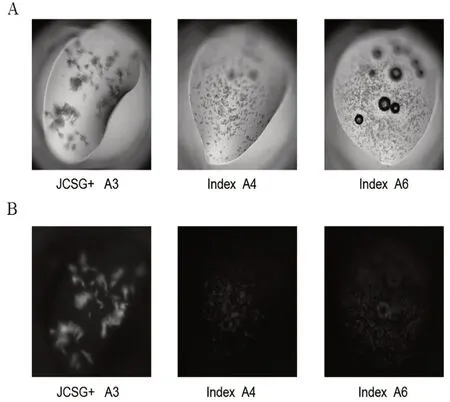
图2 蛋白结晶
通过改变沉淀剂浓度、蛋白质浓度、缓冲液pH 值和添加剂,对结晶条件进行了优化。在JCSG+A3[0.2 mol/L 柠檬酸三铵,22%(W/W)PEG3350]的优化条件下,可得到较大的晶体。X 射线衍射数据是从单晶中进行收集,最高分辨率为0.383 nm(图3B)。EF-G的数据收集和统计处理如表2所示。空间群属于P61,晶胞参数a=26.079 nm,b=26.079 nm,c=6.28 nm;α=β=90.00°,γ=120.00°。
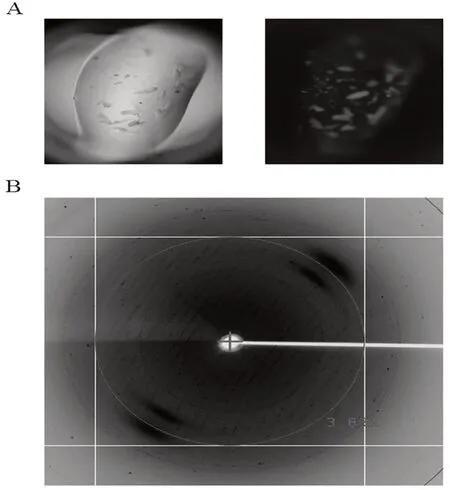
图3 X-射线衍射数据采集与处理
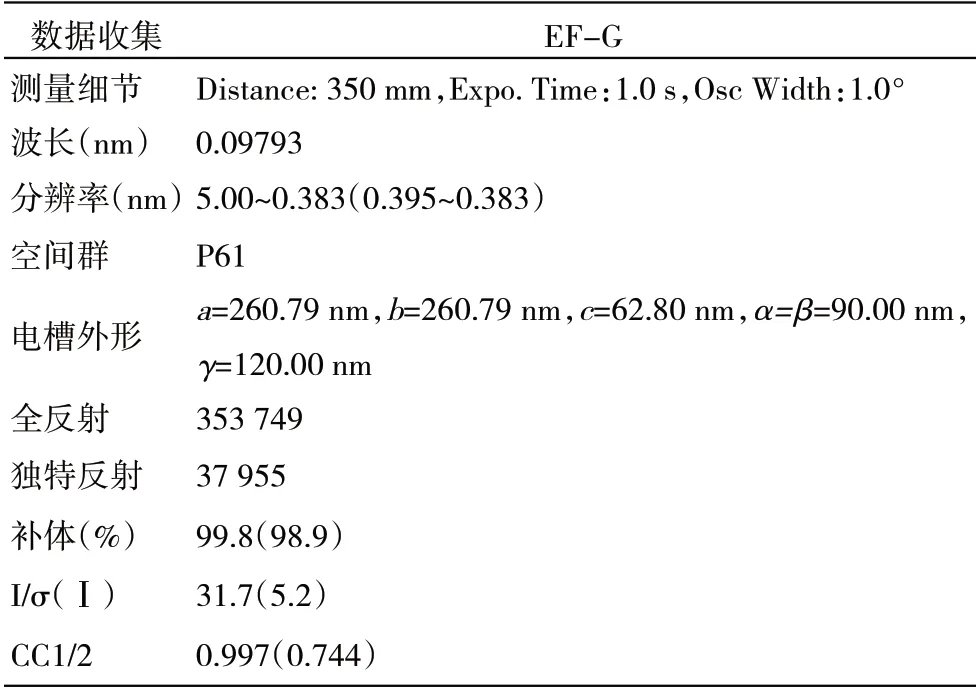
表2 初步x 射线晶体学研究
2.3 SAXS 分析 使用SAXS 方法检索EF-G 在溶液中的分子形状。根据吉尼耶图(Guinier plot)计算得到回转半径(Rg)为3.649 nm。而距离分布函数P(r),则由最大距离计算得出为13.03 nm。根据P(r)确定的回转半径(Rg)为3.667 nm,与Guinier分析计算的Rg相近似(图4A~4C)。SAXS 实验结果表明,EF-G 在溶液中形成了相对刚性的结构。
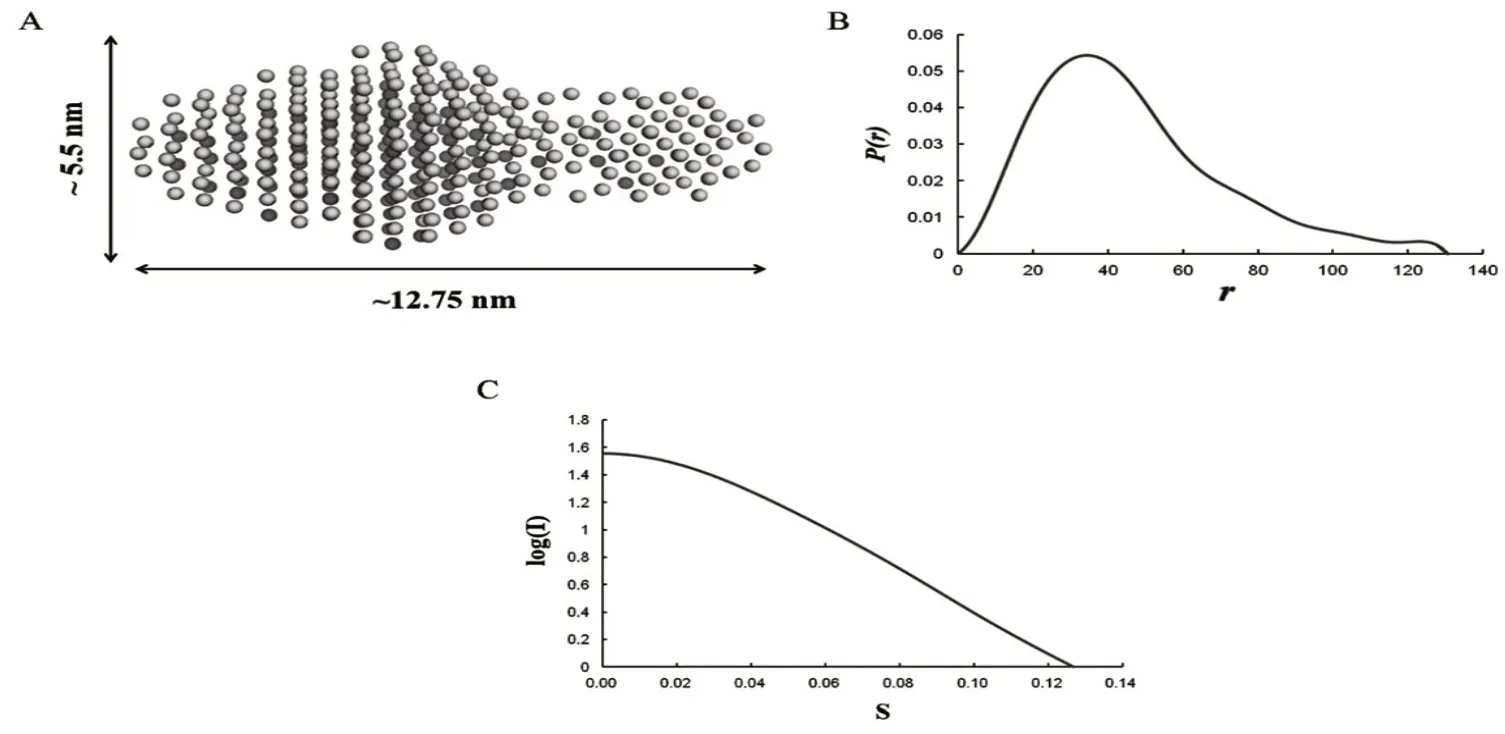
图4 SAXS 分析
3 讨论
来源于大肠杆菌[10]、嗜热链球菌[11]及金黄色葡萄球菌[12]EF-G 的结构揭示了其在蛋白质合成中的作用机制。虽然结核分枝杆菌来源的EF-G与其同源物的序列一致性很高,但有关结核分枝杆菌来源EF-G 的结构尚未见报道。本研究收集了EF-G 的X 射线散射数据。目前,正在尝试以金黄色葡萄球菌来源的EF-G(PDB:2xex)的结构作为搜索模型[12],采用分子置换(molecular replacement,MR)方法进行测定。
此外,关于目标蛋白质的三维结构尚未明确,其相关检测目前也正在进行。本实验室将在这方面进行进一步的研究。SAXS 实验是一种提取溶液中蛋白质分子形状的方法[13-14]。经SAXS 分析表明,EF-G 在溶液中为致密结构蛋白。除此之外,EF-G 还可作为一个药物靶点[1]。因此,对EFG 结构的分析将为抗结核病新药的开发奠定重要的理论基础。
