氢气中杂质对车用燃料电池性能影响的研究进展
2021-09-28何广利窦美玲
何广利,窦美玲
(1 北京低碳清洁能源研究院新能源技术研究中心,北京 102211;2 北京化工大学材料科学与工程学院,北京 100029)
质子交换膜燃料电池(proton exchange membrane fuel cells,PEMFCs)耐久性是制约氢能在交通领域大规模商业化应用的关键因素之一[1],燃料电池乘用车行驶5000h 后,输出性能衰减应小于10%[2]。目前,车用燃料电池氢气主要通过工业副产氢制取,氢源包括煤气化制氢、天然气重整制氢、生物质气化制氢、甲醇重整制氢以及焦炉煤气、合成氨尾气等[3]。不同氢源的非氢组分有一定差异,例如煤气化氢源中CO 体积分数占比35%~45%、CO2占比15%~25%、CH4占 比0.1%~0.3%、总S 占 比0.2%~1%、N2占比0.5%~1%[4];对于天然气重整氢源,其中CO 占比10%~15%、CO2占比10%~15%、CH4占比1%~3%、N2占比0.1%~0.5%[5]。尽管采用不同氢源时均经历严格的纯化除杂,仍然会因氢源的复杂性难以去除某些杂质,或在氢气纯化后的充装、运输、压缩和加注过程不可避免引入一些微量或痕量杂质,如H2S、CO和NH3等。相比之下,水电解制氢拥有较高的纯度,但其电耗高(约5kWh/m3),目前制氢成本仍高于工业副产氢纯化。
氢气中存在的杂质若含量超过一定限值,会导致车用燃料电池性能衰减、导致寿命下降[6]。PEMFCs运行时的性能损失包括电化学极化、欧姆极化和传质极化,输出电压可表示为式(1)。
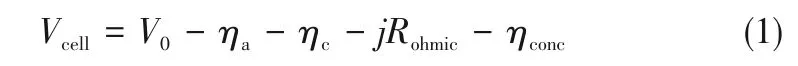
式中,V0为条件平衡电压;ηa和ηc分别为阳极和阴极过电位;j 为电流密度;Rohmic为欧姆电阻;ηconc为浓差极化过电位。当氢气中存在杂质时,会引起阳极过电位升高、欧姆电阻增加或传质过电位升高,导致PEMFCs性能下降。氢气中的多数杂质(如H2S、CO、CO2、甲醛和甲苯杂质)主要引起阳极过电位增加,而NH3主要引起欧姆电阻增加[7-9]。
PEMFCs工作时的单池输出电压在0.65~0.70V范围,为了达到运行5000h性能衰减小于10%的目标,H2杂质导致的过电位必须小于0.065V。这要求氢气中各类杂质应依据毒化机理和动力学分别确定容限值,从而建立燃料电池车用氢气品质的标准理论体系。
本文综述了三类关键杂质,即H2S、CO和NH3对PEMFCs 性能影响的研究进展,包括毒化机制、动力学、操作条件影响以及缓解策略,讨论了规定杂质容限值的理论基础,认为应根据我国PEMFCs技术发展水平确定氢气品质标准。
1 燃料电池阳极氢氧化反应
燃料电池阳极发生氢气氧化反应(hydrogen oxidation reaction,HOR),一般采用炭载铂(Pt/C)催化剂。发生在Pt上的HOR,存在Tafel-Volmer 和Heyrovskye-Volmer两个反应路径[10],如式(2)~式(4)。
Tafel反应

Volmer反应
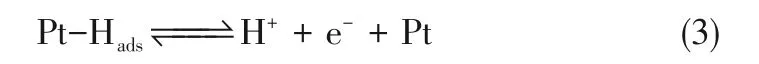
Heyrovskye反应

采取Tafel-Volmer 反应路径时,H2分子首先解离吸附在Pt表面形成Pt—H键,该反应需要两个Pt活性位点,速率较慢,然后发生氢原子氧化反应,速率相对较快,可表示为式(2)和式(3)。采取Heyrovskye-Volmer 反应路径时,H2在Pt 表面的化学吸附和单电子氧化反应同时发生,然后发生氢原子氧化反应,可表示为式(3)和式(4)。研究表明,按照Tafel-Volmer 反应历程获得的动力学方程与试验结果吻合较好[10]。
纯H2在Pt/C表面发生HOR时,反应式(2)是速率控制步骤。依据Tafel-Volmer 反应路径,反应式(2)的速率q1和反应式(3)的速率q2可分别表示为式(5)和式(6)。

式中,θPt为裸露的Pt位点占比;θH为氢在Pt表面覆盖度;CH2为H2浓度;r1f和r1b分别为正向反应和逆向反应的反应速率常数,即分别为吸附和脱附速率常数;r2为电化学氧化反应速率常数;α 为电荷转移系数;η 为过电位;F 为法拉第常数,96485C/mol;T 为绝对温度;R 为气体常数,8.314J/(mol·K)。
PEMFCs 稳定输出电流时,以上两个基元反应的数值应相等,HOR 反应过电位与基元反应速率常数以及催化剂表面可用Pt 活性位占比θPt有关。当H2中存在杂质X时,将在Pt表面发生竞争吸附,导致θPt下降,引起HOR 反应过电位升高,燃料电池输出电压下降,如图1所示。竞争吸附过程可简化表示为式(7)和式(8)。

图1 Pt催化剂表面发生的杂质X与H2的竞争吸附


反应式(7)的速率q3和反应式(8)的速率q4分别表示为式(9)和式(10)。

式中,θx为杂质X在Pt表面的覆盖度;Cx为杂质浓度;r3f和r3b分别为正向反应和逆向反应的反应速率常数,即分别为X在Pt位上吸附和脱附速率常数;r4f和r4b分别为正向反应和逆向反应的反应速率常数,即分别为X竞争反应的吸附和脱附速率常数。
可以看出,H2中存在杂质X 时,HOR 反应过电位的增加受以下因素影响:①X在Pt表面的吸附速率常数r3,与X在Pt表面的吸附机制有关,取决于Pt-X 吸附活化能和反应温度;②X 在H2中的浓度,即H2中杂质X 的含量;③X 与H2在Pt 表面的竞争吸附速率常数r4,取决于Pt-H 和Pt-X 的相对吸附强度以及反应温度。因此,为控制HOR 反应过电位、保障PEMFCs输出性能,应依据杂质X在Pt 表面的吸附机制(活化能、速率常数)以及PEMFCs 操作条件(温度、电流密度),严格限制H2中杂质X的含量。
2 氢气中CO对PEMFCs性能影响
2.1 毒化机制及动力学
与H2相比,CO与Pt的结合能更高,当H2中存在CO 时,CO 在Pt 表面会优先吸附,见式(11)和式(12)。

反应(11)比反应(2)更易发生,CO 占据Pt 活性位,导致θPt下降,阻碍H2的吸附氧化过程,CO还会通过式(12)取代Pt表面吸附的H原子(Pt-H上的H),导致θH降低,使得HOR反应过电位升高[11-17]。
纯H2在Pt表面很快达到吸附平衡,用H2-D2交换反应研究H2活化过程,获得的表观活化能为4.5~5.3kcal/mol(1cal=4.18J);当H2中存在10~70µL/L 的CO 时,反应偏离平衡,表观活化能增加至19.3~19.7kcal/mol[18-20]。假设燃料电池操作温度为60oC,根据阿伦尼乌斯方程计算可知,此时H2活化速率下降了9个数量级。
2.2 操作条件影响
CO 在Pt 表面的吸附为放热反应,随着燃料电池操作温度升高,CO 在Pt 表面脱附加快、覆盖度下降,对HOR的毒化作用减轻[15,21]。研究表明,CO含量为2µL/L、操作电流密度为1A/cm2的PEMFC,当温度为60℃时HOR 过电位246mV,当温度为80℃时HOR过电位降低为45mV[21],如图2所示。

图2 H2中含CO时PEMFC在不同操作温度下的阳极过电位[21]
在不同的PEMFC 操作电流密度下,同样含量的CO 杂质导致的过电位增加值也是不同的[21]。当H2中含有CO时,在相同的燃料气反应计量比条件下,更高的电流密度使得H2消耗速率加快,而CO基本不发生转化,这导致单位时间单位面积的催化剂表面CO 含量更高,对HOR 的毒化作用加剧[21]。研究表明,PEMFC操作温度60℃、阳极通入CO含量为2µL/L的H2,当电流密度为0.2A/cm2时,过电位仅为19mV,PEMFC可以正常运行;当电流密度升高至0.6A/cm2和1.0A/cm2时,过电位分别升高至159mV 和246mV,约为0.2A/cm2时HOR 毒化过电位的8倍和13倍[21],如图3所示。

图3 因CO引起的过电势随电流密度的变化[21]
因此,PEMFC 阳极HOR 对H2中CO 含量的耐受性,受到操作温度和电流密度的影响,应依据典型工况条件规范车用燃料电池氢气中CO 含量限值。
2.3 缓解策略
促进CO在Pt表面氧化转化,再生出Pt活性位,是缓解PEMFC阳极CO毒化的主要策略(图4),包括阳极氧化和开发抗CO催化剂两种方法。

图4 Pt合金催化剂抗CO中毒机制
阳极氧化法通过在阳极侧通入一定量的O2,将CO氧化转化为对HOR低毒性的CO2[22]。少量O2的引入,在Pt 表面形成吸附态氧Pt-Oads,与Pt-COads反应生成CO2,释放出Pt 活性位,可用Langmuir-Hinshelwood机理描述[23],可表示为式(13)~式(15)。

开发抗CO 催化剂的目的也是促进Pt-COads物种的氧化,其不同在于,通过诱导H2O 在Pt-COads附近产生吸附态OH,与CO 发生氧化还原反应。将廉价的过渡金属TM 与Pt 合金化(如Ru[24]、Sn[25]、Mo[26]、W[27]等),TM 将能够作为OH 的优势吸附位点,产生TM-OHads,具体抗CO 机理可表示为式(16)和式(17)。


3 氢气中H2S对PEMFCs性能影响
3.1 毒化机制及动力学
H2S对PEMFC阳极HOR的毒化机制尚有争议,一般认为,当PEMFC 阳极H2中含有H2S 时,将在Pt 表面发生解离吸附,生成Pt-Sads物种,如图5 所示;由于S在Pt表面更强的吸附作用,Pt-Hads也会被竞争取代生成Pt-Sads,导致HOR 可利用的Pt 活性位点占比大幅下降[28],可表示为式(18)和式(19)。


图5 H2S在Pt表面的主要吸附形式
在PEMFC 阳极环境下,尚未有直接证据证实以上机理。Mathieu和Primet等[28]采用红外光谱方法研究了H2S在Pt/Al2O3表面的吸附过程,发现H2S在Pt 表面形成Pt-Sads物种,并释放H2。也有研究表明,H2S 在Pt 表面吸附形成Pt-Sads物种时也伴随电氧化,并且提出可能存在Pt-S2ads吸附形式[4],可表示为式(20)和式(21)。

此外,Pt-Sads与阳极催化剂层中H2O 反应,生成硫氧化物,对Pt 表面活性位产生一定的覆盖作用[29-31],可表示为式(22)和式(23)。
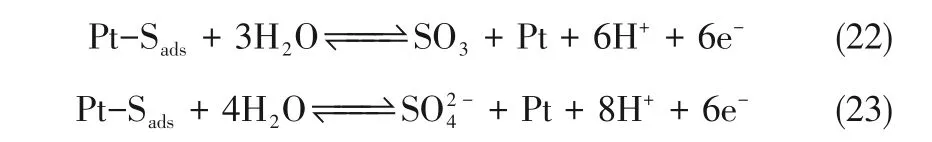
可见,H2S在PEMFC的阳极反应路径多变,且最终形成难以完全脱除的酸根离子,对HOR 毒化机制复杂。
当H2中存在H2S时,PEMFC中毒速度与温度直接相关。Mohtadi等[32]采用循环伏安氧化法研究硫物种在Pt表面的吸附强度,发现低温时吸附更强烈。然而,温度越高时H2S在Pt表面的吸附反应速率越快,例如H2中含有5µL/L H2S 时,在50℃、70℃、90℃下吸附800min,最终获得硫物种覆盖率θs分别为90%、 95%、 100%, 速 率 常 数 分 别 约 为0.0025min-1、0.0038min-1和0.008min-1,如图6所示,推导出Pt表面吸附H2S的活化能约为28.2kJ/mol[32]。

图6 硫物种覆盖度随时间变化[32]
3.2 缓解策略
H2S 对PEMFC 的毒化具有积累性,较难恢复,已研究的缓解策略包括在阳极侧通入纯氢或臭氧、阳极电氧化以及开发耐H2S中毒的阳极催化剂。
当H2中存在痕量H2S导致PEMFC发生中毒后,通入纯H2可部分恢复燃料电池性能,恢复程度取决于中毒时间和杂质浓度[33]。Kakati 和Kucernak[34]在PEMFC 阳极注入臭氧,发现能够显著恢复电池性能;当H2S 含量为100µL/L 时,注入2%的臭氧持续600s,性能可恢复至初始值的95%以上。然而,Lacaze等[35]发现注入1000µL/L臭氧会导致膜电极组件降解速率加快,引发PEMFC不可逆衰减。
采用循环伏安扫描诱导电化学氧化,能够恢复H2S 中毒后的PEMFC 性能。研究表明,将PEMFC阳极在0~1.4V 进行电位扫描,性能可以完全恢复[33]。
开发耐H2S中毒的阳极催化剂也是缓解PEMFC中毒的有效方法,但目前尚未发现抗H2S效果显著的HOR 催化剂。研究表明,Pd85Cu15/C 合金催化剂可减轻H2S 中毒[36],但具有抗CO 中毒的PtRu/C 合金催化剂没有耐H2S能力[29]。
4 氢气中NH3对PEMFCs性能影响
4.1 毒化机制


目前的研究结果表明,NH3对燃料电池的毒化行为主要是对质子电导有影响,对催化剂的影响尚不明晰。
4.2 毒化影响因素
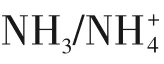
4.3 缓解策略
NH3中毒过程缓慢,需要很长时间才能达到稳定状态。含有NH3的H2通入PEMFC 阳极,长期运行后(如15h),切换至纯H2,即使数天也不能恢复燃料电池性能,但对于短期运行(如1~3h)的PEMFC,可恢复性能[38]。
5 车用燃料电池氢气杂质容限值
国际标准化组织(ISO)、美国汽车工程协会(SAE)以及中国氢能标准化技术委员会(SAC/TC309)依据技术发展趋势和产业化进程特点,针对车用燃料电池用氢质量制定了行业标准(分别为ISO 14687:2012、SAE J 2719:2015 和GB/T 37244—2018),如表1 所示。随着燃料电池技术的发展,车用燃料电池用氢质量标准也随之更新。2015年,由日本武藏理工学院的Yasuo Takagi 教授召集成立了WG 27“氢燃料质量”工作组,对ISO 14687 标准进行升级修订,并于2019年发布。
如表1 所示,新版的ISO 14687:2019 标准对个别杂质组分含量作了新的规定,对氢气杂质组分的容限值非常严格,尤其对于燃料电池性能影响较大的硫化物、CO 和NH3,标准制定的容限值分别为4nL/L、0.2µL/L 和0.1µL/L,其容限值相对于2012年发布的标准保持不变,区别是总硫的计量方式由以H2S计改成以S1计。我国氢能标准委员会也发布了GB/T 37244—2018 标准,对氢气杂质组分容限值要求与ISO 14687:2012和GB/T 37244—2018完全一致。
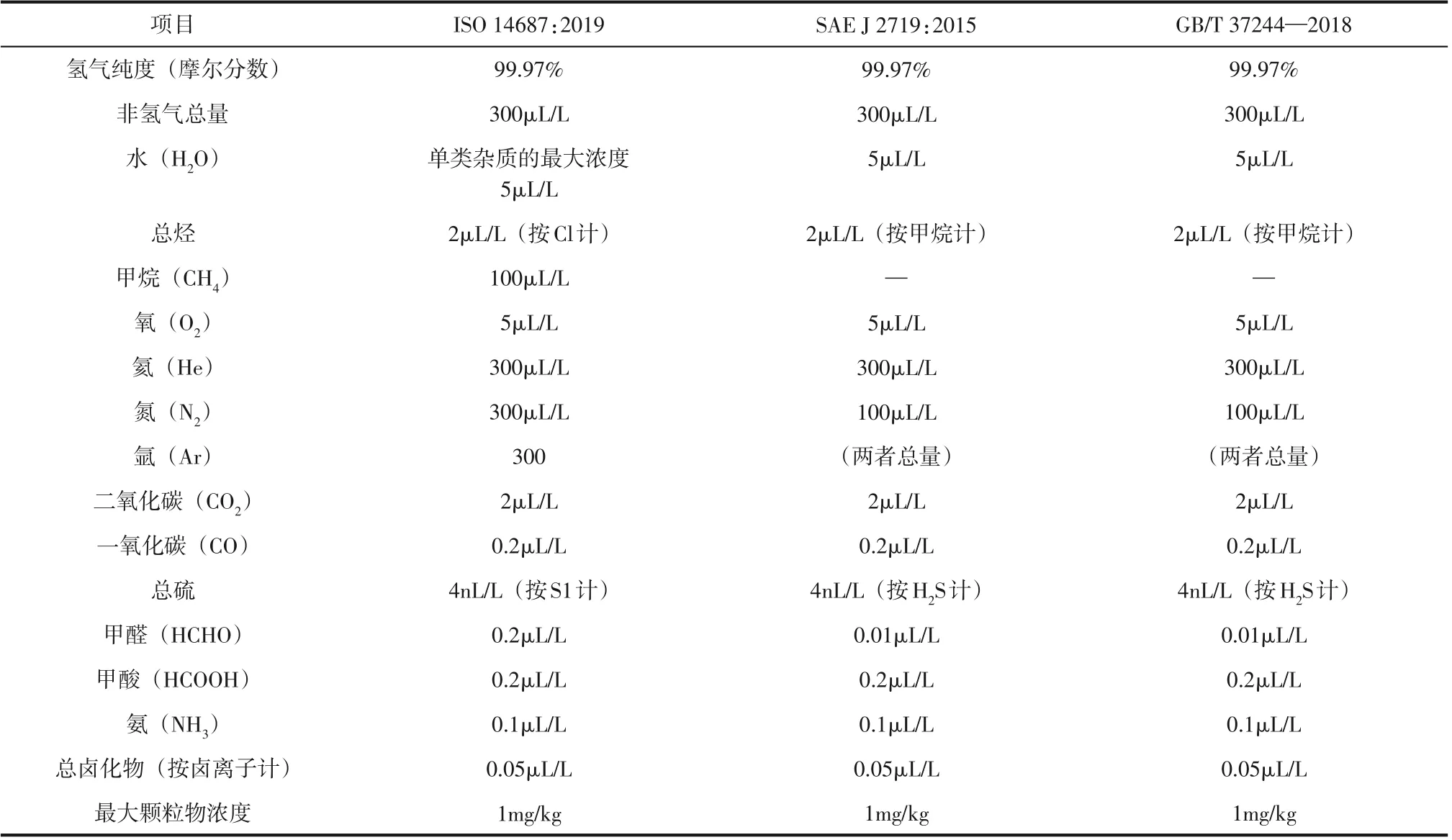
表1 车用燃料电池用氢国内外标准
目前,车用燃料电池氢气杂质容限值的精准确定,受限于实验数据的缺乏。一方面,报道的大多数实验结果来自高浓度杂质对PEMFC 毒化行为的研究,与实际应用条件下的杂质含量差别较大,如表2和表3所示。例如,在研究H2S对PEMFC 阳极的毒化过程时,H2中H2S 含量均高于0.5µL/L,这是ISO 14687:2019 标准要求(4nL/L)车用燃料电池氢气中H2S 含量的125 倍[43]。另一方面,PEMFC运行工况不同、技术水平不同,对杂质的耐受性也不同,目前尚未建立差异化的氢气杂质标准体系。以CO 为例,ISO 14687:2019 标准要求车用燃料电池氢气中CO 含量不超过0.2µL/L,但Mastuda 等[44]研究表明,该浓度下PEMFC因CO毒化作用导致的过电位仍然达到29mV(1A/cm2稳态运行50h,电池温度为60℃,催化剂担量0.11mg/cm2)。

表2 氢气中CO杂质对燃料电池性能影响研究汇总

表3 氢气中H2S杂质对燃料电池性能影响研究汇总
采用模型和实验数据相结合的方法是精准确定杂质容限值的可行手段之一。美国阿贡国家实验室采用实验数据建模,确定了CO、H2S、NH3和CO2杂质浓度的容限值。然而,这些模型基于的实验数据来自不同的实验条件,由于PEMFC 操作温度、电流密度等因素均显著影响毒化过程,因此其模拟结果不具有普适性。Jean等[51]建立了瞬态的PEMFC模型用来预测不同CO 含量下的性能损失,性能损失低于1%时的CO 含量范围为0.2~0.9µL/L,这提示ISO 标准规定的CO 容限值(0.2µL/L)可能有提高空间,从而有利于降低氢气供应成本。
6 结语
氢气中CO、H2S、NH3三种杂质对PEMFC性能影响均非常显著,H2S 和CO 与H2发生竞争吸附,覆盖在Pt 催化剂表面,导致HOR 反应活性位占比大幅下降,引起电化学极化增加;CO毒化过程快,但可以完全恢复,H2S毒化机制复杂,不可完全恢复。NH3与电极和隔膜中的离子聚合物发生质子化反应,导致电导率下降,中毒后无法完全恢复。
氢气中杂质容限值的确定,受PEMFC 运行温度、操作工况、催化剂种类影响,目前大部分研究采用较高浓度杂质且研究时间短,不利于氢气杂质容限值的精准确定,有待更多实验研究。依据毒化机制和动力学,建立杂质浓度-PEMFC性能预测模型,能够辅助燃料电池车用氢气品质标准体系的确立。
