Co-Bi-B三元复合材料的制备及其在NaBH4水解制氢中的应用
2021-09-28陈露瑶董艳梅解品红李芳李其明
陈露瑶,董艳梅,解品红,李芳,李其明
(辽宁石油化工大学石油化工学院,石油化工重点实验室,辽宁 抚顺 113001)
随着人类社会的发展和环境污染的日益加剧,以煤炭、石油、天然气等为代表的传统能源危机日益凸显,寻求新型可循环再利用的绿色、高效能源对人类社会的可持续发展具有重要意义。氢能被普遍认为是极具前景的清洁能源,近些年氢能未能在市场上大规模投入应用,瓶颈在于氢气的储存和运输两个方面。目前氢气的储存主要可以分为两大类,即物理储氢和化学储氢[1-4]。最受人们关注的是利用化学氢化物储氢,其中NaBH4储氢密度高,理论储氢量可高达10.8%[5],其释放氢气的水解反应本身为放热反应,无需外加能量。此外,硼氢化钠由于水解反应生成的氢气纯度高,不生成对环境有害的副产物等优点受到国内外学者的广泛重视与研究[6-7]。NaBH4水解制氢的关键在于开发活性高、稳定性好、寿命长、价格低廉的催化剂。
众所周知,贵金属催化剂是NaBH4水解制氢的高效催化剂,但是由于贵金属催化剂价格昂贵且储量有限,其应用受到限制[8]。近年来非贵金属催化剂CoB、NiB、FeB、CuB等由于其廉价高效的优势被广泛研究[9-12],其中尤其以纳米非晶态合金CoB 催化剂最为引人注目,其催化活性仅次于Ru基催化剂。然而,磁性CoB纳米颗粒在催化NaBH4水解制氢的过程中极易发生团聚现象,从而降低了其催化效率。近年来,研究人员主要通过制备负载型CoB 催化剂[13-16]来提高催化剂比表面积,弱化CoB 粒子之间的磁性吸引,从而提高催化剂活性。另一种避免CoB 纳米粒子团聚的有效途径是掺杂Cr、Mo 或W 等其他金属原子[17],即使是很低的原子浓度也能显著增加CoB 催化剂粉末的比表面积,避免团聚,提高催化剂的催化活性。近几年有不少研究者通过掺杂过渡元素的方法来改良CoB催化剂的性能,如马敬环等[17]通过掺杂Pr制备了Co-Pr-B三元合金催化剂,陈悦蓉等[18]通过掺杂Cr 制备Co-Cr-B 高活性催化剂用于催化硼氢化钠水解反应,Wei等[19]通过掺杂Ni元素改善CoB催化剂的性能。上述研究者在研究过程中发现,掺杂第三种元素能够有效改良CoB 催化剂的性能。本文将系统探讨Bi 掺杂对CoB 晶相结构和催化活性的影响。
本文通过液相共还原法在CoB基质催化剂基础上掺杂了不同质量金属Bi元素,制备了一系列Co-Bi-B 三元合金催化剂,并通过XRD、SEM、XPS等表征分析新催化剂的性能,研究了Co-Bi-B催化NaBH4水解制氢过程中的催化剂制备温度、Bi的掺杂量和反应温度对产氢速率的影响。
1 实验
1.1 实验药品
六水合氯化钴(CoCl2·6H2O,AR,辽宁泉瑞试剂有限公司)、五水合硝酸铋[Bi(NO3)3·5H2O,AR,沈阳市试剂一厂]、硼氢化钠(NaBH4,AR,天津市光复精细化工研究所)、氢氧化钠(NaOH,AR,天津市瑞金特化学品有限公司)。实验室自制去离子水。
1.2 Co-Bi-B的制备
催化剂的制备采用液相共还原法。首先,取3.0g CoCl2·6H2O和一定量的Bi(NO3)3·5H2O分别溶于50mL 去离子水中搅拌均匀,配置为溶液1;然后,按 照NaOH 与CoCl2摩 尔 比 为1∶1 称 取0.504g NaOH,按NaBH4与CoCl2摩尔比为5∶1称取2.391g NaBH4,依次溶于20mL 去离子水中搅拌,混合均匀配置为溶液2;最后将溶液2 用微流量注射泵缓慢滴入溶液1中,制备过程通过冰水混合浴控制合成温度为0℃。反应完成后将所生成的黑色沉淀进行抽滤、洗净和干燥,最终得到Co-Bi-B三元合金粉末。通过改变Bi 和Co 的摩尔比制备出一系列Co-Bi-B催化剂,进行对比实验研究。
1.3 Co-Bi-B三元复合材料的表征
采用日本理学电机公司生产的X 射线衍射仪(XRD,D/max-RB 型)进行催化剂物相分析,其实验条件为:Cu 靶Kα辐射(λ=0.15418nm),管压为40kV,管流为30mA,扫描范围5°~90°,扫描步长为0.03°。通过扫描电子显微镜(SEM-EDS,SU8010 型,日本日立公司)对催化剂微观形貌以及元素组成进行分析。
1.4 Co-Bi-B催化NaBH4水解制氢
Co-Bi-B 催化NaBH4水解的催化活性通过产氢速率vH2[mL/(min·g)]予以体现。NaBH4水解产生的氢气采用排水法测量。将0.01g Co-Bi-B 催化剂加入到100mL 0.01g/mL NaOH 和5×10-4g/mL NaBH4混合溶液中开始计时,每间隔1.0min与电脑相连的精密电子天平记录t时刻排出的水量。测试过程中采用恒温水浴来控制温度,采用磁力搅拌器控制转速。
2 结果与讨论
2.1 催化剂的表征
2.1.1 Co-Bi-B催化剂的XRD表征分析
图1 是不同掺杂比例的Co-Bi-B 和CoB 催化剂的XRD 图。图中材料a 为CoB 催化剂的XRD 图,从图中可以看出其没有显著的特征吸收峰,从而可知CoB为非晶态物质[20]。材料b~e四条XRD谱线的基本形状相似,在26.5°、38°、39.5°和49°出现Bi的特征衍射吸收峰,并且随着Bi掺杂比例的增加,特征峰吸收强度增高。此外复合材料b~e除了拥有Bi 的特征峰外还有2°、25.8°、32.5°、33.5°、41°、46.5°和59°这几个窄峰,与BiOCl上的(101)、(110)、(102)、(112)、(200)和(212)晶面相对应[21]。综上可知,本实验制备的Co-Bi-B三元复合材料包含了少量的BiOCl。

图1 CoB和掺杂不同比例Bi的Co-Bi-B催化剂XRD图
2.1.2 SEM-EDS表征分析
催化剂的形貌和颗粒大小对催化剂的性能有一定的影响。通过SEM对CoB和Co-Bi-B催化剂形貌和分布特点进行表征分析,由图2可看出CoB颗粒较大且团聚现象严重;掺杂Bi得到的Co-Bi-B催化剂颗粒小且明显减轻了颗粒的团聚现象,使大量的活性位点暴露在粒子表面,提高了催化活性。图3(a)~(d)为Co-Bi-B 催化剂的SEM-mapping 表征分析图,直观地显示了Co-Bi-B催化剂的表面结构及其表面生成物的分布规律。从图中可以清楚地看到Co、Bi和B三种元素在催化剂表面分布均匀,证明了Bi 元素成功掺杂到催化剂体系中并且具有良好的分散度。图3(e)为上图样品所对应的SEM-EDS图,由图可知在Co-Bi-B 催化剂粉末中含有Co、Bi、B 三种元素。表1 为催化剂中的原子分数,由表中可以看出原子分数的比例与所加入量基本一致。综上可知,在CoB 催化剂中成功掺杂了Bi元素。

图2 CoB和Co-Bi-B[n(Bi)∶n(Bi+Co)=0.01]催化剂的SEM图
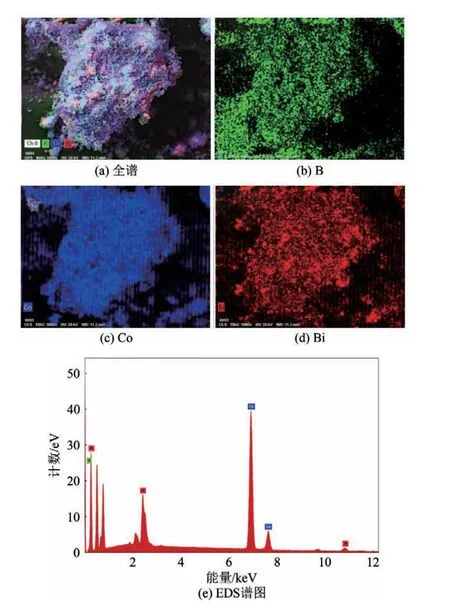
图3 Co-Bi-B催化剂的SEM-mapping和EDS谱图

表1 Co-Bi-B 催化剂中各元素的比例
2.1.3 XPS表征分析
为了深入了解Co-Bi-B三元催化剂表面的元素组成及化学价态,本研究又对其进行了XPS 分析。图4(a)图是Co-Bi-B三元合金催化剂的XPS全谱图,从图中只能观察到Co、B、Bi、C 和O 五种元素。O峰的相对强度较强,表明在XPS样品的制备过程中存在元素表面发生氧化的现象。Co、Bi和B的高分辨率XPS光谱分别如图4(b)~(d)所示。由图4(b)可知Co 2p3/2 和Co 2p1/2 自旋轨道峰分别位于778.0~792.0eV 和794.0~797.0eV 结合能区域。在结合能781.3eV 处所对应的吸收峰为CoO 或Co(OH)2,在786.85eV 处所对应的为CoO 或Co(OH)2的卫星峰。778.3eV的单质态Co的吸收峰基本观测不到,这是由于在样品储存过程或测试过程中催化剂表面氧化所致[22-23]。图4(c)中在158.8eV和164.3eV出现的两个峰分别对应Bi 4f7/2和Bi 4f5/2两个自旋轨道分裂对称强峰,表示Bi以三价氧化物的形式存在。图4(d)为B 1s的XPS图,可以观察到在186.5eV和191.8eV处出现了两个峰,分别对应元素态B和氧化态B3+。
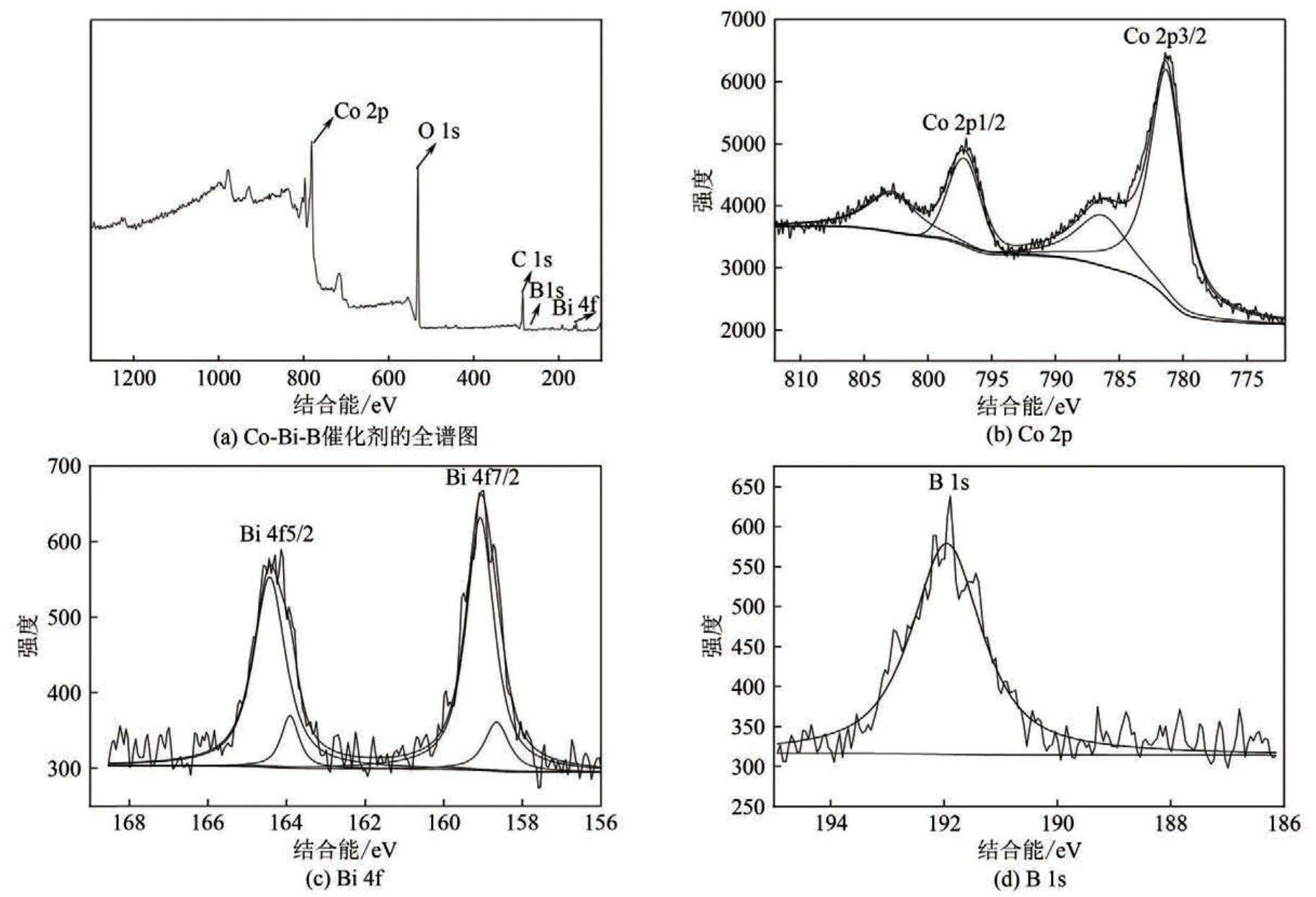
图4 XPS分析
2.1.4 BET表征分析
通过BET 测试测得CoB 的比表面积大约为27.77m2/g,Co-Bi-B催化剂的比表面积为28.47m2/g,见图5。Co-Bi-B催化剂的比表面积比CoB高一些,但是差距不是特别明显,由此可见Co-Bi-B三元合金催化剂活性的提高除了受比表面积影响外,催化剂不同组分之间的电子迁移作用可能起到了更大的作用。

图5 Co-Bi-B与CoB催化剂比表面积对比
2.1.5 不同还原制备温度对催化剂微观形貌的影响
图6 为不同还原制备温度(0℃、25℃和50℃)下所制备的Co-Bi-B催化剂微观形貌图。从图中可以看出0℃时经NaBH4还原所制备的催化剂趋向于分散度更高,团聚程度更低。25℃和50℃还原制备催化剂团聚较为严重,尤其50℃还原制备CoB催化剂粒径趋向于更大。这是由于在高温还原条件下化学反应较快,放热严重,因此所制备的催化剂粒径更大。因此,在后续实验过程中制备催化剂时均控制还原反应温度为0℃。

图6 不同还原温度制备的CoB催化剂SEM图
2.2 催化剂的活性测试
2.2.1 不同还原温度对Co-Bi-B催化性能影响
图7 为在还原温度分别为0℃、25℃和50℃条件下所制备的Co-Bi-B催化剂在相同反应条件下的产氢速率曲线。由图可知在0℃时,经NaBH4还原所制备的催化剂活性明显高于其他温度下所制备的催化剂活性,并且还原温度为25℃和50℃所制备催化剂活性基本相同。这是由于在低温还原条件下化学反应相对较慢,所制备的催化剂粒径较小,分散度更高,因此催化剂具有更高的催化活性,这与前面的SEM表征结果较为一致。
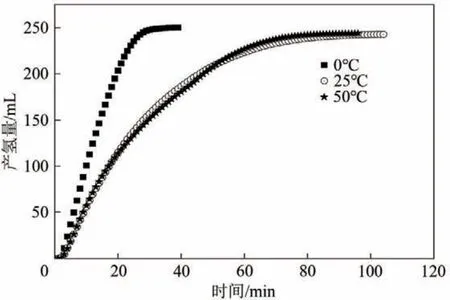
图7 不同反应温度条件下制备催化剂的活性
2.2.2 Bi的掺杂比对NaBH4催化性能影响
图8 显示了不同n(Bi)∶n(Bi+Co)的Co-Bi-B 催化剂在30℃时催化NaBH4水解产氢的性能,n(Bi)∶n(Bi+Co)分别为0、5%、10%、15%、20%。从图中可以看出,随着掺杂Bi比例的增加,Co-Bi-B催化NaBH4制氢的速率先增加后下降。掺杂比例为5%、10%、15%的Co-Bi-B 催化剂的催化效果明显优于纯CoB 催化剂,并且当Bi 的掺杂比例为10%时催化效果最好,产氢速率高达610.6mL/(min·g)。当Bi的掺杂比例大于10%以后,催化活性开始下降。因此,适量Bi 掺杂的催化剂催化活性更好,过高的掺杂量会降低催化剂的整体催化活性。
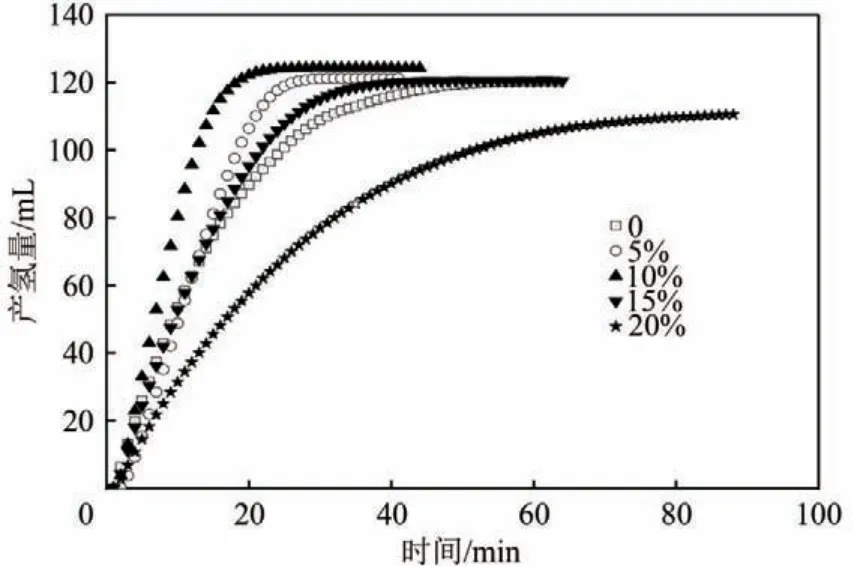
图8 在30℃下不同Bi质量分数的Co-Bi-B催化剂的催化活性对比
2.2.3 反应温度对NaBH4制氢的影响
图9 为Bi 掺杂为10%的Co-Bi-B 催化剂在30℃、35℃、40℃、45℃、50℃时催化NaBH4溶液反应制氢曲线。从图中明显看出随着温度的增加,NaBH4水解产氢速率逐渐增加,当温度达到50℃时产氢速率高达1104.4mL/(min·g)。这主要是由于随着温度的逐渐增高,反应系统中的NaBH4扩散速率逐渐增加,和催化剂接触概率增加,从而导致反应速率增大。

图9 反应温度对NaBH4水解制氢的影响
图10 为Co-Bi-B 复合催化剂的lnk与1/T的Arrhenius 曲 线。lnk=-Ea/RT+lnA式 中,k为 反 应 速率常数;T 为反应温度;Ea为反应活化能。根据公式计算所得该催化剂的活化能为Ea=38.97kJ/mol,其明显小于文献中Co 基催化剂的活化能[17,24]。如张月[25]采用化学镀法在γ-Al2O3小球载体上负载了Co-Ni-Cr-P 四元合金催化剂,其在NaBH4水解制氢中的活化能为45.96kJ/mol,梁志花等[26]制备的负载型CoB/ZIF-7 催化剂活化能为51.48kJ/mol。
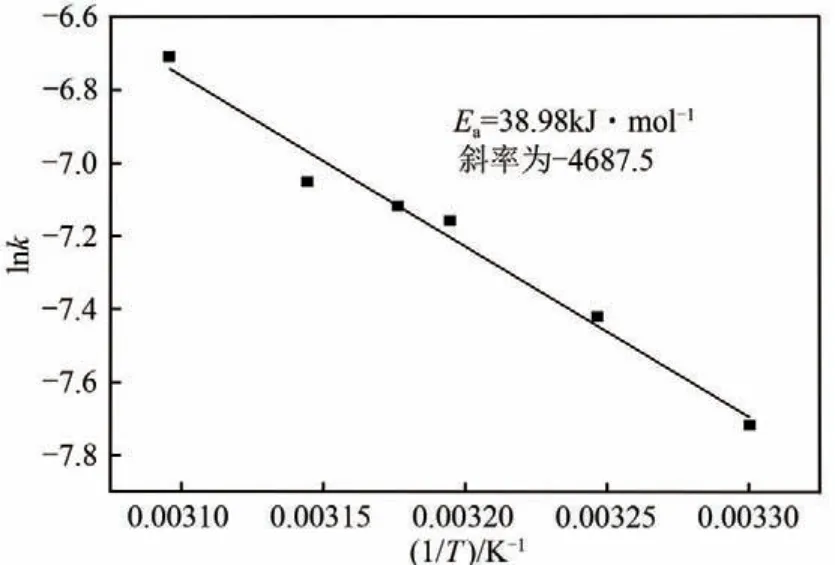
图10 Co-Bi-B催化剂制氢反应Arrhenius曲线
3 结论
(1)采用液相共还原法制备了Co-Bi-B三元复合催化剂,通过XRD、SEM-EDX、BET 和XPS 对材料结构、形貌和元素分布进行了分析发现掺杂Bi可以有效提高催化剂的分散度。
(2)在还原温度为0℃、n(Bi)∶n(Bi+Co)为10%条件下所制备的Co-Bi-B复合催化剂的催化剂活性最高。
(3)随着温度的升高,Co-Bi-B 催化剂催化NaBH4水解反应速率增加。通过对水解制氢过程进行动力学研究计算得到基于Co-Bi-B催化剂水解反应的活化能为38.97kJ/mol,实验结果表明基于Co-Bi-B 三元合金催化剂的硼氢化钠水解制氢反应具有较低的活化能。
