中性粒细胞/淋巴细胞值、血小板/淋巴细胞值、淋巴细胞/单核细胞值对食管癌根治术后吻合口瘘的预测价值
2021-09-28俞越韩云
俞越,韩云
(中国医科大学附属盛京医院胸外科,第二胸外科病房,沈阳 110004)
食管癌是最常见的消化道恶性肿瘤之一。据癌症统计报告显示,全球食管癌新发病例约为57.2万例,发病数量在恶性肿瘤中排第7位[1]。手术是治疗食管癌的最主要方式之一,然而食管术后可能出现多种并发症。其中,术后吻合口瘘(anastomtic leakage,AL)是最常见的严重并发症之一。近年来,据国外文献[2]报道,食管切除术后AL的发生率为3.4%~20%;死亡率达50%左右。目前,临床中对AL尚无有效的预判,往往是AL发生后才采取补救性措施。因此,在临床工作中,需要进一步寻找AL的高危因素并尽早采取干预措施,从而减少AL发生。
研究[3-4]发现,全身炎症反应可能与肿瘤的发展以及组织的愈合相关,目前全身炎症反应的主要指标有中性粒细胞/淋巴细胞值(neutrophil/lymphocyte ratio,NLR)、血小板/淋巴细胞值(platelet/lymphocyte ratio,PLR)以及淋巴细胞/单核细胞值(lymphocyte/monocyte ratio,LMR)等。本研究拟探讨NLR、PLR、LMR值对食管癌根治术后AL的预测作用,以期发现术后AL的高危因素,从而尽早干预,降低AL发生率。
1 材料与方法
1.1 一般资料
回顾性分析 2016年 1月1日至2019 年 12 月31日中国医科大学附属盛京医院胸外科收治的182例行食管癌根治术患者的病例资料,所有手术均由我院经验丰富的主任医师完成。年龄32~80岁,其中,女17例,男165例。术后病理诊断:鳞状细胞癌127例,腺癌54例,小细胞癌1例。纳入标准:(1)切除肿瘤标本经病理证实为恶性肿瘤;(2)入院第2天有晨起血常规检查结果,手术后第4天晨起有血常规检查结果。排除标准:(1)术前接受新辅助化疗等其他治疗者;(2)围术期存在其他影响外周血细胞的疾病(如呼吸、泌尿系统感染、白血病等)者;(3)术中或术后4 d内有输血史者;(4)多发转移者。
1.2 记录内容
一般情况及既往史:年龄、性别、体质量指数(body mass index,BMI)、病理类型、肿瘤分期、糖尿病史、术前白蛋白值。实验室检查指标:术前NLR、术前PLR、术前LMR、手术前后NLR的变化值(术后NLR/术前NLR)、手术前后PLR的变化值(术后PLR/术前PLR)及手术前后LMR的变化值(术后LMR/术前LMR)。用入院第2天晨起空腹血常规结果计算术前NLR、PLR以及LMR值;用术后第4天晨起空腹血常规结果计算术后NLR、PLR以及LMR值(血常规均采用我院同一规格型号设备检验)。手术情况:手术时长、术式以及术中失血量。
1.3 术后AL的判定标准
术后出现原因不明的发热,切口处红肿、疼痛、触之有波动感;切口处存在积液、积气,痰液、胃液等溢出;胸部CT显示纵隔内或吻合口周围存在不同程度渗出、积液或积气。同时合并以下任意1条即可确诊[5]:(1)颈部切口打开后能直接看到瘘口;(2)口服美兰后食管床引流液、胸腔引流液或颈部引流液染色;(3)行上消化道检查,应用泛影葡胺或碘剂造影可见造影剂外溢;(4)数字减影血管造影(digital subtraction angiography,DSA)显示造影剂吻合口处外溢。
1.4 统计学分析
采用SPSS 22.0软件进行统计分析,应用受试者工作特征(receiver operating characteristic,ROC)曲线计算每组指标的最佳截断值。单因素分析采用t检验、χ2检验或Fisher确切概率法,采用logistic回归模型进行多因素分析。P< 0.05为差异有统计学意义。
2 结果
本研究共纳入182例行食管癌根治术患者,术后发生AL23例,发生率为12.64%,平均住院日为(39.61±3.85)d。
2.1 NLR、PLR、LMR相关值对术后AL的预测价值以及最佳截点的获取
通过绘制ROC曲线发现,高NLR变化值、高PLR变化值、低LMR变化值对食管癌根治术后发生AL有较好的预测效能,其曲线下面积(area under curve,AUC)分别为0.714、0.691、0.62,Youden指数所对应的最佳截点分别为3.36、2.26、0.65。见图1~3。
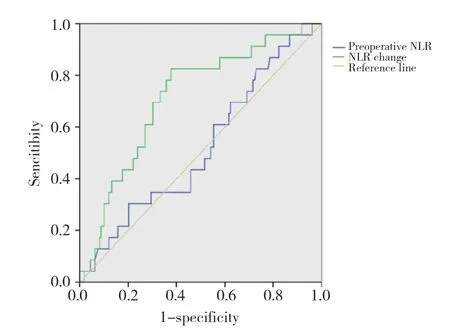
图1 术前NLR、NLR变化值预测AL的ROC曲线Fig.1 ROC curve of prediction for AL by the preoperative NLR and NLR variation
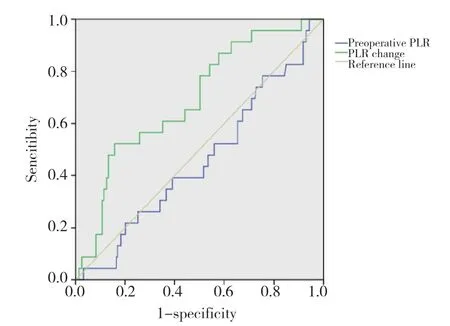
图2 术前PLR、PLR变化值预测AL的ROC曲线Fig.2 ROC curve of prediction for AL by the preoperative PLR and PLR variation
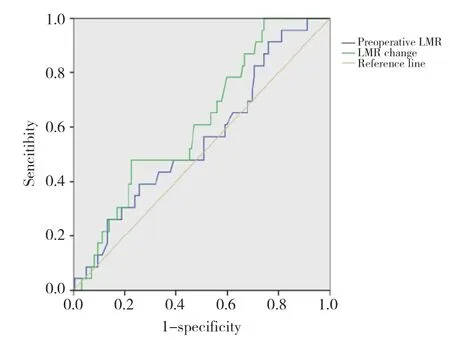
图3 术前LMR、LMR变化值预测AL的ROC曲线Fig.3 ROC curve of prediction for AL by the preoperative LMR and LMR variation
2.2 AL发生的独立危险因素分析
对AL组和无AL组患者的一般资料、术中情况及实验室化验结果进行单因素分析(表1)。发现术后AL与手术方式、手术时间、糖尿病、NLR变化值≥3.36、PLR变化值≥2.26、LMR变化值<0.65以及术前白蛋白<35 g/L与AL的发生有相关关系。将上述可能引起AL的相关因素进一步行多因素logistic分析,结果发现,术前合并糖尿病、NLR变化值≥3.36、PLR变化值≥2.26是食管癌根治术后AL发生的独立危险因素,见表2。
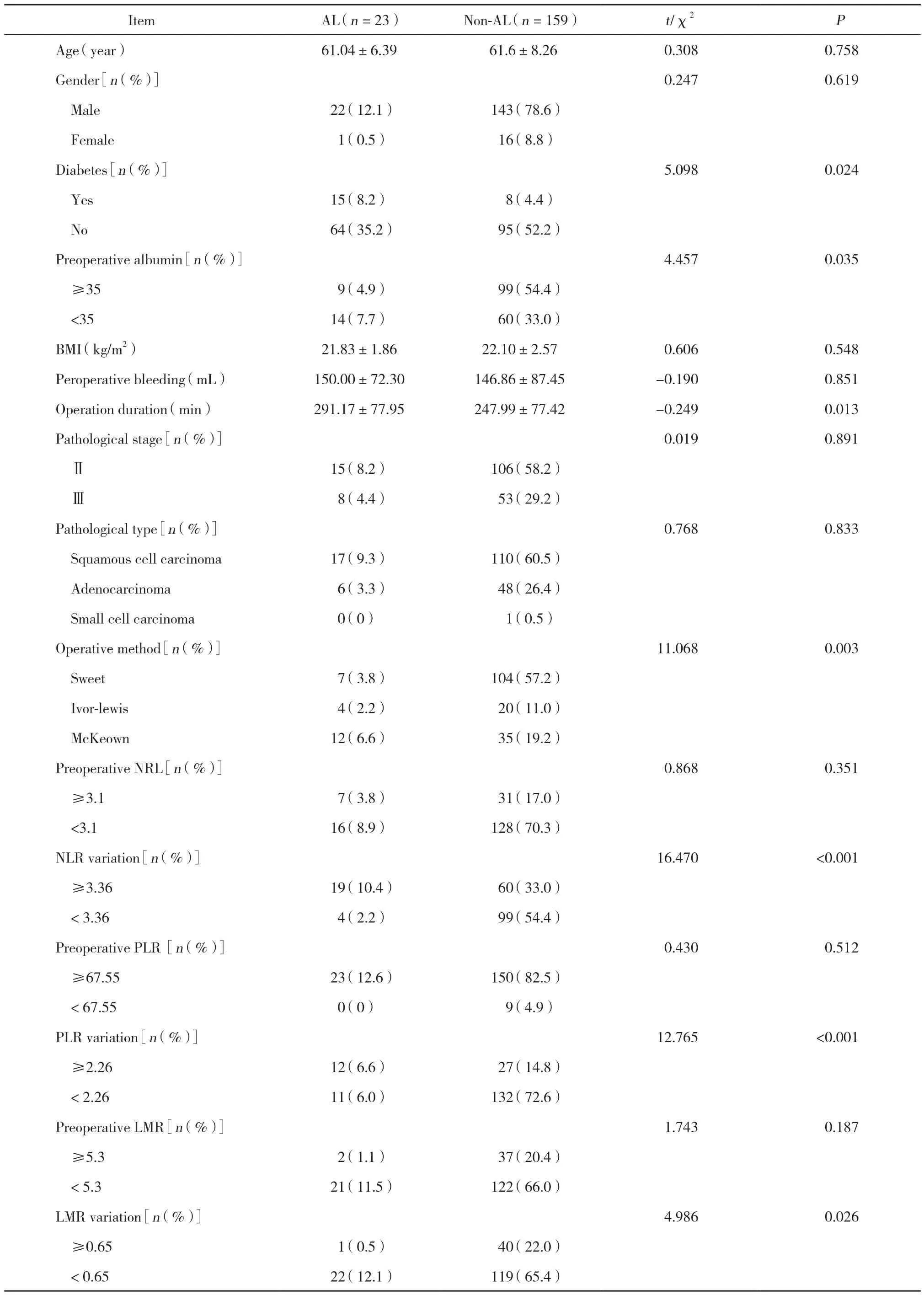
表1 AL的单因素分析结果Tab.1 Comparison of general medical data

表2 多因素回归分析Tab.2 Multi variate logistic regression analysis
3 讨论
随着现代医学的发展,食管癌手术患者的预后较前显著改善,并发症发生率也明显降低,但术后AL的发生率仍然很高。本研究术后AL发生率为12.64%,与国内外研究[2]结果相似。目前认为术后发生AL的原因很多,主要原因有吻合口张力过大,吻合口区域血运不佳,吻合口周围感染等[6-9]。已有研究[10-11]证实,NLR、PLR及LMR可以作为肿瘤术后并发症以及预后的预测指标。因此,本研究探讨了NLR、PLR、LMR 对于食管癌根治术后AL的意义,以期发现AL的高危因素,及时采取处理措施降低AL的发生率。
中性粒细胞作为主要的炎症细胞,可以分化为血管内皮生长因子等多种细胞因子;淋巴细胞本身可直接杀伤肿瘤细胞,还可以介导细胞毒作用以及释放炎性因子,发挥抑制肿瘤作用[12]。术前NLR能反映肿瘤进展与机体免疫的关系。术后NLR反映了炎症反应的强弱和机体自我修复程度,术后高NLR可能与自我修复缺陷相关,但尚无明确证据[13-14]。术后NLR大幅升高可能提示预后不佳或过度炎症反应,这些炎症反应可能源于自我修复的过程,也可能来自手术并发症。血小板作为发挥凝血功能的重要组成同样与肿瘤的预后相关。肿瘤在发展的过程中,可促进血小板升高,使机体处于高凝状态,导致组织血供减少从而产生相关并发症[15]。术后PLR升高可能引起吻合口处组织血运不佳,是AL的诱因之一。单核细胞分泌的炎性细胞因子,如肿瘤坏死因子、白细胞介素等可以抑制适应性免疫和促进血管生成[16]。术后LMR降低可能提示吻合口处的侧支循环的建立受抑制[17],影响吻合口处的血运,导致AL的发生。
本研究结果显示,手术前后NLR变化值≥3.36、PLR变化值≥2.26、LMR变化值<0.65时,提示AL的风险较高。进一步多因素回归分析结果显示,手术前后高NLR、PLR变化值是AL的独立危险因素。而手术前后LMR变化值不是影响AL发生的独立危险因素(P> 0.05)。术后AL的危险因素还有很多,本研究纳入了部分可能导致AL的危险因素,并证实合并糖尿病为AL 发生的独立危险因素(P< 0.05)。但手术方式、术前营养状态、手术时间与AL的相关性与某些研究[18]不符,可能是由于研究样本差异性导致。
综上,手术前后高NLR、PLR变化值对食管癌术后AL具有一定的预测价值。针对高危人群,可以通过应用免疫调节制品、及时调整抗生素、延缓进食时间等方法预防AL。同时应对高危人群早期进行检查,尽早发现早期AL,早期治疗,从而缩短AL治愈时间。本研究作为单中心回顾性研究仍存在一些局限性,未来还需大样本多中心以及前瞻性研究来进一步证实本研究结果。
