SOX21在胃癌中的表达和甲基化状态及对体外胃癌细胞的作用*
2021-09-28李丽萍贾筠蔡永昌赖庆君彭尧
李丽萍 贾筠 蔡永昌 赖庆君 彭尧
(1.东莞市人民医院肿瘤内科四区,广东 东莞 523059; 2.东莞市人民医院肿瘤内科,广东 东莞 523059;3.东莞市人民医院胃肠外科,广东 东莞 523059;4. 广州医科大学基础医学院,广东 广州 510095)
胃癌(gastric cancer,GC)是世界上第四大最常见的癌症,也是导致癌症相关死亡的第二大原因。2018年,胃癌的发病率在全球排名第六,新增病例为1,033,701例(占所有癌症类型的新增病例的5.7%)[1]。癌症作为一种复杂的多因素疾病,是遗传学和表观遗传学途径之间相互作用的结果。表观遗传学研究表明,DNA甲基化通过干扰DNA和染色质分子结构在促进胚胎发育、衰老和许多类型的癌症中必不可少[2]。促癌基因启动子低甲基化和抑癌基因启动子高甲基化是肿瘤的一个重要的特征。因此,基因的异常甲基化可以作为不同癌症类型的标志,并可用于癌症的诊断和分类[3]。性别决定区Y-BOX 21(sex-determining region Y- box 21,SOX21)是SOX家族蛋白质B2组的成员之一,位于13q32.1染色质上,具有高迁移率基团DNA结合域,在胚胎发育、神经和牙齿形成等过程中发挥重要作用[4]。最近的研究表明,在大肠癌组织中,SOX21基因启动子甲基化率明显高于癌旁组织,SOX21基因启动子甲基化可作为大肠癌患者粪便和血浆中一种潜在的非侵入性诊断标志物[5]。目前,关于SOX21基因在胃癌中的甲基化状态及对胃癌细胞的作用尚不明确。Wnt信号通路影响细胞生长、胚胎发育、肿瘤细胞分裂、增殖、肿瘤发展、转移和预后[6]。Zhou W等[7]通过实验证明抑制Wnt/β-catenin信号通路,可抑制胃癌细胞增殖、迁移、侵袭和血管生成。本研究探讨SOX21在胃癌组织中的表达及甲基化水平,进一步分析SOX21是否通过调控Wnt/β-catenin信号通路在胃癌细胞中发挥作用,以期为明确胃癌的发病机制、开发新的胃癌诊断靶点及治疗策略提供新的科学依据。
1 资料与方法
1.1 一般资料 收集2016年4月~2017年5月于东莞市人民医院行胃癌根治术患者的癌组织及对应的癌旁组织各44例。其中男23例,女21例,年龄34~71岁,平均(53.181±10.775)岁。纳入标准:①患者经影像学及组织学检查诊断为原发性胃癌。②患者术前未进行放、化疗及生物治疗。③患者无其他肿瘤或重大疾病。④组织标本经我院病理科鉴定,确认为癌组织及癌旁组织。
1.2 主要材料 胃癌细胞株AGS和人胃粘膜上皮细胞株GES-1购自武汉普诺赛生命科技有限公司;SOX21过表达慢病毒液(简称SOX21)及其阴性对照慢病毒液(简称NC)购自武汉金开瑞生物工程有限公司;DNA提取试剂盒和DNA重亚硫酸盐转化试剂盒购自天根生化科技(北京)有限公司;SOX21抗体购自美国Santa Cruz Biotechnology公司;β-catenin、c-myc、cyclinD1、MMP7和GAPDH抗体购自武汉三鹰生物技术有限公司;CCK-8试剂盒购自武汉博士德生物工程有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京森贝伽生物科技有限公司。
1.3 方法
1.3.1 细胞培养及慢病毒转染 AGS和GES-1细胞用含10% FBS的DMEM培养基,于37℃、5%CO2培养箱中培养。待细胞密度达到80%~90%时,0.25%胰酶液消化细胞,收集细胞。MSP检测AGS和GES-1细胞中SOX21启动子甲基化状态,qRT-PCR和Western blot检测SOX21的表达。此外,将对数期生长的AGS细胞接种于6孔板中(4×105个/mL),继续培养24h后,将细胞分为空白对照组、NC组和SOX21组。弃去细胞培养基,添加含有6μg/mL polybrene的2mL新鲜培养基,NC组和SOX21组分别加入NC和SOX21慢病毒液各70MOI,空白对照组加入等量PBS,细胞继续培养24h后,更换新鲜培养基继续培养。48h后进行后续实验。
1.3.2 甲基化特异性PCR(Methylation-Specific PCR,MSP)检测组织和细胞SOX21启动子甲基化状态 收集AGS和GES-1细胞,GC组织及其癌旁组织,按照DNA提取试剂盒说明书提取细胞和组织的总DNA并测定DNA浓度及纯度。取1000ng DNA样品,参照DNA重亚硫酸盐转化试剂盒说明书进行DNA重亚硫酸盐转化及DNA纯化。根据SOX21基因序列信息,利用 Methyl Primer Express v1.0 软件设计SOX21基因的甲基化引物和去甲基化引物。甲基化上游引物:5′- ATGGAATTCTCTTCTTGGCT CCGGGCAGGGTG-3′,甲基化下游引物;5′-ATGA AGCTTCTGAGCCGGTGCAGAGGGCG-3′;去甲基化上游引物:5′-ATGGAATTCGTTTAGGCGAGTG GAGAGTCCG-3′,去甲基化下游引物:5′-ATGCTCG AGAATCTTTAGGACAAAACTGAGC-3′。 扩增条件为:95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 1 min,共40个循环;72℃ 10 min。反应结束后,PCR产物用2%琼脂糖凝胶进行电泳检测。
1.3.3 qRT-PCR检测SOX21 mRNA表达 Trizol法提取细胞和组织总RNA,并将RNA逆转录合成cDNA。根据SYBRRPremix Ex TaqTMⅡ试剂盒说明书检测SOX21 mRNA表达。反应条件:95℃、30s;95℃、5s,60℃、34s,40个循环。SOX21以GAPDH为内参,采用2-ΔΔCt法计算其mRNA表达。SOX21上游引物:5′- GCACAACTCGGAGATCAGCA-3′, SOX21下游引物:5′-CCGGGAAGGCGAACTTGTC-3′; GAPDH上游引物:5′-TGCACCACCAACTGCTTAGC-3′, GAPDH下游引物:5′-GGCATGGACTGTGGTCATGAG-3′。
1.3.4 免疫组化检测组织中SOX21表达 GC组织及其癌旁组织用4%多聚甲醛固定72h,梯度酒精脱水,二甲苯透明。石蜡包埋、切片。常规脱蜡至水,3% H2O2避光孵育15min,PBS清洗后,5%BSA避光孵育1h,SOX21抗体(1∶200)4℃孵育过夜。二抗(1∶400)避光孵育1h。DAB显色液显色,苏木素染液染色5min。自来水冲洗,1%盐酸酒精溶液分化10s。0.2%氨水做返蓝处理8s。切片经自来水冲洗后,进行脱水、透明处理,中性树胶封片,光学显微镜观察分析。通过染色强度和面积分数的总和评估IHC分数。 染色强度:0表示无染色,1表示弱染色,2表示中度染色,3表示强染色。 染色面积:0表示0%~5%,1表示6%~25%,2表示26%~50%,3表示> 50%。
1.3.5 Western blot检测SOX21和Wnt/β-catenin通路相关蛋白表达 RIPA裂解液裂解细胞或组织,收集上清,BCA法测定其蛋白浓度。取各样品30μg蛋白进行SDS-PAGE分离,湿转法将胶块中的蛋白转至PVDF膜上。10%脱脂奶粉封闭,SOX21抗体(1∶1000)、β-catenin抗体(2∶1000)、c-myc抗体(2∶1000)、cyclinD1抗体(2∶1000)、MMP7抗体(1∶1000)和GAPDH抗体(1∶5000)4℃孵育过夜, 二抗(1∶5000)室温孵育1h。 ECL发光液显色,暗室曝光。
1.3.6 CCK-8试剂盒检测细胞活力 将慢病毒感染后的AGS细胞接种于96孔板(5×103个细胞/孔),细胞继续培养12、24、48、72h后,向每孔细胞中加入10μL CCK-8,37℃条件下孵育3h。酶标仪测定各孔在450nm处的光密度(OD)值。
1.3.7 克隆形成实验检测细胞增殖能力 0.25%胰酶消化慢病毒感染后的AGS细胞,新鲜培养基重悬细胞。取200个AGS细胞接种于培养皿中,细胞于37℃、5% CO2培养箱中持续培养2周。PBS清洗细胞,4%多聚甲醛固定细胞,0.1%结晶紫染液染色1h,流水缓慢洗去染液,空气干燥,观察细胞克隆形成数量。
1.3.8 流式细胞术检测细胞凋亡 将AGS细胞接种于6孔板(5×106个细胞/mL),继续培养24h 。收集AGS细胞,加入300μL 的1×Binding Buffer 重悬细胞。加入5μL的Annexin V-FITC,室温避光孵育15min。随后再加入5μL的PI染色,补加200μL的1×Binding Buffer,立即上流式细胞仪检测。
1.3.9 Transwell检测细胞迁移和侵袭能力 迁移实验:上腔室加入100μL 含5×104个AGS细胞的细胞悬液,下腔室加入500μL含20% FBS的DMEM培养基,37℃、 5%CO2条件下培养24h。5%戊二醛4℃条件下固定,0.1%结晶紫室温染色30min,显微镜下观察。侵袭实验:无血清DMEM培养基稀释Matrigel。取100μL稀释液加入上腔室中,37℃孵育至凝固。随后按照迁移实验步骤进行后续实验。

2 结果
2.1 SOX21在胃癌组织中的甲基化率及表达水平 与癌旁组织相比,GC组织中SOX21甲基化率明显升高(P<0.001),SOX21 IHC评分、mRNA表达和蛋白表达均明显降低(P<0.05),见表1、图1。
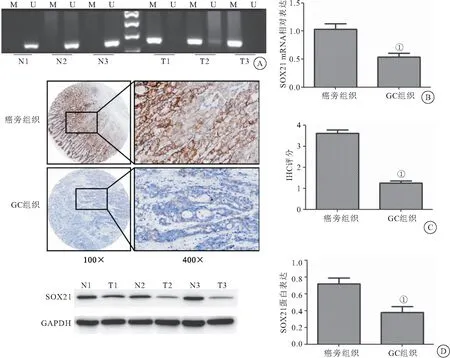
图1 SOX21在胃癌组织中的甲基化及表达水平
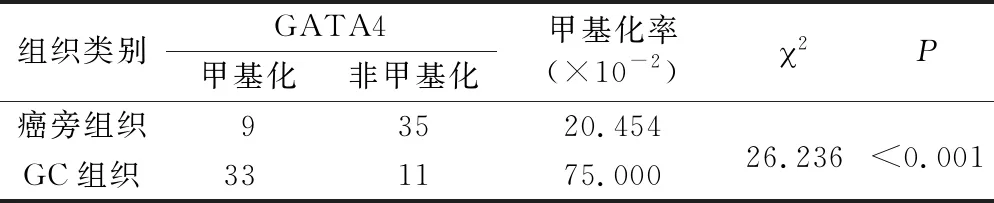
表1 GC组织和癌旁组织中SOX21甲基化状态
2.2 SOX21在胃癌细胞中的甲基化及表达水平 SOX21在GES-1细胞中呈去甲基化状态,而在AGS中呈完全甲基化状态。与GES-1细胞相比,AGS细胞中SOX21 mRNA和蛋白表达均显著降低(P<0.05),见图2。

图2 SOX21在胃癌细胞中的甲基化及表达水平
2.3 过表达SOX21对胃癌细胞增殖的影响 与NC组相比,SOX21组中SOX21 mRNA和蛋白表达明显升高(P<0.05),24、48、72h细胞活力明显降低(P<0.05),克隆形成数明显降低(P<0.05),见图3。
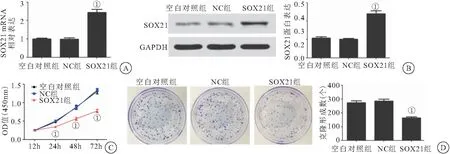
图3 过表达SOX21对胃癌细胞增殖的影响
2.4 过表达SOX21对胃癌细胞凋亡的影响 与NC组相比,SOX21组细胞凋亡率明显升高(P<0.05),见图4。
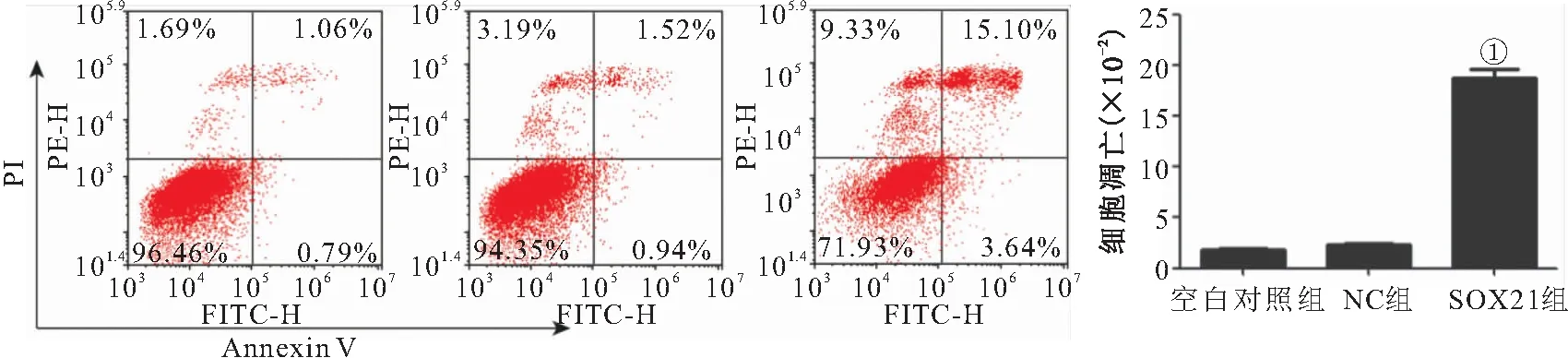
图4 过表达SOX21对胃癌细胞凋亡的影响
2.5 过表达SOX21对胃癌细胞迁移和侵袭的影响 与NC组相比,SOX21组迁移和侵袭细胞数明显降低(P<0.05),见图5。
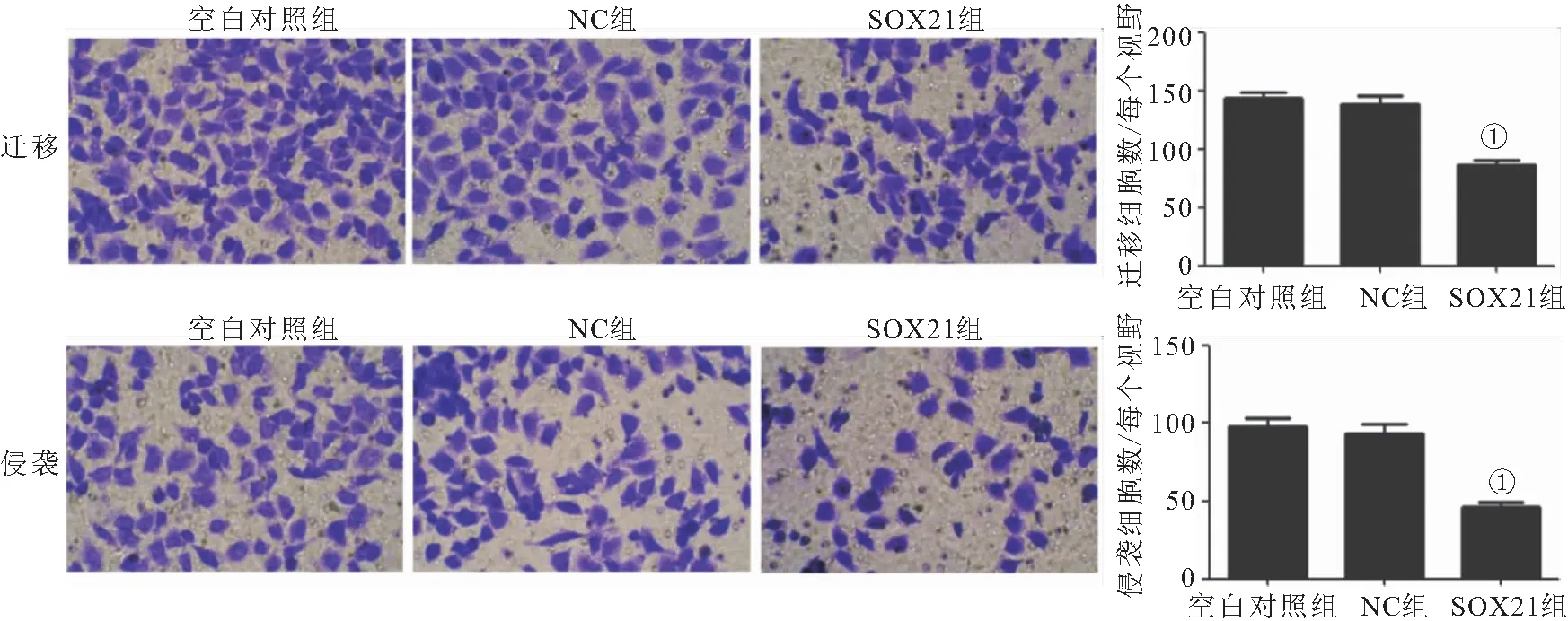
图5 过表达SOX21对胃癌细胞迁移和侵袭的影响(200×)
2.6 过表达SOX21对Wnt/β-catenin通路的影响 与NC组相比,SOX21组细胞中β-catenin、c-myc、cyclinD1和MMP7蛋白表达均明显降低(P<0.05),见图6。
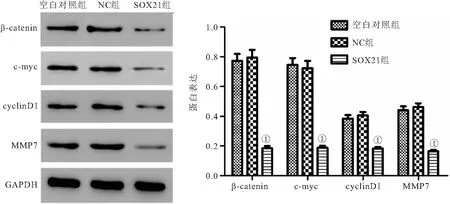
图6 过表达SOX21对Wnt/β-catenin通路的影响
3 讨论
GC是消化系统最常见的恶性肿瘤之一。80%的GC患者早期无明显症状,确诊时已进入晚期,尽管进行了胃切除术和化疗治疗,患者的5年生存率仍然不到20%[8]。因此,GC的早期诊断和治疗尤为重要。DNA甲基化作为表观遗传学的一种表现形式,是基因表达调控的重要机制。启动子的异常甲基化在肿瘤早期诊断、疗效预测、预后评估和指导个体化治疗等方面具有重要作用[9]。SOX21在胶质瘤形成过程中可能通过改变SOX 2和SOX 21之间的平衡而发挥肿瘤抑制作用,SOX2/ SOX21轴可能成为胶质瘤新的治疗靶点[10]。
SOX13是BOX家族D组成员之一,是胚胎发育和软骨形成的重要调节因子。SOX13在肿瘤组织中的表达高于在配对的非肿瘤组织中的表达。SOX13表达上调与肝癌患者分化差、转移、复发、总体及无瘤生存率差有关[11]。SOX6和SOX21可能是胶质母细胞瘤的一个预后标志物和潜在的治疗靶点[2]。对结直肠癌组织和粪便标本进行检测发现,SOX21基因启动子发生异常高甲基化[13]。此外,已有研究表明,从正常胃黏膜组织经由萎缩性胃炎最后发展到胃癌过程中,SOX21蛋白表达量逐渐下调,提示SOX21在胃癌中可能发挥着抗肿瘤作用[14]。本研究结果显示,SOX21基因启动子在GC组织中呈异常甲基化状态,SOX21表达下调。同样的,在GC细胞株中SOX21基因启动子也发生异常甲基化,SOX21表达下调。过表达SOX21后,GC细胞增殖、迁移和侵袭能力明显下调,细胞凋亡率明显上调。该结果表明,SOX21在胃癌中发挥着抗肿瘤作用。
有证据表明,Wnt/β-catenin信号过度激活广泛存在于不同恶性肿瘤中,尤其是消化系统肿瘤,因此靶向抑制Wnt/β-catenin通路在抑制肿瘤进展方面具有巨大应用潜力[15]。研究表明,促进Wnt/β-catenin信号通路的主要级联基因,包括WNT11、FZD家族和DVL2,在高危侵袭性胃肠道间质瘤中上调[16],该结果表明Wnt/β-catenin信号通路的激活对侵袭性胃肠道间质瘤的发生发展具有重要意义。肿瘤坏死因子受体超家族成员11B促进了GC细胞的侵袭,并激活了Wnt/β-catenin信号通路[17]。维甲酸相关孤儿受体可通过下调Wnt/β-catenin信号通路,抑制胃癌细胞增殖、上皮-间质转化和侵袭[18]。同样的,沉默T-box3可通过抑制Wnt/β-catenin信号通路中Wnt3α、β-catenin和c-myc的表达,抑制Wnt/β-catenin通路激活,从而抑制胃癌细胞增殖、迁移和侵袭[19]。李萍等的研究结果也表明,上调Wnt/β-catenin通路中Wnt、β-catenin、cyclinD1和c-myc的表达可促进胃癌细胞增殖并抑制凋亡[20]。本研究结果显示,过表达SOX21后,可下调Wnt/β-catenin信号通路中β-catenin、c-myc、cyclinD1和MMP7蛋白表达。
4 结论
SOX21基因启动子在GC组织和细胞中异常甲基化,过表达SOX21可能通过下调Wnt/β-catenin信号通路抑制GC细胞增殖、迁移和侵袭,促进细胞凋亡。本研究结果为明确胃癌的发病机制、开发新的胃癌诊断靶点及治疗策略提供了新的科学依据。
