培美曲塞对人肺腺癌HCC827细胞株PD-L1表达的影响及作用机制
2021-09-28王洁刘单邓述恺
王洁 刘单 邓述恺
(西南医科大学附属医院呼吸与危重症医学科,四川 泸州 646000)
全球肺癌的发生率和死亡率均居所有癌症首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌类型的85%左右[1]。尽管目前肺癌治疗方式较多,但化疗仍是肺癌治疗的重要基石之一。培美曲塞是一种多靶点的抗叶酸化疗药物,主要是基于其抑制高增殖细胞中叶酸代谢的能力,被推荐用于非鳞非小细胞肺癌的一线治疗[2],目前CSCO指南推荐培美曲塞是一种有效的联合免疫检查点阻断治疗晚期非小细胞肺癌的药物。但其对肿瘤免疫的影响,特别是对NSCLC免疫的影响,尚未得到充分的研究。程 序 性 死 亡 受 体-1(PD-1)属于抑制性T细胞受体,通常由活化的T细胞和长期暴露于各种抗原的抗原特异性T细胞表达,其配体程序性细胞死亡配体-1(PD-L1)在包括NSCLC在内的多种人类癌症中经常高表达,与预后不良有关[3]。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase,AKT)信号通路在调节细胞增殖、存活和迁移的多种生物活性中起着关键作用,该信号通路的激活是许多人类癌症生长的核心[4-5]。本实验拟通过Pem对HCC827细胞株PD-L1表达的影响,初步探讨其可能的作用机制,为Pem抗肿瘤效应可能与抑制PD-L1的表达从而消除肿瘤细胞对免疫系统的抑制作用相关提供实验依据。
1 材料与方法
1.1 试剂及仪器 HCC827细胞株,DMEM高糖培养基(HyClone);Pem(美国Selleck生物科技有限公司);CCK-8检测试剂盒(上海碧云天生物技术有限公司);SDS-PAGE凝胶制备试剂盒、BCA蛋白质浓度测定试剂盒(武汉阿斯本生物技术有限公司);PD-L1单克隆抗体(eBioscience)、AKT 、p-AKT 一抗(美国 CST 公司);内参GAPDH抗体(英国 Abcam 公司);流式细胞仪(美国 BD 公司)。
1.2 方法
1.2.1 细胞的培养及传代 将HCC827细胞系在含10%胎牛血清的DMEM高糖培养基中培养,后放置于5% CO2、37℃培养箱中生长,贴壁生长到一定程度后,经胰蛋白酶消化传代。
1.2.2 采用CCK-8 法测定不同浓度及时间时Pem对细胞增殖的抑制作用 收集对数生长期的HCC827细胞,接种于96孔板,培养24h后,分为对照组(加入培养液)和实验组(Pem浓度分别为0.01、0.1、1、10、100 μmol/L ),每组设 5 个重复,分别孵育12、24和48 h,每孔分别加入CCK-8 试剂10uL,置于培养箱中继续孵育4 h。使用酶标仪测定450nm光密度值(OD),同时计算细胞增殖抑制率及半抑制浓度(IC50)用于后续实验,细胞存活率%=(1- OD实验组/ OD对照组)×100%。实验结果表明,48h对细胞抑制效果最好,并以此作为后续实验时间。
1.2.3 流式细胞仪测定不同浓度Pem对细胞PD-L1表达影响 按照1×105个/mL将HCC827 细胞株接种于 6 孔板,实验分组部分同 1.2.2,分别使用不同浓度Pem作用细胞48 h后,在超净台内收集细胞,离心弃去上清液,分别加入 5μLPD-L1-PE 抗体标记,避光4℃孵育 20min,加1m L鞘液,震荡混匀后,1500rpm 离心5min,弃去上清液,加入 200μL 鞘液,震荡混匀后,流式细胞仪检测,试验重复3次。
1.2.4 WB检测各实验组AKT、P-AKT蛋白水平 将HCC827细胞接种于 96 孔培养板,实验分为对照组(加入培养液)和实验组,实验组再分为Pem 组(加入 IC50 浓度的 Pem)、740-YP组(浓度为25nM)、740-YP(浓度为25nM)+Pem组(加入IC50 浓度的Pem),每组设 5 个复孔。培育 48 h,细胞经裂解液裂解后提取总蛋白。BCA蛋白浓度检测,绘制标准曲线,计算各组待测蛋白的浓度。SDS-PAGE电泳,转移至PVDF膜,使用5%脱脂牛奶密封1h, p-AKT 及AKT一抗 4℃过夜,缓冲液洗膜3次,后加二抗,室温孵育30min,洗膜,ECL发光剂显影、定影。采用GAPDH作为内参用作标准对照,以上操作重复3次。
1.2.5 流式细胞仪检测各实验组PD-L1表达 按照1×105个/mL将HCC827 细胞株接种于 6 孔板,分组部分同1.2.4,分别使用不同浓度Pem作用细胞48 h后,在超净台内收集细胞,离心弃去上清液,分别加入 5μL PD-L1-PE 抗体标记,避光4℃孵育 20min,加1mL 鞘液,震荡混匀后,1500rpm 离心5min,弃去上清液,加入 200μL 鞘液,震荡混匀后,流式细胞仪检测,以上试验重复3次。

2 结果
2.1 不同浓度的Pem对HCC827细胞增殖的抑制作用及IC50 CCK-8结果示,浓度为0.01、0.1、1、10、100μM Pem均可抑制HCC827细胞的增殖,且随着药物浓度的增加,增殖抑制效果更明显,培美曲塞48h组抑制作用强于12h组(P<0.05),与24h组抑制率无明显差别(P>0.05),见表1(Pem12h、24h及48h对应的IC50值分别为0.441、0.309、0.171μmol/L)。

表1 不同浓度Pem对不同时间的HCC827生长抑制率比较
2.2 不同浓度Pem对HCC827细胞表面PD-L1表达的影响 作用于HCC827细胞48h条件下,对照组、0.01、0.1、1、10、100 μM Pem组其PD-L1表达量随着药物浓度增加逐渐下降,差异均有统计学意义(F=311.516,P<0.05),见图1、图2。
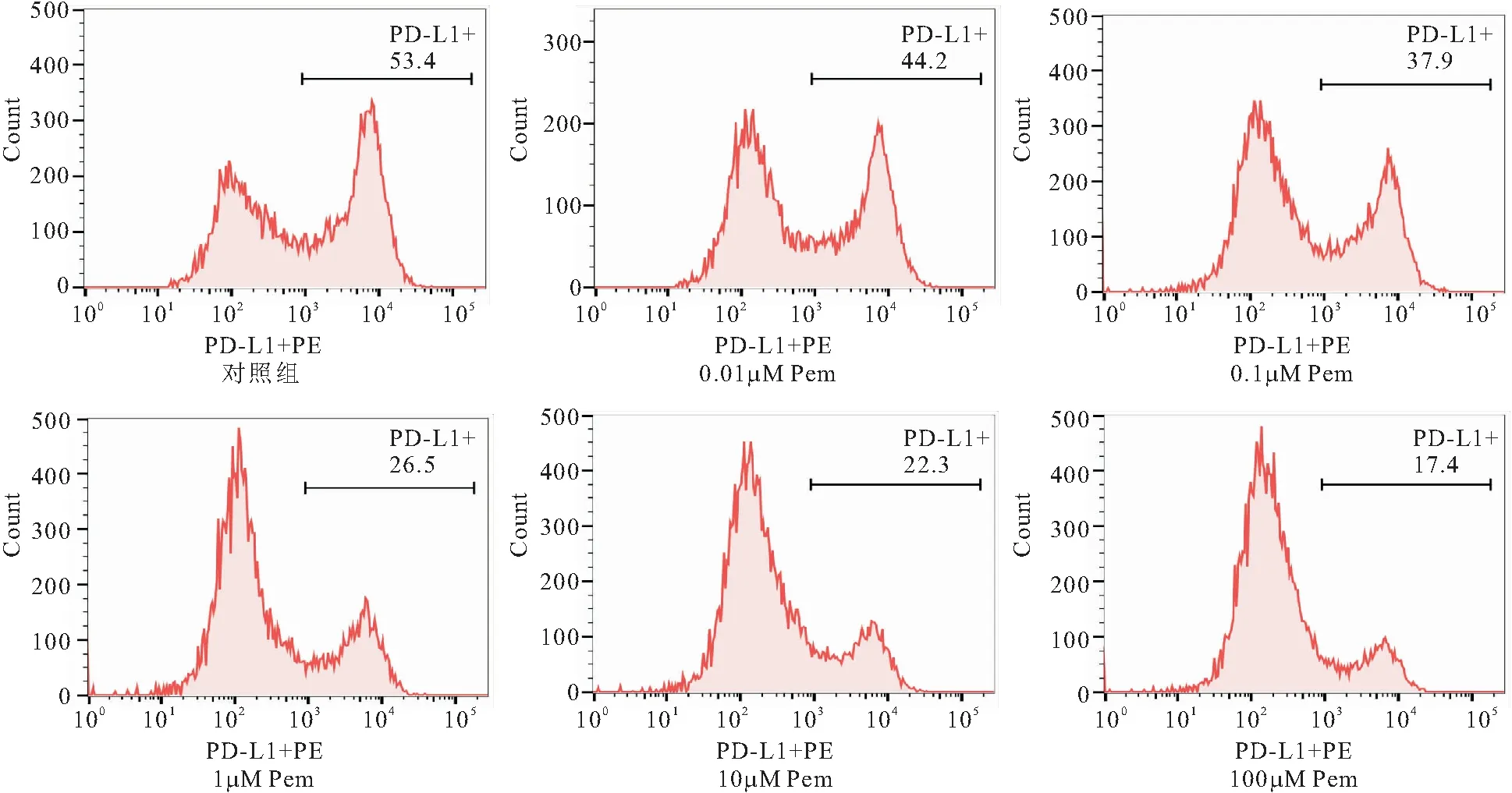
图2 各组HCC827细胞表面PD-L1的表达
2.3 Pem及740-YP对HCC827细胞AKT、P-AKT蛋白表达的影响 作用于HCC827细胞48h后,对照组、Pem组、740-YP组、Pem组+740-YP组P-AKT/GAPDH 值分别为(0.24±0.01)、(0.05±0.01)、(0.54±0.03)、(0.13±0.01),4组比较,差异有统计学意义(F=486.716,均P<0.05);与对照组比较,P-AKT/GAPDH 值在740-YP组上升(P<0.05),在Pem组、Pem+740-YP组均下调(P<0.05),且Pem组P-AKT/GAPDH 值低于Pem+740Y-P组,差异有统计学意义(P<0.05)。对照组、Pem组、740-YP组、Pem组+740-YP组AKT/GAPDH 值分别为(0.63±0.03)、(0.64±0.04)、(0.63±0.03)、(0.65±0.02),4组比较,差异均无统计学意义(F=0.294,P=0.828),见图3、图4、图5。
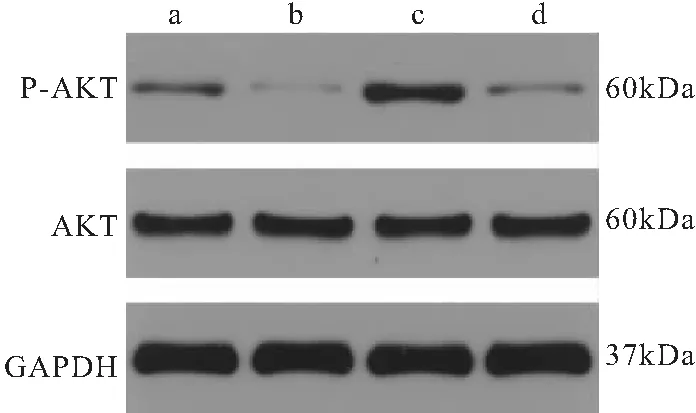
图3 HCC827细胞株P-AKT及AKT蛋白的表达

图4 HCC827细胞株P-AKT蛋白的表达
图5 HCC827细胞株AKT蛋白的表达
2.4 Pem及740Y-P对HCC827细胞PD-L1 表达的影响 作用于HCC827细胞48h后,对照组、Pem组、740-YP组、Pem+740Y-P组PD-L1表达量分别为(59.83±2.58)%、(32.5±1.04)%、(71.63±2.82)%、(41.1±2.48)%,4组比较,差异有统计学意义(F=172.951,均P<0.05);与对照组比较,740-YP组PD-L1表达量上调(P<0.05),Pem组、Pem+740-YP组PD-L1表达量均下降(P<0.05),且Pem组PD-L1表达量低于Pem+740-YP组,差异均有统计学意义(均P<0.05),见图6、图7。

图6 药物对HCC827细胞表面PD-L1表达影响的比较
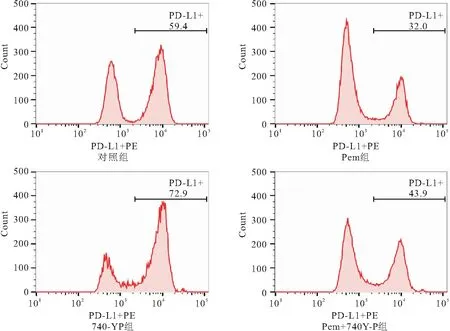
图7 各组HCC827细胞表面PD-L1的表达
3 讨论
目前认为,化疗可以通过诱导肿瘤细胞的免疫原性死亡(ICD)、提高肿瘤抗原性、阻断免疫抑制途径、增强效应T细胞反应等途径来调节肿瘤免疫功能,从而改变免疫抑制肿瘤的微环境,增强免疫细胞的细胞毒性[6]。Pem是非小细胞肺癌的一线标准治疗药物,先前的研究表明,单独使用培美曲塞或与其他化疗药物联合使用可延长非小细胞肺癌患者的总体生存期[7]。目前KEYNOTE-Ⅲ期临床实验结果分析,帕博利珠单抗联合Pem及铂类治疗已成为转移性NSCLC的标准治疗选择之一,免疫疗法联合化疗后,患者的总生存率、无进展生存期及客观缓解率均得到了显著的提高。
最近的研究表明,肿瘤细胞以几种方式“编辑宿主”免疫,以逃避肿瘤微环境中的免疫防御,这种现象被称为“癌症免疫逃逸”。该系统中最重要的组成部分之一是由PD-1及其受体PD-L1介导的免疫抑制共信号[8]。研究证明, PD-L1在多种恶性肿瘤中发挥重要作用,可以减弱宿主对肿瘤细胞的免疫反应,其高表达与免疫逃逸相关[9]。PD-L1高表达最终可促进T细胞凋亡、无能和功能衰竭,从而使癌细胞逃脱T细胞的免疫监视[10-11]。在胃癌中,PD-L1高表达患者的预后明显比PD-L1低表达或缺乏表达的患者差[12]。Que Y 等[13]研究结果表明,过度表达PD-L1的软组织肉瘤细胞, 与肿瘤分期晚、侵袭性强、预后不良相关,在肝细胞癌[14]、肺癌[15]等恶性癌症中均有相似报道。同时有研究证实,肿瘤细胞高表达的PD-L1与T细胞表达的PD-1结合,导致PD-1/PD-L1通路处于持续激活状态进而抑制T细胞的功能[16],阻断PD-1和PD-L1之间的相互作用可增强T细胞反应并介导抗肿瘤活性[17-18],以上结果表明,降低PD-L1的表达水平,可改善肿瘤微环境中的免疫抑制状态。在本实验中,发现Pem可下调PD-L1表达的水平,提示Pem抗肿瘤作用可能与下调PD-L1表达进而解除机体免疫抑制相关,通过Pem降低PD-L1的表达,进一步减少与PD-1的结合,这可能是Pem联合PD-1抑制剂治疗NSCLC的作用机制之一。
PI3K/AKT信号通路是人体主要的信号通路之一,该通路作为原癌基因发挥作用,有调节癌细胞存活及致癌转化的可能机制,包括刺激增殖、生存、侵袭/转移等不同生物功能,在包括肺癌在内的各种癌症中经常被激活[19],该信号通路不仅可通过刺激细胞增殖及降低细胞凋亡促进肿瘤的发展,同时可上调PD-L1的表达从而介导免疫逃逸[20]。Bo Li等[21]研究表明,Pem可以通过抑制PI3K/AKT信号通路和在蛋白和转录水平上调促凋亡因子而抑制肺癌细胞的增殖。Gao Y[22]、Zhang X等[23]研究发现抑制 PI3K 激酶以及下游的信号分子AKT 可以下调 PD- L1 的表达以及增强细胞毒 T 细胞杀伤肿瘤细胞的功能。以上研究提示,PD-L1可能是PI3K/AKT信号通路的作用靶点之一,Pem可能通过PI3K/AKT来调节PD-L1的表达。本研究结果显示,Pem可使HCC827细胞PD-L1表达下降,使用740-YP激活该信号通路传导途径,可逆转Pem引起的PD-L1表达下降。实验结果表明,Pem可通过PI3K/AKT信号通路来调节PD-L1在肿瘤细胞的表达,与上述研究结果一致。
4 结论
Pem抑制人肺腺癌HCC827细胞的增殖,其机制可能与抑制PI3K/AKT通路激活,使PD-L1表达下调,减少与PD-1受体相互作用,降低因两者结合引起的T细胞程序性死亡,从而恢复肿瘤细胞对机体的免疫应答相关,同时Pem通过促进PD-L1表达减低,在肿瘤微环境中可为PD-1免疫检查点抑制剂的疗效创造有利条件,进一步提高治疗效果。本实验不足之处只在细胞水平上进行了研究,未来会进一步收集临床血液样本,为化疗药物对免疫的影响进行更深入的研究。
