益气活血方改善血糖波动型GK 大鼠肾损伤的机制
2021-09-27方文明胡张捷戴灵豪王慧铭
方文明,胡张捷,戴灵豪,刘 艺,王慧铭,王 辉
(浙江中医药大学,浙江 杭州 310053)
糖尿病肾病(diabetic nephropathy,DN)是临床上最常见的糖尿病微血管并发症之一,主要病理特征是肾小球肥大、肾小球和肾小管基底膜增厚、系膜区细胞外基质的进行性积累,后期造成肾小球、肾小管间质纤维化[1⁃2],肾小管上皮细胞转分化(tubular epithelial to mesenchymal transdifferentiation,TEMT)是肾间质纤维化的重要机制之一,TGF⁃β/Smad 信号通路起了重要作用。在高糖状态下,肾小管上皮细胞中TGF⁃β/Smad 信号通路激活可增加miR⁃21 的表达[3],后者通过结合于靶mRNA 的3’UTR 端抑制张力蛋白同源的磷酸酯酶基因(phosphatase and tensin homolog,PTEN)的表达,进一步刺激PI3K/Akt 通路从而激活下游激酶引起肾间质肥大、细胞外基质(ECM)异常沉积和足细胞凋亡[4],表 明TGF⁃β1/miR⁃21/PTEN/PI3K/Akt 信号通路与DN 发生和发展密切相关。
中医将糖尿病归属“消渴病”范畴,气虚血瘀是其基本病机[5],中药复方具有多靶点、多途径的特点,在防治DN 方面具有独特的优势,临床常用益气活血法治疗[6]。课题组前期证实,益气活血方能有效改善DN[7],本实验在此基础上考察该方是否通过调控TGF⁃β1/miR⁃21/PTEN/Akt 信号通路来改善血糖波动型GK 大鼠肾损伤,以期为其进一步开发利用提供依据。
1 材料
1.1 动物 SPF 级雄性Wistar 大鼠,6 只,体质量(250±20)g;SPF 级雄性自发性糖尿病大鼠,42 只,体质量(250±20)g(GK 大鼠),均购自上海上海斯莱克实验动物有限公司,实验动物生产许可证号SCXK(沪)2017⁃0005,饲养于浙江中医药大学动物实验研究中心屏障系统内,实验动物使用许可证号SYXK(浙)2018⁃0012。
1.2 药物 门冬胰岛素注射液(批号KVGY963⁃1,丹麦诺和诺德公司);缬沙坦(批号H20170166,瑞士诺华制药有限公司)均购自浙江省中医院;25%葡萄糖注射液(批号20190808,德州京信药业有限公司)。黄芪、川芎、葛根、生地黄、天花粉(批 号190402、190601、190602、190402、190601,产地甘肃、四川、安徽、河南、浙江,浙江中医药大学中药饮片公司),经专家鉴定为正品。
1.3 仪器 血糖仪(罗氏血糖健康医护公司);糖化血红蛋白检测仪(无锡博慧斯生物医药科技有限公司);低温高速离心机(美国Beckman,型号Allegra X⁃30R);全自动血液生化分析仪(日本日立株式会所,型号7020);包埋机(常州市雅博电子设备有限公司,型号YaBo 400);切片机(型号RM2245)、倒置显微镜(型号DMI3000B)(德国Leica 公司);A1CEZ2.0 糖化血红蛋白检测仪(江苏省无锡市博慧斯生物医药科技有限公司);酶标仪(美国Thermo Scientific 公司,型号Multiskan MK3);SDS⁃PAGE 电泳系统(美国Bio⁃Rad 公司);化学发光仪(美国Bio⁃Rad 公司,型号ChemiDoc XRS+)。
1.4 试剂 血糖试纸(批号478811,罗氏血糖健康医护公司);糖化血红蛋白检测卡(批号020431,EKF⁃diagnostic GmbH);miRNA 第一链cDNA 合成(茎环法)、miRNA 荧光定量PCR 试剂盒(染料法)、Trizol Reagent(批号B511311)(生工生物工程股份有限公司);BCA 蛋白定量试剂盒(批 号 L23J11G119324)、RIPA 裂解液(批 号L23J11G119326)、SDS⁃PAGE 凝胶配制试剂盒(批号L23J11G119323)(上海源叶生物科技有限公司);β⁃actin [批号8115914,博格隆(上海)生物技术有限公司];TGF⁃β1 兔单克隆抗体、PTEN兔单克 隆抗体、goat anti⁃rat IgG⁃HRP(批 号GR3252552⁃5、GR217474⁃9、GR3299244⁃2,英国Abcam 公司);P⁃Akt(Ser473)兔单克隆抗体(批号25,美国CST 公司);肌酐试剂盒、尿酸试剂盒、尿蛋白试剂盒、尿素氮试剂盒、总胆固醇试剂盒、甘油三酯试剂盒(批号20190821、20190821、20190821、20190810、20190810、20190821,南京建成生物工程研究所)。
2 方法
2.1 益气活血方制备 益气活血方组方药材生黄芪24 g、川芎6 g、生地黄12 g、葛根12 g、天花粉6 g,大烧瓶中浸泡4 h(使水面高过药物3 cm),第1 次10 倍量水回流提取2 h,第2 次8 倍量水回流提取1.5 h,滤过,合并滤液,减压浓缩至1 g/mL,置于4 ℃冰箱中保存备用。
2.2 造模与分组 以Wistar 大鼠为正常组。GK大鼠适应性喂养后选取空腹血糖9.0 mmol/L 以上者造模,每天8:00、14:00 腹腔注射250 g/L 葡萄糖溶液0.375 mL/kg,8:30、14:30 皮下注射门冬胰岛素注射液,每只1 U,造成1 d 中血糖值大幅度波动,连续6 周,于第3、6 周末测定9 个时间点(8:00、8:30、10:00、12:00、14:00、14:30、16:00、18:00、20:00)血糖波动情况。将造模大鼠随机分为模型组、缬沙坦组、益气活血方组,益气活血方剂量根据临床用量进行换算为每天8.3 g/kg,缬沙坦剂量为每天30 mg/kg,正常组、模型组大鼠以同容量生理盐水灌胃,连续8 周。
2.3 指标检测
2.3.1 一般体征 每天观察并记录大鼠活动、精神状态、毛发、排尿等情况。
2.3.2 体质量 每周称量并记录1 次大鼠体质量。
2.3.3 血糖波动监测、给药后空腹血糖及糖化血红蛋白于当天8:00、8:30、10:00、12:00、14:00、14:30、16:00、18:00、20:00 测定并记录血糖,绘制其波动趋势图。给药后每周1 次对大鼠采用尾尖点刺出血法采血,血糖仪测定空腹血糖,第4、8 周末颌下静脉采血,检测糖化血红蛋白。
2.3.4 生化指标 给药8 周后,大鼠代谢笼收集尿液,3 500 r/min 离心15 min,留取上清液,测定尿肌酐、尿蛋白,计算24 h 尿蛋白排泄率,颌下静脉取血,4 ℃下3 500 r/min 离心15 min,取血清,采用全自动血液生化分析仪检测血清尿素氮、尿酸、总胆固醇、甘油三酯水平。
2.3.5 肾脏指数 大鼠麻醉后迅速剖检取双侧肾脏,生理盐水洗涤血液并用干纸吸取水分,称定质量,计算肾脏指数,公式为肾脏指数=肾脏质量/体质量。
2.3.6 PAS、HE 染色 将大鼠单侧肾用多聚甲醛固定,乙醇脱水后石蜡包埋切片,PAS、HE 染色,在光镜下观察肾脏组织病理变化。
2.3.7 大鼠肾脏组织miR⁃21 水平 采用TRIzol 两步法抽提大鼠肾脏组织总RNA,按照逆转录试剂盒说明书进行逆转录操作,SYBR Green 法检测miR⁃21 水平,以U6 为内参(反应条件为95 ℃,10 min,95 ℃20 s,62 ℃30 s,72 ℃30 s,共循环40 次),2-△△Ct法计算表达量。miR⁃21 正向5′⁃GCGCGTAGCTTATCAGACTGA⁃3′,反 向 5′⁃AGTG CAGGGTCCGAGGTATT⁃3′;U6 正 向5′⁃TACAGAG AAGATTAGCATGGCCCT⁃3′,反向5′⁃AGTGCAGGG TCCGAGGTATT⁃3′。
2.3.8 大鼠肾脏组织TGF⁃β1、PTEN、P⁃Akt 蛋白表达 用高温消毒剪刀剪取部分大鼠肾脏组织,将其粉碎并置于玻璃匀浆器中,加入适量裂解液,冰上研磨裂解30 min,12 000×g、4 ℃离心5 min,取上清液,转移于预冷的离心管中,BCA 法测定蛋白浓度后加上样缓冲液煮沸变性,配制8%分离胶、5%浓缩胶,每孔上样量20 μg,进行电泳、转膜后TBST 洗膜3 次,5%脱脂奶粉封闭2 h,TBST洗膜3 次,孵育一抗,4 ℃摇床孵育过夜,TBST洗膜3 次,二抗室温孵育2 h,TBST 洗膜3 次,化学发光法显影,以目的蛋白与内参蛋白灰度值的比值表示蛋白的相对表达量。
2.4 统计学分析 通过SPSS 20.0 软件进行处理,计量资料以()表示,组间比较采用单因素方差分析,方差齐者采用最小显著性差异法(LSD)检验,方差不齐者采用Tamhane’s T2(M)法检验。以P<0.05 为差异具有统计学意义。
3 结果
3.1 一般体征 正常组大鼠反应敏捷,精神活跃,毛发柔顺且有光;模型组大鼠较为暴躁,毛发杂乱;缬沙坦组、益气活血方组大鼠均有一定程度的改善,毛发柔顺,精神活跃。
3.2 体质量 如图1 所示,正常组大鼠体质量持续增长,速度快于其他各组。从第12 周开始,与模型组比较,缬沙坦组、益气活血方组大鼠体质量升高(P<0.01),但2 组之间无显著差异(P>0.05)。

图1 各组大鼠体质量Fig.1 Body weights of rats in various groups
3.3 血糖波动、空腹血糖、糖化血红蛋白
3.3.1 血糖波动情况 如图2 所示,Wistar 大鼠血糖水平在同一天内均处于正常范围;血糖波动型GK 大鼠在注射葡萄糖30 min 后血糖达到峰值,若注射胰岛素则在150 min 内降至最低值,14:00 时基本恢复到正常水平,再注射葡萄糖、胰岛素后20:00 时亦然,同一天内形成2 次血糖高峰与低谷,而且在造模第6 周时注射胰岛素后血糖值高于第3 周时,表明其胰岛素抵抗更严重。

图2 大鼠血糖波动情况Fig.2 Blood glucose fluctuation conditions of rats
3.3.2 空腹血糖 如图3 所示,给药第6 周时,与模型组比较,益气活血方组大鼠空腹血糖水平降低(P<0.01)。
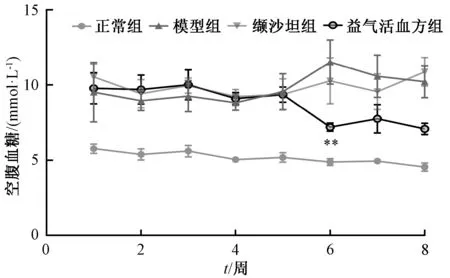
图3 各组大鼠空腹血糖水平Fig.3 FBG levels in rats in various groups
3.3.3 糖化血红蛋白 如图4 所示,与正常组比较,模型组糖化血红蛋白水平升高(P<0.01);给药第4 周时,与模型组比较,益气活血方组、缬沙坦组糖化血红蛋白水平无明显变化(P>0.05);在给药第8 周时,益气活血方组糖化血红蛋白水平降低(P<0.01)。
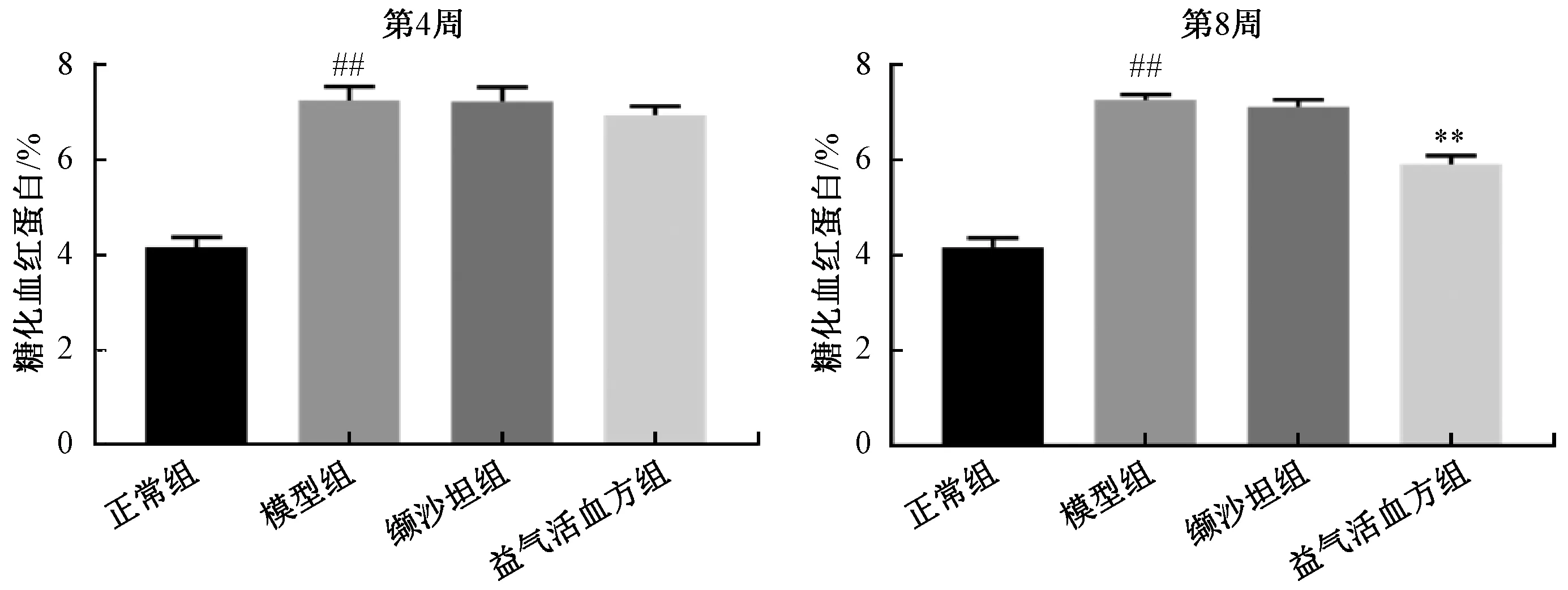
图4 各组大鼠糖化血红蛋白水平Fig.4 Glycosylated hemoglobin levels in rats in various groups
3.4 生化指标
3.4.1 尿肌酐、24 h 尿蛋白排泄率 如图5 所示,与正常组比较,模型组大鼠尿肌酐水平、24 h 尿蛋白排泄率升高(P<0.01);与模型组比较,缬沙坦组、益气活血方组大鼠尿肌酐水平、24 h 尿蛋白排泄率降低(P<0.01)。

图5 各组大鼠尿肌酐水平、24 h 尿蛋白排泄率Fig.5 Urinary creatinine levels and 24 h urinary protein excretion rates in rats in various groups
3.4.2 血清尿素氮、尿酸、总胆固醇、甘油三酯 由表1 可知,与正常组比较,模型组大鼠血清尿素氮、尿酸、总胆固醇、甘油三酯水平升高(P<0.01);与模型组比较,缬沙坦组、益气活血方组血清尿素氮、尿酸、总胆固醇、甘油三酯水平降低(P<0.01)。
表1 各组大鼠血清尿素氮、尿酸、总胆固醇、甘油三酯水平(, n=6)Tab.1 Serum urea nitrogen,uric acid,total cholesterol and triglyceride levels in rats in various groups(, n=6)

表1 各组大鼠血清尿素氮、尿酸、总胆固醇、甘油三酯水平(, n=6)Tab.1 Serum urea nitrogen,uric acid,total cholesterol and triglyceride levels in rats in various groups(, n=6)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01。
3.5 肾脏指数 如图6 所示,与正常组比较,模型组大鼠肾脏指数升高(P<0.01);与模型组比较,缬沙坦组、益气活血方组大鼠肾脏指数降低(P<0.01)。

图6 各组大鼠肾脏指数Fig.6 Renal indices of rats in various groups
3.6 肾脏组织PAS、HE 染色 如图7~8 所示,正常组大鼠肾脏组织结构清晰完整,形状规则;模型组大鼠肾小球萎缩,基底膜增厚,细胞外基质积聚,系膜扩张,细胞形态改变;与模型组比较,缬沙坦组、益气活血方组大鼠肾脏组织病理改变程度均有所改善。
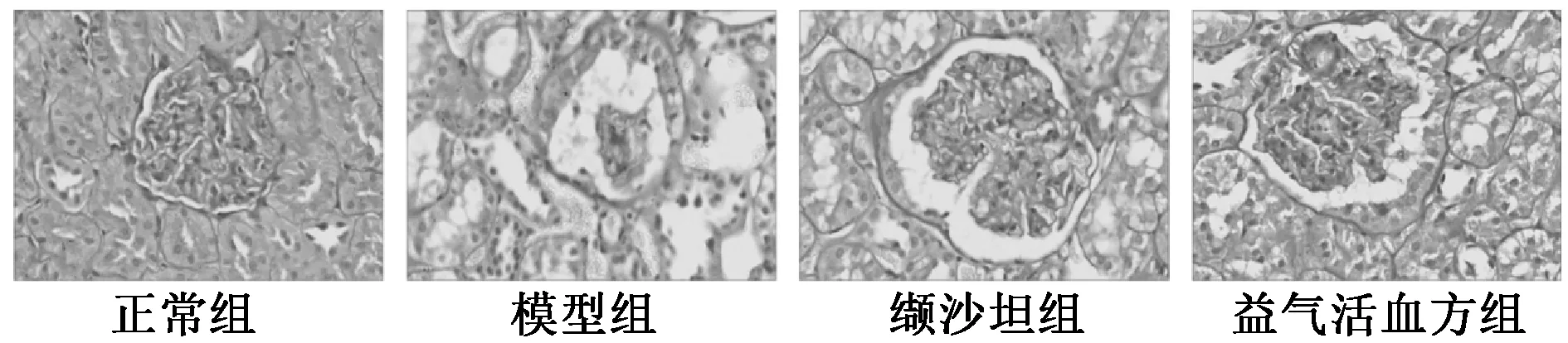
图7 各组大鼠肾脏切片PAS 染色(×400)Fig.7 PAS staining of renal sections of rats in various groups(×400)
3.7 肾脏组织miR⁃21 表达 如图9 所示,与正常组比较,模型组大鼠miR⁃21 表达升高(P<0.01);与模型组比较,缬沙坦组、益气活血方组大鼠miR⁃21 表达降低(P<0.01),以缬沙坦组更优。
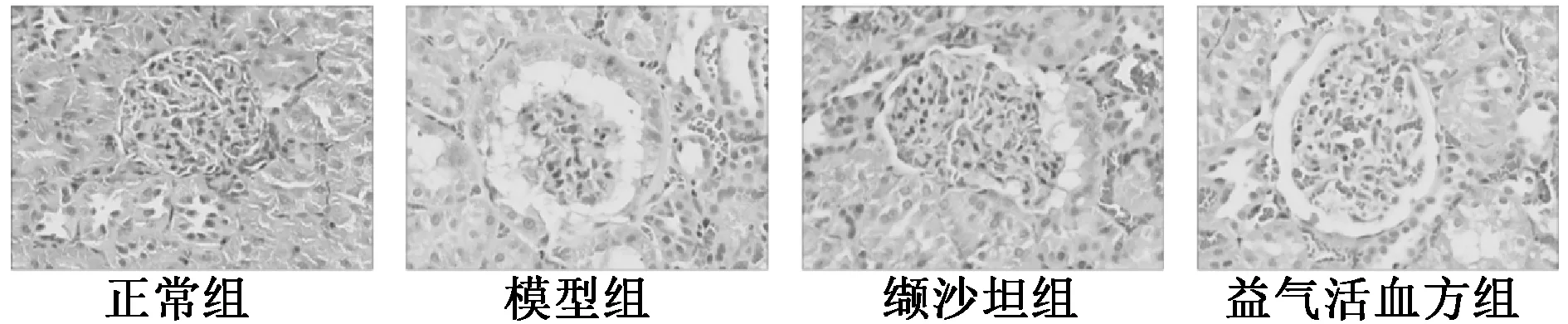
图8 各组大鼠肾脏切片HE 染色(×400)Fig.8 HE staining of renal sections of rats in various groups(×400)
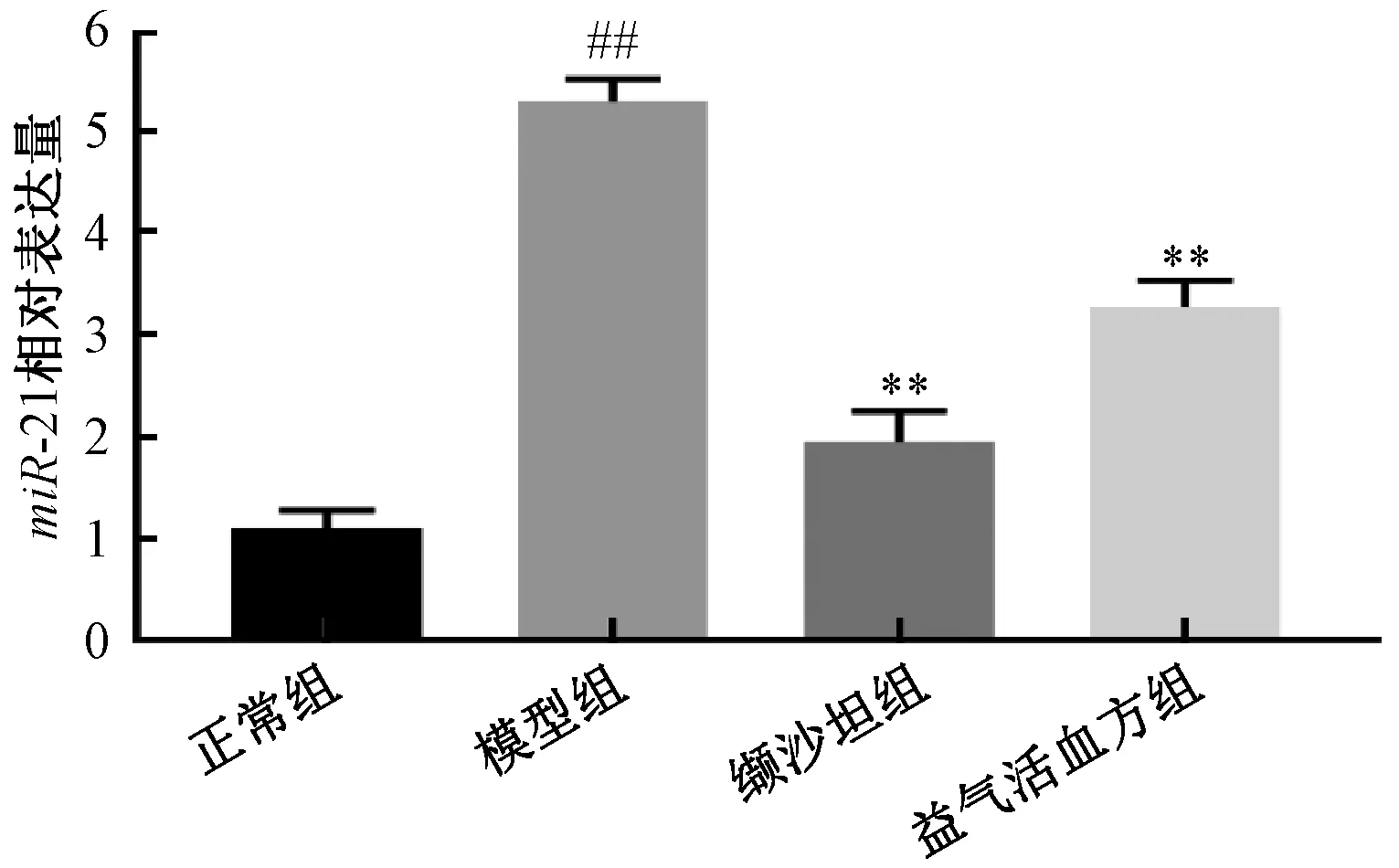
图9 各组大鼠肾脏组织中miR⁃21 表达Fig.9 Expressions of miR⁃21 in renal tissues of rats in various groups
3.8 TGF⁃β1、PTEN、P⁃Akt 蛋白表达 如图10所示,与正常组比较,模型组大鼠TGF⁃β1、P⁃Akt表达升高(P<0.01),PTEN 表 达降低(P<0.01);与模型组比较,缬沙坦组、益气活血方组大鼠TGF⁃β1、P⁃Akt 表达降低(P<0.01),PTEN表达升高(P<0.01)。
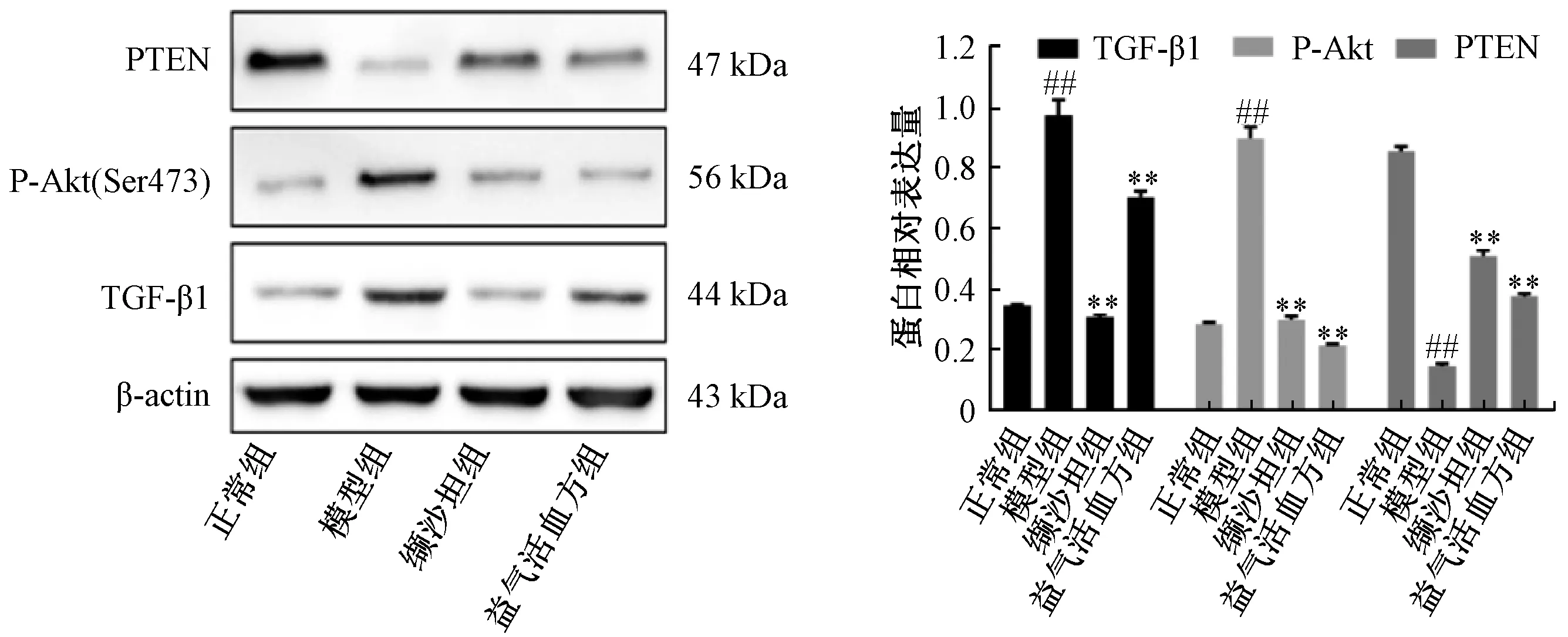
图10 各组大鼠肾脏组织TGF⁃β1、PTEN、P⁃Akt 表达Fig.10 Expressions of TGF⁃β1,PTEN and p⁃Akt in renal tissues of rats in various groups
4 讨论
DN 是糖尿病微血管并发症之一,发病机制复杂,近年来,DN 发病率逐年上升,逐渐成为终末期肾病(ESRD)和肾功能衰竭的首要诱因(约占35%)[8],严重威胁人类健康。而血糖波动是引起糖尿病并发症的关键因素,近年研究表明波动性血糖对患者并发症和死亡率的影响远大于稳定性高血糖,且波动越大,并发症发生率越高、预后越差[9⁃11]。前期研究结果表明血糖波动可以加重GK大鼠的肾脏病变[12],本课题组研究证实益气活血方能改善大鼠的肾脏病变,本实验在前期研究基础上探究益 气活血 方是否通过TGF⁃β1/miR⁃21/PTEN/Akt 信号通路保护血糖波动型GK 大鼠肾脏损伤,结果表明给药8 周后可以改善糖尿病大鼠的症状,降低空腹血糖、尿肌酐、24 h 尿蛋白排泄率、尿素氮、尿酸、总胆固醇、甘油三酯及肾脏指数,从病理切片结果说明益气活血方可以改善肾小球损伤及基底膜增厚等病理变化。
TGF⁃β1 是一种多效性的细胞因子,具有强大的调节功能。TGF⁃β1 信号通路在DN 中被激活,TGF⁃β1 的抑制可减轻糖尿病动物模型中的肾纤维化。TGF⁃β1 促进纤维化的机制是多因素的,包括促进ECM 过度表达、减少ECM 降解、增强胶原和弹性蛋白纤维之间的交联以及过度激活近端小管和内皮细胞分化[13⁃15]。实验结果表明益气活血方可以降低TGF⁃β1 的表达量,这可能是其改善肾脏损伤的作用机制。microRNA 是基因组的有力调节剂,整体表达谱分析显示miR⁃21 是与糖尿病肾病中相关性最高的microRNA 之一[16]。miR⁃21 在正常肾组织中很少表达,却在人类及动物的急性及慢性肾病模型中高表达,尤其在糖尿病大鼠模型的肾小球及肾小管间质组织中呈明显上调趋势,在缺血/再灌注的肾组织中表达丰度也显著升高[17⁃18]。有研究表明TGF⁃β1 诱导的系膜细胞miR⁃21 的表达量显著升高[19],本研究也证实模型组大鼠miR⁃21 的表达量升高,通过益气活血方干预后可以降低miR⁃21 表达。
有研究表明沉默miR⁃21 可提高PTEN 的蛋白表达,足细胞中PTEN 的下调会导致肌动蛋白动力学失调,从而促进足突消失和蛋白尿,PTEN 功能降低导致PI3K/Akt 过度激活,PI3K/Akt 信号通路的异常激活可触发了下游相关的各种酶和转录因子。PI3K/Akt 信号通路的激活间接导致α⁃平滑肌肌动蛋白和胶原蛋白Ⅳ的增多,并促进DN 的进展[20⁃22]。本项研究表明益气活血方可以升高PTEN的表达并且降低P⁃Akt 的表达。
综上所述,益气活血方可以保护血糖波动型GK 大鼠的肾脏组织,延缓疾病发展进程,这可能与其通过TGF⁃β1/miR⁃21/PTEN/Akt 信号通路调节有关。本研究为益气活血方进一步在临床上的应用提供实验基础和理论支持,同时也为糖尿病肾病提供了新的治疗策略。
