贞芪扶正颗粒辅助奥沙利铂治疗H22 移植瘤小鼠的疗效及其对Bax、Bcl⁃2 表达的影响
2021-09-27周熙祥伍志伟张录梅金华刘永琦娜颜春鲁孙文平
周熙祥伍志伟*张录梅金 华刘永琦 薛 娜颜春鲁孙文平
(1.甘肃中医药大学,甘肃 兰州730000; 2.甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,甘肃 兰州730000; 3.敦煌医学与转化省部共建教育部重点实验室,甘肃 兰州730000; 4.甘肃省肿瘤医院腹外二科,甘肃 兰州 730000)
肝癌是临床常见的恶性肿瘤之一,其死亡率位居世界癌症死亡率的第4 位,在男性癌症死亡率中位居第2 位,肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中的主要亚型,约占75%~85%[1]。目前,肝癌的临床治疗多采用外科切除和放化疗措施,但外科切除常因多发灶及转移的发生导致HCC 患者的死亡率较高,放化疗后可出现中性粒减少、贫血、腹泻、手足皮肤反应等不良症状,从而导致患者的生存质量降低[2⁃3]。
奥沙利铂(L⁃OHP)为一类具有体外细胞毒性和体内抗肿瘤活性的广谱抗癌药物,但在临床治疗过程中产生的多种不良反应严重制约了其应用。已有研究表明,中医药辨证施治、扶正祛邪、阴平阳秘等整体理念与西医的局部治疗理论互补,在增强西药疗效、降低毒副作用、提高机体免疫力等方面有独特的优势[4⁃6]。因此,中西医联合治疗肝癌或许能达到优势互补和标本兼治的效果,对提升患者的生存率和改善生存质量有重要意义。本实验选用贞芪扶正颗粒与奥沙利铂联合,经常规观察、瘤体检测、病理检查等方法进行疗效分析,全自动蛋白电泳和qPCR 检测Bax、Bcl⁃2 肿瘤相关分子,这将为揭示联合用药治疗肝癌的分子机制、拓展该中成药的临床应用提供理论依据。
1 材料与方法
1.1 试剂与药物 贞芪扶正颗粒(甘肃扶正药业科技股份有限公司,批号K20180536);注射用奥沙利铂(齐鲁制 药有限公司,批 号2A2E16120138);Bcl⁃2 鼠源性一抗(美国Imuno Way 公司,批号B4101);Bax 兔源性一抗(美国GeneTex 公司,批号39988);GAPDH 兔源性一抗(美国GeneTex 公司,批号42977);EZ Standard PACK 1(美国Proteinsimple 公司,批号88335);Anti⁃Rabbit Detection Module(美国proteinsimple 公司,批号17404);Jes/Wes Separation 12⁃230kDa(美国proteinsimple 公司,批号20933);Jess/Wes Separation 12⁃230kDa(美国proteinsimple 公司,批号20933);10× Sample Buffer(美国proteinsimple公司,批号 86719);Wash Buffer(美国proteinsimple 公司,批号86532);Real Time qPCR试剂盒(日本TaKaRa 公司,批号AI82513A);TRIzol(美国 ambion 公司,批号175702);Nuclease⁃Free Water(美国Promega 公司,批号0000070302);反转录试剂盒(美国Promega 公司,批号0000366052)。
1.2 仪器 BX61 光学显微镜(日本Olympus 公司);1⁃14K 高速低温冷冻离心机(德国Sigma 公司);DW⁃86L626 超低温冰箱(青岛海尔电器有限公司);CP214 精密电子天平(美国奥豪斯仪器有限公司);WS⁃2932 proteinsimple Wes(美国Santa Clara 公司);S1000TM 逆转录仪、BIOMATE 3S 核酸蛋白测定仪、iMARK 酶标仪(美国Bio⁃Rad 公司);EG1150 石蜡包埋机、CM3050 组织切片机(德国Leica 公司)。
1.3 细胞 H22肝癌细胞株,由甘肃中医药大学甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室惠赠。
1.4 动物 SPF 级KM 雄性小鼠72 只,体质量(20±2)g,购自甘肃中医药大学科研动物实验中心,实验动物生产许可证号SCXK(甘)2015⁃0002,实验动物使用许可证号SYXK(甘)2015⁃0005,饲养于相对湿度45%~55%,温度21~25 ℃的环境中,以标准鼠饲料及无菌水饲养。
1.5 方法
1.5.1 模型构建 参照文献[7] 报道,将体外增殖的H22肝癌细胞以无菌PBS 稀释至1×105/mL,取200 μL 经腹腔注射接种于小鼠体内;驯化培养后抽取腹水细胞,无菌生理盐水稀释至2×106/mL;抽取细胞悬液100 μL,采用皮下注射法接种于小鼠前肢右侧腋下。
1.5.2 分组与给药 72 只SPF 级KM 种小鼠在动物实验室适应性饲养3 d 后,随机分为空白组、模型组、奥沙利铂组、奥沙利铂+贞芪扶正颗粒高剂量组、奥沙利铂+贞芪扶正颗粒中剂量组、奥沙利铂+贞芪扶正颗粒低剂量组。除空白组外,其余各组按“1.5.1”项下方法建立H22移植瘤小鼠模型。待瘤体达到100~300 mm3(植瘤第3 天)后开始给药。取贞芪扶正颗粒溶于无菌水中,奥沙利铂冻干粉溶于葡萄糖水注射液中,空白组正常饲养,模型组以0.1 mL/10 g 无菌水灌胃(1 次/d),并以0.1 mL/10 g 葡萄糖注射液腹腔注射(1 次/2 d),奥沙利铂组和奥沙利铂+贞芪扶正颗粒高、中、低剂量组以10 mg/kg 腹腔注射奥沙利铂(1 次/2 d),奥沙利铂+贞芪扶正颗粒高、中、低剂量组同时分别以0.026、0.013、0.007 g/kg 贞芪扶正颗粒溶液灌胃(1 次/d)。
1.5.3 体质量测定 造模完成后,于给药前及给药后5、10 d 固定时间段内,分别称取小鼠体质量,计算其变化。
1.5.4 瘤体测量、抑瘤率测定 游标卡尺测量给药前及给药后5、10 d 各组小鼠瘤体长径a(mm)和短径b(mm),以公式V=ab2/2 计算肿瘤体积(V)。末次给药24 h 后处死小鼠,剥离瘤体组织,称重并计算药物抑瘤率,公式为抑瘤率= [(对照组平均瘤质量-治疗组平均瘤质量)/对照组平均瘤质量] ×100%。
1.5.5 脾脏质量及指数测定 末次给药24 h 后处死小鼠,剥离脾脏组织,生理盐水漂洗、称重,计算脾脏指数,公式为脾脏指数=脾脏质量/小鼠体质量。
1.5.6 瘤体Bcl⁃2、Bax 免疫组化分析 石蜡切片经脱蜡与水化、内源性过氧化物酶清除、抗原修复、一抗与二抗孵育、DAB 显色等过程后,具体参照文献[8],置于200 倍光镜下检测,以细胞核或细胞质中出现黄褐色者为阳性。
1.5.7 瘤体Bcl⁃2、BaxmRNA 表达检测 称取0.1 g 瘤体组织,应用TRIzol 法提取RNA,微量分光光度法检测RNA 含量与纯度,qPCR 法检测瘤体组织中Bcl⁃2、BaxmRNA 表达,具体操作参照日本 TaKaRa公司qPCR 试剂盒说明书。以GAPDH 为内参,采用2—△△Ct法计算Bcl⁃2 和Bax基因mRNA 的相对水平,每组设4 个重复,6 个平行实验。引物由杭州科宝生物科技有限公司合成,序列见表1。
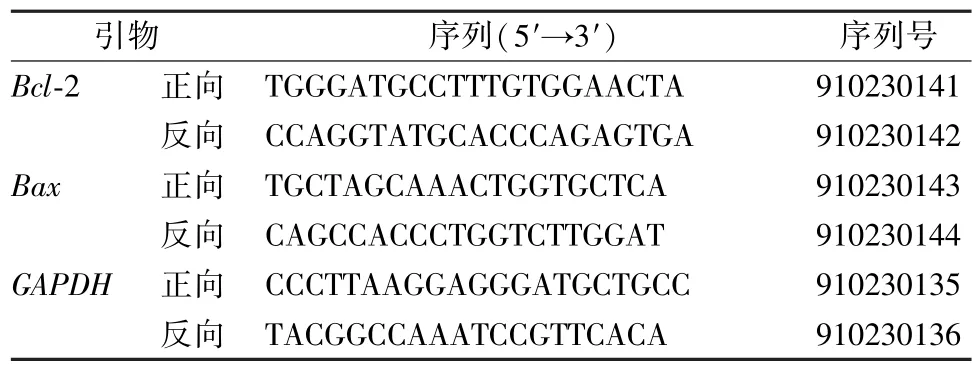
表1 PCR 引物序列Tab.1 PCR primer sequences
1.5.8 瘤体Bcl⁃2、Bax 蛋白表达检测 称取瘤体组织0.1 g,剪碎,加入组织裂解液,匀浆,4 ℃静置15 min,每5 min 涡旋振荡30 s,离心后取上清分装,BCA 法测定蛋白浓度,具体操作参照BCA 试剂盒说明书。Wes 全自动蛋白分析系统检测瘤体组织中Bcl⁃2、Bax 蛋白表达,具体操作参照试剂盒说明书;以GAPDH 为内参,应用Image J软件测算灰度值,对比分析瘤体组织中Bcl⁃2 和Bax 蛋白的相对表达。
1.5.9 统计学分析 通过SPSS 18.0 软件进行处理,计量资料以()表示,2 组间比较采用独立样本t检验,多组间两两比较采用One way ANOVA 中的LSD 法。P<0.05 表示差异有统计学意义。
2 结果
2.1 体质量 给药后5、10 d,模型组小鼠体质量增速明显高于奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组(P<0.05),5 d 增幅大于10 d;空白组较模型组增重缓慢(P>0.05);奥沙利铂组与奥沙利铂+贞芪扶正颗粒低剂量组间及奥沙利铂+贞芪扶正颗粒高剂量组与奥沙利铂+贞芪扶正颗粒中剂量组间体质量增幅无明显变化(P>0.05),见表2。
表2 各组小鼠体质量(, n=12)Tab.2 Body weights of mice in various groups(, n=12)

表2 各组小鼠体质量(, n=12)Tab.2 Body weights of mice in various groups(, n=12)
注:与空白组比较,△P<0.05;与模型组比较,*P<0.05。
2.2 瘤体体积 给药后5 d,奥沙利铂+贞芪扶正颗粒高、中、低剂量组较模型组瘤体体积增速慢(P<0.05),与奥沙利铂组比较,奥沙利铂+贞芪扶正颗粒高剂量组体积较小(P<0.05)。给药后10 d,奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组小鼠瘤体体积明显小于模型组(P<0.05),其中奥沙利铂+贞芪扶正颗粒高剂量组小鼠瘤体体积小于奥沙利铂组(P<0.05);药物组瘤体体积依次为奥沙利铂+贞芪扶正颗粒低剂量组>奥沙利铂组>奥沙利铂+贞芪扶正颗粒中剂量组>奥沙利铂+贞芪扶正颗粒高剂量组,见表3。
表3 各组小鼠瘤体体积(, n=12)Tab.3 Tumor volume of mice in various groups(, n=12)
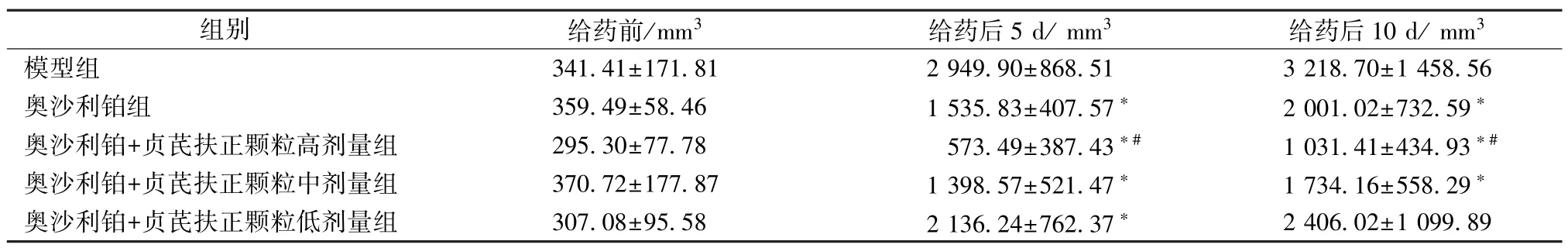
表3 各组小鼠瘤体体积(, n=12)Tab.3 Tumor volume of mice in various groups(, n=12)
注:与模型组比较,*P<0.05;与奥沙利铂组比较,#P<0.05。
2.3 瘤体质量、抑瘤率 奥沙利铂组,奥沙利铂+贞芪扶正颗粒高、中、低剂量组瘤体质量低于模型组(P<0.05);奥沙利铂组瘤体质量高于奥沙利铂+贞芪扶正颗粒高剂量组(P<0.05);奥沙利铂+贞芪扶正颗粒高、中、低剂量组抑瘤率均高于奥沙利铂组,见表4。
表4 各组小鼠瘤体质量、抑瘤率(, n=12)Tab.4 Tumor weights and tumor inhibition rates of mice in various groups(, n=12)
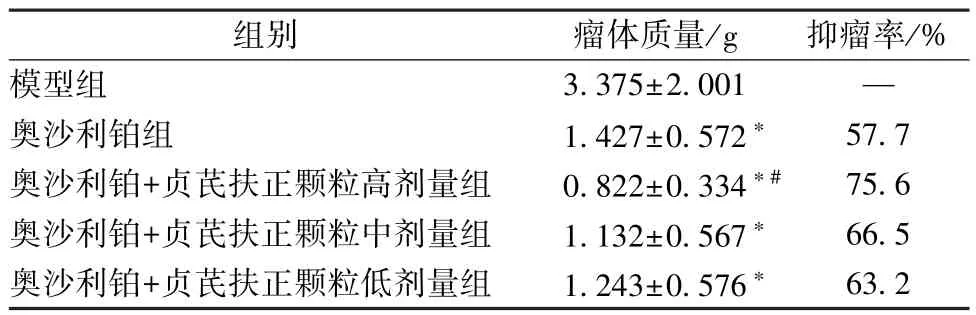
表4 各组小鼠瘤体质量、抑瘤率(, n=12)Tab.4 Tumor weights and tumor inhibition rates of mice in various groups(, n=12)
注:与模型组比较,*P<0.05;与奥沙利铂组比较,#P<0.05。
2.4 脾脏质量及指数 空白组,奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组脾脏质量和脾脏指数低于模型组(P<0.01);空白组与奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组比较,差异具有统计学意义(P<0.05);奥沙利铂组,奥沙利铂+贞芪扶正颗粒高、中、低剂量组比较,依次为奥沙利铂+贞芪扶正颗粒高剂量组>奥沙利铂+贞芪扶正颗粒中剂量组>奥沙利铂+贞芪扶正颗粒低剂量组>奥沙利铂组,但组间无明显变化(P>0.05),见表5。
表5 各组小鼠脾脏质量及指数(, n=12)Tab.5 Spleen weights and indices of mice in various groups(, n=12)

表5 各组小鼠脾脏质量及指数(, n=12)Tab.5 Spleen weights and indices of mice in various groups(, n=12)
注:与空白组比较,#P<0.05;与模型组比较,**P<0.01。
2.5 瘤体Bax、Bcl⁃2 蛋白表达 如图1~2 所示,与模型组比较,奥沙利铂组及奥沙利铂+贞芪扶正颗粒中、低剂量组均上调(P<0.05);奥沙利铂+贞芪扶正颗粒高剂量组上调极明显(P<0.01)。Bcl⁃2 在奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组瘤体组织中表达均较模型组低,其中奥沙利铂组和奥沙利铂+贞芪扶正颗粒高剂量组更明显(P<0.05)。
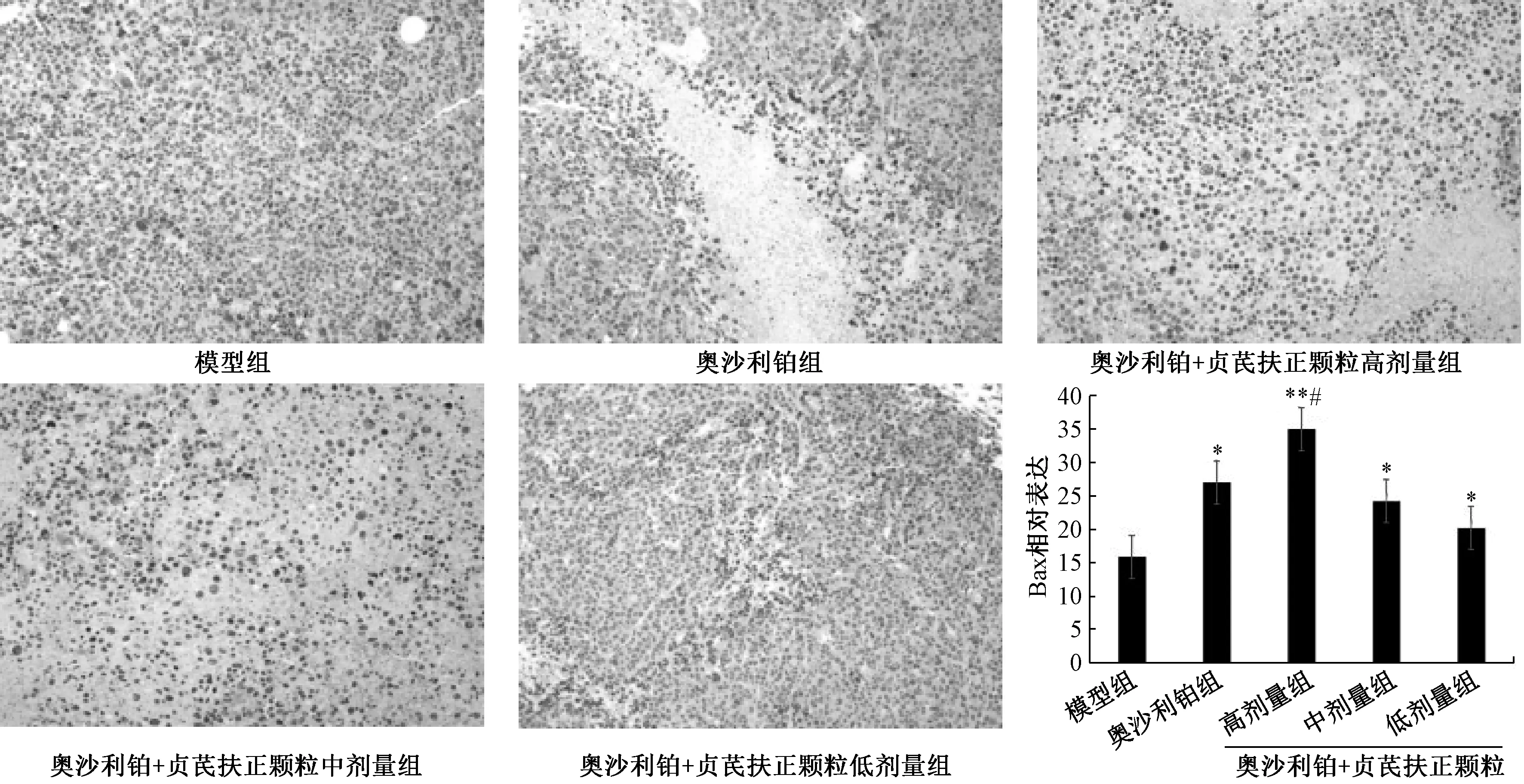
图1 各组小鼠瘤体Bax 蛋白表达(IHC,×200)Fig.1 Bax expressions in tumor tissues of mice in various groups(IHC,×200)
2.6 瘤体Bax、Bcl⁃2 mRNA 表达 与模型组比较,奥沙利铂组及奥沙利铂+贞芪扶正颗粒高、中、低剂量组瘤体组织中Bcl⁃2 mRNA 表达下降(P<0.05);与奥沙利铂组比较,奥沙利铂+贞芪扶正颗粒高、中剂量组瘤体组织Bcl⁃2 mRNA 表达降低(P<0.05),而Bax的mRNA 表达在奥沙利铂组,奥沙利铂+贞芪扶正颗粒高、中、低剂量组中升高(P<0.05),见表6。
表6 各组小鼠瘤体Bcl⁃2、 Bax mRNA 表达(, n=12)Tab.6 Bcl⁃2 and Bax mRNA expressions in tumor tissues of mice in various groups(, n=12)
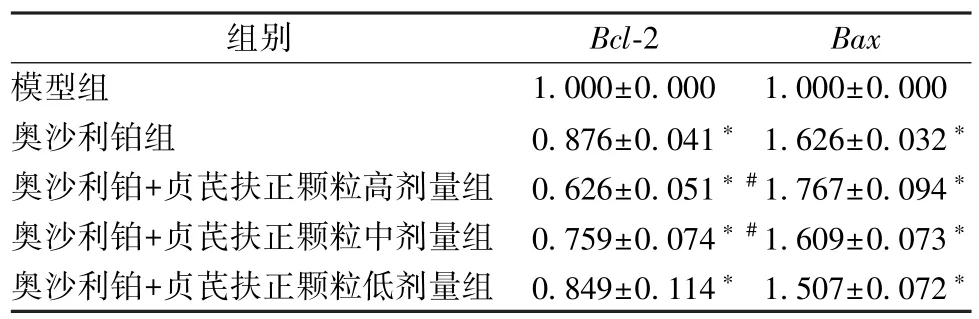
表6 各组小鼠瘤体Bcl⁃2、 Bax mRNA 表达(, n=12)Tab.6 Bcl⁃2 and Bax mRNA expressions in tumor tissues of mice in various groups(, n=12)
注:与模型组比较,*P<0.05;与奥沙利铂组比较,#P<0.05。
图2 各组小鼠瘤体Bcl⁃2 蛋白表达(IHC,×200)Fig.2 Bcl⁃2 expressions in tumor tissues of mice in various groups(IHC,×200)
2.7 瘤体Bax、Bcl⁃2 蛋白表达 与模型组比较,各治疗组瘤体组织中Bcl⁃2 蛋白表达下降(P<0.05);与奥沙利铂组比较,奥沙利铂+贞芪扶正颗粒高剂量组瘤体组织中Bcl⁃2 蛋白表达下降(P<0.05);与模型组比较,各治疗组Bax 蛋白表达升高(P<0.05);与奥沙利铂组比较,奥沙利铂+贞芪扶正颗粒高、中剂量组瘤体组织中Bax 蛋白表达升高(P<0.05),见图3,与“2.6”项下结果一致。
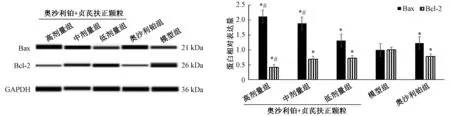
图3 各组小鼠瘤体Bcl⁃2、Bax 蛋白表达Fig.3 Bcl⁃2 and Bax protein expressions in tumor tissues of mice in various groups
3 讨论
在中医理论中,肝癌病因多样,病机复杂。根据其临床症状,可将肝癌归纳于“积聚”的范畴。积者有形,《医宗必读》 中说:“积之成者,正气不足,而后邪气距之。”其病机为脏腑正气不足,内被七情所困,外有六淫所扰,多种病因交相互结,致气滞痰凝,热毒痰蕴,进而导致阴阳失调,气血逆乱,日久成积,化成肿瘤。此说正如《内经》 中“正气存内,邪不可干,邪之所凑,其气必虚”的观点。肝脏体阴用阳,邪气耗伤肝中阴液,导致肝风化热,热炽津伤,炼液成痰,痰凝日久,积而成瘤。有现代医家提出了“阴虚癌毒”的假说[9],根据癌细胞过度异常增生的属性将癌毒归于阳亢的范畴,阴虚不能制约亢阳,轻阳壅盛,蕴久而化为癌毒。贞芪扶正颗粒由女贞子、黄芪2 味药组成,可以扶助人体正气,符合金元大家张元素的“养正积自除”的思想。女贞子最先记载于《神农本草经》,其性凉,味甘、苦,归肝、肾经,有益肝肾之阴的功效。《草本经疏》 中说:“女贞子气味俱阴”,是补阴要品。黄芪在《神农本草经》 中被列为“上品”,明代医家李时珍称其为“补药之长”。其性微温,味甘,归肺、脾经,有补气升阳,益气固表,利水消肿,脱疮生肌的功效。二药相须为用,有益气滋阴的功效。本研究以此为理论指导,选择滋阴扶正类中药——贞芪扶正颗粒与具有体外细胞毒性和体内抗肿瘤活性的奥沙利铂联合,以增强奥沙利铂的抗肿瘤活性和减少其骨髓抑制等毒副作用。通过常规观察、小鼠体质量、脾脏质量、瘤体体积、抑瘤率等相关指标分析,提示在H22肝癌模型小鼠实验中贞芪扶正颗粒具有辅助奥沙利铂增效减毒的作用。
课题组对黄芪活性成分进行了大量的研究。已有研究表明,黄芪多糖可以上调白介素IL⁃1α、IL⁃2、IL⁃6、Bax 等的表达和下调IL⁃10、Bcl⁃2 等的表达,提高脾脏指数和胸腺指数,对H22肝癌小鼠有明显的抗肿瘤作用[7];黄芪甲苷可抑制HCC 细胞的上皮⁃间质转化和迁移,下调lncRNA⁃ATB 表达使IL⁃11/STAT3 信号失活,从而诱导HCC 细胞发生凋亡[10]。现代药理研究发现,女贞子补肾阴,具有抗骨髓抑制的功效,其活性成分红景天苷、多糖、齐墩果酸等具有抗肿瘤的功能[11],其乙醇提取物通过调节Bcl⁃2、Bax、caspase⁃3(半胱氨酸天冬氨酸蛋白酶)、TIMP2(组织抑制因子)、基质金属蛋白酶MMP⁃2 及MMP⁃9 的表达来抑制细胞的迁移和侵袭,亦可通过PTEN(磷酸酶基因)的DNA 去甲基化来抑制PI3K/Akt 磷酸化,从而抑制肝癌的生长[12]。Bcl⁃2 和Bax 具有控制线粒体膜的通透性从而调控肝癌细胞凋亡的作用[13⁃14],二者功能相互对立,如同中医理论中的正气与邪气——正气存内,邪不可干,邪之所凑,其气必虚。本实验研究发现,与奥沙利铂组比较,贞芪扶正颗粒与奥沙利铂联合用药后的抑瘤效果显著,其中高剂量组抑瘤效果最为明显,提示贞芪扶正颗粒可以辅助提高奥沙利铂的疗效,且贞芪扶正颗粒的剂量越大,抑瘤效果越明显。在奥沙利铂治疗后,小鼠的体质量下降,脾脏功能也受到损伤,而贞芪扶正颗粒对小鼠的体质量、脾脏有明显保护的作用,且与给药剂量呈正相关。此外,贞芪扶正颗粒可以显著下调Bcl⁃2 的蛋白基因表达,上调Bax 的蛋白基因表达,同样与给药剂量呈正相关性,提示奥沙利铂联合贞芪扶正颗粒可能通过改善Bcl⁃2 与Bax 的表达来提升正气,从而抵抗邪气,最终达到抑制肝癌的效果。
