lncRNA SNHG3 靶向调控miR-514a-5p对骨肉瘤细胞增殖、凋亡、迁移和侵袭的影响
2021-09-27谭晓谦梅海波伍江雁
谭晓谦 梅海波 伍江雁 严 安
湖南省儿童医院骨科,湖南长沙 410007
骨肉瘤是骨肿瘤中常见的一种恶性肿瘤,具有侵袭性极高、恶性程度高、预后不良等特点,超过15%的患者在确诊时已经发现有远处转移[1-3]。骨肉瘤的治疗主要以手术切除和手术期化疗为主,其中未发生远处转移的骨肉瘤患者的5 年生存率高达70%,但是转移性和复发性骨肉瘤患者的5 年生存率低于20%[4-5]。近年研究结果显示,长链非编码RNA 在骨肉瘤中通过参与细胞分化、细胞增殖、细胞凋亡和转移等生物学过程,发挥着重要的作用[6-8]。核仁小分子RNA 宿主基因3(small nucleolar RNA host gene 3,SNHG3)位于人染色体1p35.3 位置上,在多种肿瘤中异常表达。研究发现SNHG3 在骨肉瘤组织中高表达,与不良预后显著相关;SNHG3 靶向作用miRNA-151a-3p 上调AB22A 表达促进骨肉瘤细胞的侵袭和迁移[9]。微小RNA(microRNA,miRNA)在多种肿瘤中起到抑癌或促癌的作用,miR-514a-5p 在多种癌细胞中表达下调,但miR-514a-5p 在骨肉瘤的作用机制尚不明确。因此,本研究探讨SNHG3 通过靶向调控miR-514a-5p对骨肉瘤细胞增殖、侵袭、迁移的作用,为骨肉瘤疾病的诊断、治疗提供参考。
1 材料与方法
1.1 细胞与主要试剂
成骨细胞hFOB1.19 和骨肉瘤细胞SW-1353、HOS、U-2OS、Saos-2 购于中国科学院上海细胞库;胎牛血清(9735212)、DMEM 培养基(91249142)购于美国Gibco 公司;si-NC、si-SNHG3、miR-NC、miR-514a-5p、anti-miR-NC 和anti-miR-514a-5p 购于广州瑞博生物公司;引物由上海吉玛公司设计合成;LipofectamineTM2000 转染试剂盒(10652-011)、Trizol 试剂盒(10153-023)购于美国Invitrogen 公司;荧光定量试剂盒(RR246B)、反转录试剂盒(452237152)购于大连Takara 公司;CCK-8 试剂盒(32021)购于日本同仁公司;凋亡试剂盒(C0948)购于碧云天生物研究所;c-Myc 抗体(3097T)、Bax 抗体(0265T)、MMP-2 抗体(4026T)购于美国CST 公司;Transwell 小室(3564314 13324)购于美国Corning 公司;Matrigel 基质胶(3124523)购于美国BD 公司;双荧光素酶试剂盒(D0132)购于北京索莱宝公司。
1.2 细胞培养与转染
将成骨细胞hFOB1.19 和骨肉瘤细胞SW-1353、HOS、U-2OS、Saos-2 常规复苏后,进行细胞培养,置于含10%胎牛血清的DMEM 培养基,在37℃、5%CO2中培养。细胞的密度融合至75%~85%时,加入胰蛋白酶消化。
取对数生长期的U-2OS 细胞,根据LipofectamineTM2000 转染试剂盒说明书进行转染,将其分为si-NC 组(转染si-NC)、si-SNHG3 组(转染si-SNHG3)、miR-NC 组(转染miR-NC)、miR-514a-5p 组(转染miR-514a-5p)、si-SNHG3+anti-miR-NC 组(共转染si-SNHG3和anti-miR-NC)和si-SNHG3+anti-miR-514a-5p 组(共转染si-SNHG3 和anti-miR-514a-5p)。
1.3 qRT-PCR 检测细胞中SNHG3 和miR-514a-5p表达
使用Trizol 试剂盒提取各组细胞的总RNA,在紫外分光光度计检测RNA 浓度和纯度。按照反转录试剂盒反转录合成cDNA,以cDNA 为模板,通过荧光定量试剂盒进行PCR 扩增。反应条件为95℃预变性2 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40 个循环。分别以GAPDH 和U6 为内参,通过2-△△Ct法计算SNHG3 和miR-514a-5p 的表达。SNHG3 正向引物:5’-GACTTCCGGGCACTTCGTAA-3’,反向引物:5’-TGCTCCAAGTCTGCCAAAGA-3’;GAPDH 正向引物:5’-AATGGGCAGCCGTTAGGAAA-3’,反向引物:5’-GCGCCCAATACGACCAAATC-3’。miR-514a-5p正向引物:5'-TCACTACTCTGGAGAGTGACAAT-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;U6 正向引物:5’-TGCGGGTGCTCGCTTCGGCAGC-3’,反向引物:5’-CCAGTGCAGGGTCCGAGGT-3’。
1.4 CCK-8 法检测细胞活力
离心后收集沉淀的细胞,加入磷酸盐缓冲液制备细胞悬液,接种于96 孔板中,培养48 h 后,在每孔内加入10 μL CCK-8 溶液,继续培养2 h,使用酶标仪及在450 nm 波长处测量吸光值。细胞活力=实验组吸光度值/空白对照吸光度值×100%。
1.5 流式细胞术检测细胞凋亡
取各组离心后收集的细胞,加入500 μL 结合缓冲液,通过凋亡试剂盒说明书,分别加入5 μL Annexin-V FITC 和PI 溶液,避光反应20 min,在流式细胞仪上检测细胞凋亡率。
1.6 Western blot 检测c-Myc、Bax 和MMP-2 蛋白表达
采用BCA 法检测定量蛋白,同时取45 μg 的蛋白样品在聚丙烯酰胺凝胶电泳处理后,转膜,封闭,加入相应的一抗,过夜孵育,次日加入二抗,孵育2 h 后行显影处理(化学发光液),GAPDH 作为内参,采用Image J 对蛋白条带的灰度值进行分析,计算蛋白表达。
1.7 Transwell 小室检测细胞迁移和侵袭
1.7.1 迁移实验 取各组细胞加入不含胎牛血清的DMEM 培养基内,稀释细胞浓度为2×105个/mL。在Transwell 小室上层加入100 μL 细胞悬液,下层加入500 μL 含10 %胎牛血清的DMEM 培养基,培养24 h,从培养箱中取出小室,使用棉签轻轻擦拭上层细胞,加入甲醇固定30 min,结晶紫染色10 min,显微镜下选择3 个视野拍照,观察细胞数目,计数取平均值。
1.7.2 侵袭实验 在Transwell 小室上层铺稀释Matrigel基质胶,烘干后,其余步骤同“1.7.1”项下。
1.8 双荧光素酶验证SNHG3 与miR-514a-5p 关系
Starbase 在线数据库显示SNHG3 和miR-514a-5p 存在结合位点。构建SNHG3 野生型(SNHG3 wild type,SNHG3-WT)和SNHG3 突变型(SNHG3 mutant,SNHG3-MUT)双荧光素酶报告载体,分别转染miRNC 和miR-514a-5p 至U-2OS 细胞。转染48 h,采用双荧光素酶试剂盒检测荧光素酶活性。
1.9 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验;两组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 SNHG3 和miR-514a-5p 在不同细胞中的表达水平比较
骨肉瘤细胞SW-1353、HOS、U-2OS、Saos-2 中SNHG3 表达高于成骨细胞hFOB1.19,miR-514a-5p表达低于成骨细胞hFOB1.19,差异有统计学意义(P <0.05)。见表1。
表1 SNHG3 和miR-514a-5p 在不同细胞中的表达水平比较(,n=9)

表1 SNHG3 和miR-514a-5p 在不同细胞中的表达水平比较(,n=9)
注:与hFOB1.19 组比较,aP <0.05。SNHG3:核仁小分子RNA 宿主基因3
2.2 敲低SNHG3 后U-2OS 细胞增殖、凋亡及c-Myc、Bax 蛋白表达比较
si-SNHG3 组的SNHG3 表达、细胞活力、c-Myc蛋白表达低于si-NC 组,细胞凋亡率、Bax 蛋白高于si-NC 组,差异有统计学意义(P<0.05)。见图1、表2。

图1 敲低SNHG3 后U-2OS 细胞凋亡及c-Myc、Bax 蛋白表达比较
表2 敲低SNHG3 后U-2OS 细胞增殖、凋亡及c-Myc、Bax 蛋白表达比较(,n=9)

表2 敲低SNHG3 后U-2OS 细胞增殖、凋亡及c-Myc、Bax 蛋白表达比较(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3
2.3 敲低SNHG3 后U-2OS 细胞迁移和侵袭及MMP-2 蛋白表达比较
si-SNHG3 组迁移细胞、侵袭细胞和MMP-2 蛋白表达低于si-NC 组,差异有统计学意义(P <0.05)。见图2、表3。
表3 敲低SNHG3 后U-2OS 细胞迁移和侵袭及MMP-2 蛋白表达比较(,n=9)
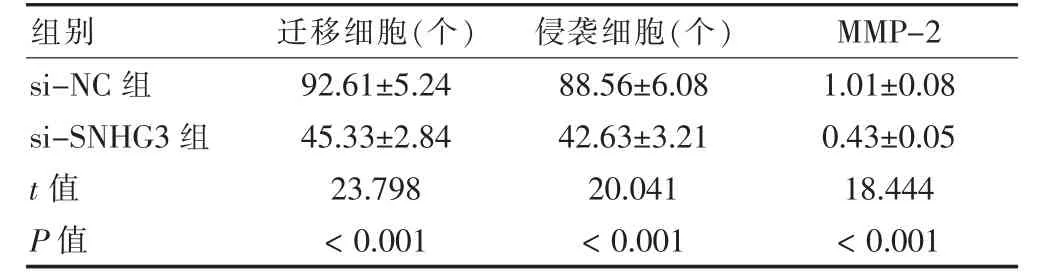
表3 敲低SNHG3 后U-2OS 细胞迁移和侵袭及MMP-2 蛋白表达比较(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3

图2 敲低SNHG3 后U-2OS 细胞迁移和侵袭及MMP-2 蛋白表达比较
2.4 双荧光素酶验证结果
SNHG3 与miR-514a-5p 存在互补的结合位点,见图3。miR-514a-5p 组SNHG3-WT 荧光素酶活性低于miR-NC 组,差异有统计学意义(P <0.05);miR-514a-5p 组与miR-NC 组SNHG3-MUT 荧光素酶比较,差异无统计学意义(P >0.05)。见表4。

图3 SNHG3 和miR-514a-5p 结合位点
表4 双荧光素酶验证结果(,n=9)

表4 双荧光素酶验证结果(,n=9)
注:SNHG3-WT:SNHG3 野生型;SNHG3-MUT:SNHG3 突变型;SNHG3:核仁小分子RNA 宿主基因3
2.5 过表达miR-514a-5p 后U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2 蛋白表达比较
miR-514a-5p 组miR-514a-5p 表达、细胞凋亡率、Bax 蛋白表达高于miR-NC 组;细胞活力、迁移细胞、侵袭细胞、c-Myc 和MMP-2 蛋白表达低于miRNC 组,差异有统计学意义(P <0.05)。见图4、表5。
表5 过表达miR-514a-5p 后U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2 蛋白表达比较(,n=9)

表5 过表达miR-514a-5p 后U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2 蛋白表达比较(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3

图4 过表达miR-514a-5p 对U-2OS 细胞增殖、凋亡、迁移和侵袭的影响
2.6 抑制miR-514a-5p 后敲低SNHG3 对U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2蛋白表达比较
si-SNHG3+anti-miR-514a-5p 组的miR-514a-5p 表达、细胞凋亡率、Bax 蛋白表达低于si-SNHG3+anti-miR-NC 组;细胞活力、迁移细胞、侵袭细胞、c-Myc 和MMP-2 蛋白表达高于si-SNHG3+antimiR-NC 组,差异有统计学意义(P <0.05)。见图5、表6。
表6 抑制miR-514a-5p 后敲低SNHG3 对U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2 蛋白表达比较(,n=9)
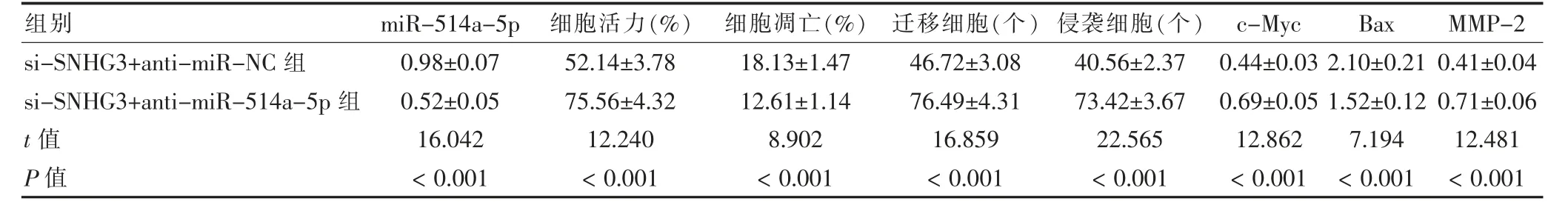
表6 抑制miR-514a-5p 后敲低SNHG3 对U-2OS 细胞增殖、凋亡、迁移、侵袭及c-Myc、Bax 和MMP-2 蛋白表达比较(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3

图5 抑制miR-514a-5p 后敲低SNHG3 对U-2OS 细胞增殖、凋亡、迁移和侵袭的影响
3 讨论
随着医学治疗水平的进步,新的辅助治疗骨肉瘤方法已经取得了明显的作用效果,但是仍会出现复发、转移等不良后果[11-12]。LncRNA 是一种非编码RNA分子自身没有编码蛋白质的功能,但是可以通过转录或转录后调控基因的表达[13-14]。Ju 等[15]研究结果显示,SNHG5 在骨肉瘤细胞中表达上调,抑制SNHG5 表达,可以明显抑制骨肉瘤细胞的增殖、迁移和侵袭。Xu 等[16]研究结果显示,SNHG4 在骨肉瘤组织和细胞中表达上调,其高表达与肿瘤大小和预后不良有关,SNHG4 可以海绵化miR-224-3p 调节骨肉瘤细胞的增殖和转移。Chen 等[17]研究结果显示,SNHG3 在骨肉瘤组织中表达上调,与患者预后和肿瘤大小有关,抑制SNHG3表达,可以明显抑制骨肉瘤细胞的增殖,与本研究结果相似。本研究结果显示,在骨肉瘤细胞中SNHG3 表达上调,敲低SNHG3 可以抑制U-2OS 细胞增殖、迁移和侵袭,并诱导细胞凋亡,提示SNHG3 可以作为骨肉瘤潜在生物标志物。
miRNA 是一种具有高度保守的非编码RNA 分子,可以通过调控靶向mRNA 表达参与肿瘤细胞增殖、凋亡、迁移和侵袭等生物学过程[18-19]。miRNA 在骨肉瘤细胞中起着抑癌或促癌的作用,其中miR-1284、miRNA-206、miR-493-5p、miR-501-3p 和miR-502-5p 等已证实[20-21]。miRNA-708 在骨肉瘤细胞中表达下调,miRNA-708 通过CUL4B 调节骨肉瘤细胞的增殖和凋亡[22]。Wang 等[23]研究结果显示,miR-423-5p 在骨肉瘤组织和细胞中表达下调,miR-423-5p 通过靶向STMN1 抑制骨肉瘤细胞增殖、转移。Wu 等[24]研究结果显示,miR-17 在骨肉瘤细胞中表达上调,miR-17可以上调SASH1 的表达,对于骨肉瘤细胞增长、迁移有一定抑制作用,同时还可以促进细胞凋亡,与本研究结果相反。miR-514a-5p 在肝癌、鼻咽癌等癌症中表达下调[25],在肿瘤细胞中起着抑癌的作用。本研究结果显示,在骨肉瘤细胞中miR-514a-5p 表达下调,过表达miR-514a-5p 可以抑制骨肉瘤细胞的增殖、迁移和侵袭,并诱导细胞凋亡。进一步实验结果显示,SNHG3 可以靶向miR-514a-5p 的表达,而抑制miR-514a-5p 逆转了敲低SNHG3 对U-2OS 细胞的增殖、凋亡、迁移和侵袭的作用,提示敲低SNHG3 可以通过调控miR-514a-5p 发挥在骨肉瘤细胞中的作用。
综上所述,SNHG3 在骨肉瘤细胞中表达上调,敲低SNHG3,或有效调控miR-514a-5p 表达,可以明显抑制骨肉瘤细胞增长、迁移、侵袭作用,同时促进细胞凋亡,为骨肉瘤临床治疗提供新的作用靶点。
