不同铝耐性小麦内源磷再利用差异分析
2021-09-26张晓龙陶烨朱晓芳马建锋沈仁芳
张晓龙 陶烨 朱晓芳 马建锋 沈仁芳


摘要:植物体内磷的分配和再利用是植物对磷元素利用的具体表现,磷和铝是酸性土壤上限制作物生长的两大主要因子,因此,对不同铝耐性品种在磷再利用机制方面的研究具有重要意义。以小麦耐铝品种Atlas 66和铝敏感品种Scout 66为研究材料,研究有无磷供应下品种间磷含量与细胞壁及其组分磷含量以及果胶甲酯酶(PME)活性的差异。结果表明,与Scout 66相比,Atlas 66在缺磷条件下鲜质量和干质量相对较低,全磷和可溶性磷含量也相对较低,但品种间差异不显著。另一方面,在缺磷条件下,小麦耐铝品种Atlas 66磷相关基因表达量大多显著大于铝敏感品种Scout 66,说明在缺磷条件下,Atlas 66对磷的需求明显要高于Scout 66,以此来满足自身的生长发育需求。缺磷条件下,Atlas 66的根部细胞壁磷含量以及地上部果胶磷含量大多显著高于Scout 66,无论有无磷供应下Atlas 66 与Scout 66的PME活性并没有显著差异,说明相比于Scout 66,Atlas 66在缺磷时细胞壁释放的可供植物再利用的磷显著减少,因而,Atlas 66对磷的需求提高,进一步验证了表达量的结果。综上所述,耐铝型小麦品种Atlas 66在整体磷含量上略低于铝敏感型品种Scout 66,更多的磷固定在Atlas 66细胞壁中不能释放,这可能也是其耐铝机制之一。
关键词:小麦;耐铝性;缺磷;细胞壁;磷再利用
中图分类号:Q945.12;S512.101 文献标志码:A
文章编号:1002-1302(2021)17-0080-07
收稿日期:2021-02-04
基金项目:江苏省杰出青年基金(编号:BK20190050);中国科学院青年创新促进会(编号:2015250);国家重点基础研究发展计划(973)项目(编号:2014CB441000);中国科学院战略性先导科技专项(编号:XDB15030302、XDB15030202)。
作者简介:张晓龙(1990—),男,安徽阜阳人,博士研究生,主要从事植物逆境生理的研究。E-mail:974588379@qq.com。
通信作者:朱晓芳,博士,副研究员,主要从事植物逆境生理的研究。E-mail:xiaofangzhu@issas.ac.cn。
磷是生物体内不可缺少的大量营养元素,同时也是农业生态系统中作物生长的主要限制因子[1]。植物吸收和代谢的磷主要是磷酸盐形式的无机磷,尽管土壤中的磷含量丰富,但是由于磷在土壤中的特殊形式,导致可供植物吸收利用的量少之又少[2]。微生物的转化固定、酸性土壤中磷铝等的结合、碱性土壤中磷钙等的结合以及径流等过程限制着植物对磷的吸收[3-6]。因此,研究植物在缺磷、低磷条件下的机制已经成为植物育种的主要目标之一。
在长期应对磷不足的过程中,植物本身进化出一系列的应对机制。对于植物而言,可通过自身形态的改变[7]、有机酸的分泌[8]、微生物共生[9]等方式促使根際范围有效磷含量的提高。植物自身内部通过磷转运基因的表达[10]、糖类代谢[11]、磷的再分配[12]等机制将吸收的磷再利用进而缓解磷的缺乏以满足自身的生长发育。近年来,对于植物体内磷再利用的研究又有了新的认识,即细胞壁中吸附的磷在植物磷不足时的再利用机制。果胶是细胞壁的主要成分,其可在植物磷缺乏时将细胞壁中吸附的磷酸盐中的磷置换出来,进而供植物再利用,而体外的磷解析试验也证实了这一点[13-15]。因此,由于磷缺乏导致的细胞壁组分含量的改变可以影响植物内源磷的再利用。
小麦是我国重要的粮食作物,在南方酸性土壤上也多有种植,与其他作物一样,铝毒和磷缺乏也是限制酸性土壤小麦生产的2个主要因素[16]。已有的研究多是从单一方向对磷和铝进行比较,结果一致认为,耐铝则磷高效,而磷高效则耐铝[17-18]。而不同铝耐性品种作物在内源磷再利用机制方面是否存在差异还鲜有报道。因此,本研究以小麦耐铝品种Atlas 66和铝敏感品种Scout 66为研究材料,研究缺磷条件下磷再利用能力的差异,从而丰富不同铝耐性小麦品种内部的磷再利用机制。
1 材料与方法
1.1 供试材料和培养条件
本试验于2019年12月至2020年9月于江苏省南京市中国科学院南京土壤研究所温室内进行。选取Atlas 66和Scout 66 2个小麦品种为试验材料。
将种子在10%的H2O2中浸泡消毒30 min,用蒸馏水冲洗干净后,置于蒸馏水中浸泡2 h。然后将种子置于湿润的滤纸上,26 ℃避光催芽。1 d后,将种子移至浮于0.5 mol/L的CaCl2(pH值为6.0)溶液的浮板上,26 ℃避光培养3 d,培养过程中每天更换CaCl2溶液。避光培养后,选取长势一致的幼苗移至改良后的1/4 霍格兰(Hoagland)营养液中继续培养,全营养液配方如下:2 mmol/L Ca(NO3)2·4H2O、650 μmol/L MgSO4·7H2O、250 μmol/L KH2PO4、750 μmol/L K2SO4、40 μmol/L Fe-EDTA、10 μmol/L MnSO4·H2O、0.1 μmol/L CuSO4·5H2O、1 μmol/L ZnSO4·7H2O、1 μmol/L H3BO3、0.05 μmol/L (NH4)6Mo7O24·4H2O、100 μmol/L KCl,pH值为6.0。培养和处理试验均在光照培养间培养,白天14 h/28 ℃和夜晚10 h/23 ℃,光照强度为400 μmol/(m2·s),相对湿度为60%,每天更换1次营养液。
正常培养1周后,选取长势一致的幼苗置于1.25 L的培养罐中进行处理,处理1周后收样。试验设品种和磷供应水平2个因素,小麦为耐铝品种Atlas 66和铝敏感品种Scout 66 2个品种,磷供应水平设正常培养(+P)和缺P处理(-P)2个水平,共4个处理,分别标记为A+P、A-P、S+P、S-P。
1.2 可溶性磷的提取与含量测定
将处理后的小麦样品用蒸馏水冲洗干净,用吸水纸吸干水分后分别称取根和地上部鲜质量。将样品用液氮充分研磨,根和地上部样品分别依次加入400 μL 5 mol/L H2SO4、4 mL去离子水和800 μL 5 mol/L H2SO4、8 mL的去离子水,充分混匀后转入10 mL离心管。室温静置4 h后,4 000 r/min离心 5 min。吸取100 μL上清液或100 μL磷标准液(0、5、10、15、20、25、30 mg/L),100 μL钼锑抗试剂(含15%维生素C),800 μL去离子水于1.5 mL离心管中。混匀后于37 ℃静置显色30 min,在880 nm处测定吸光度。
1.3 全磷的提取与含量测定
将处理后的小麦样品用蒸馏水冲洗干净,吸水纸吸干水分后分别称取根和地上部鲜质量。将称好的样品塞入信封并于烘箱中105 ℃杀青30 min,然后70 ℃烘至恒质量。将烘干的样品粉碎,称取0.5 g放入20 mL消煮管中,而后向消煮管中加入 5 mL 浓H2SO4,于消煮炉上180 ℃消煮至无色。消煮结束后,置于室温条件下,待温度降至室温后定容。吸取100 μL上清液或100 μL磷标准液(0、5、10、15、20、25、30 mg/L),100 μL钼锑抗试剂(含15%抗坏血酸),800 μL去离子水于1.5 mL离心管中,混匀后于37 ℃静置显色30 min,在880 nm下测定吸光度。
1.4 RNA的提取及相关基因表达量的测定
试验处理完成后,将小麦根系剪下冲洗干净,迅速用吸水纸吸干水分并放入1.5 mL灭菌后的离心管中,于液氮中冷冻,每个处理3次重复。将样品用液氮充分研磨,加入 300 μL裂解液,充分混匀后65 ℃裂解2 min,15 000 r/min、4 ℃条件下离心 3 min。取 200 μL 上清液,用 TGuide 核酸自动提取仪(TIANGEN M16,中国)提取总RNA。然后用 NanoDrop(Thermo Fisher,美国)检测 RNA 的浓度和质量,并用 1% 琼脂糖电泳检测其完整性。
用 ReverTra Ace qPCR RT Kit(TOYOBO,日本)试剂盒进行RNA反转录,共20 μL体系,即4 μL 5×RT Buffer、1 μL Enzyme Mix、1 μL Primer Mix、14 μL RNA和无菌水混合液(RNA总量为 1 μg)。反转录程序:37 ℃ 15 min,98 ℃ 5 min,4 ℃ 终止反应,得到 cDNA。
实时荧光定量 PCR(RT-PCR)用 SYBR Green Realtime PCR Master Mix(TOYOBO,日本)试剂盒及实时荧光定量 PCR仪(LightCycler 480Ⅱ,Roch,瑞士)进行试验。反应体系共10 μL体系,即5 μL SYBR Green,4.5 μL 无菌水,0.2 μL 正向引物,0.2 μL 反向引物,0.1 μL cDNA(稀释后)。反应条件:95 ℃ 预变性1 min,95 ℃ 变性15 s,55 ℃ 退火10 s,72 ℃ 延伸20 s,40个循环。每个样品3次平行,用公式 2-ΔΔCT 来计算基因的相对表达量。反应的引物序列见表1。
1.5 根系果胶甲酯酶(PME)活性测定
处理后的根系样品于1.5 mL离心管中经液氮冷冻后充分研磨,加入 500 μL PME提取液(1 mol/L NaCl,10 mmol/L Tris-HCl,pH值=7.5),静置冰浴 30 min后,15 000 r/min 离心 5 min。吸取 100 μL 上清液和甲醇标准液(0、10、20、30、40、50、75、100 μmol/L)于1.5 mL离心管中,加入200 μL 200 mmol/L 磷酸缓冲液{其中包含0.64 mg/mL果胶[酯化度(DE)=90%,Sigma]、0.01 units/μL 乙醇氧化酶(AO),pH值为7.5}。振荡混匀,30 ℃孵育 10 min后加入 400 μL 5 g/L的巯基拉曼染料,振荡混匀,30 ℃ 孵育 30 min,在550 nm 处测定吸光度。
1.6 细胞壁的提取及细胞壁有效磷含量测定
试验处理完成后,将样品用蒸馏水冲洗干净,用吸水纸擦干水分。将样品分根和地上部2个部分分别于研钵中用液氮充分研磨,然后加入5 mL 75%的乙醇,混匀后倒入10 mL离心管,室温静置20 min后,4 000 r/min 离心10 min,去上清。分别依次加入 5 mL 丙酮,1 ∶1的甲醇和三氯甲烷混合液以及甲醇,重复静置、离心、去上清等步骤。最终得到的残渣即为细胞壁粗提物,用冷冻干燥仪冷冻干燥后,于4 ℃冰箱保存备用。
称取5 mg左右细胞壁样品于1.5 mL离心管中,加入1 mL 2 mol/L HCl溶液,涡旋振荡24 h 后,15 000 r/min離心5 min。取100 μL上清液测定磷含量,测定方法同“1.2”节。
1.7 果胶的提取及其磷含量测定
称取3 mg左右细胞壁样品于1.5 mL离心管中,加入1 mL去离子水,100 ℃水浴1 h后13 200 r/min离心10 min,然后将上清液转移至5 mL离心管中。重复2次水浴步骤后,将3次所得到的上清液混匀即为提取的果胶溶液。取100 μL上清液测定磷含量,测定方法同“1.2”节。
1.8 数据处理
试验所得数据采用Excel 2007 和 SPSS 16.0软件进行统计分析,并用最小显著性差异法(LSD)检验处理间的差异显著性(P<0.05)。
2 结果与分析
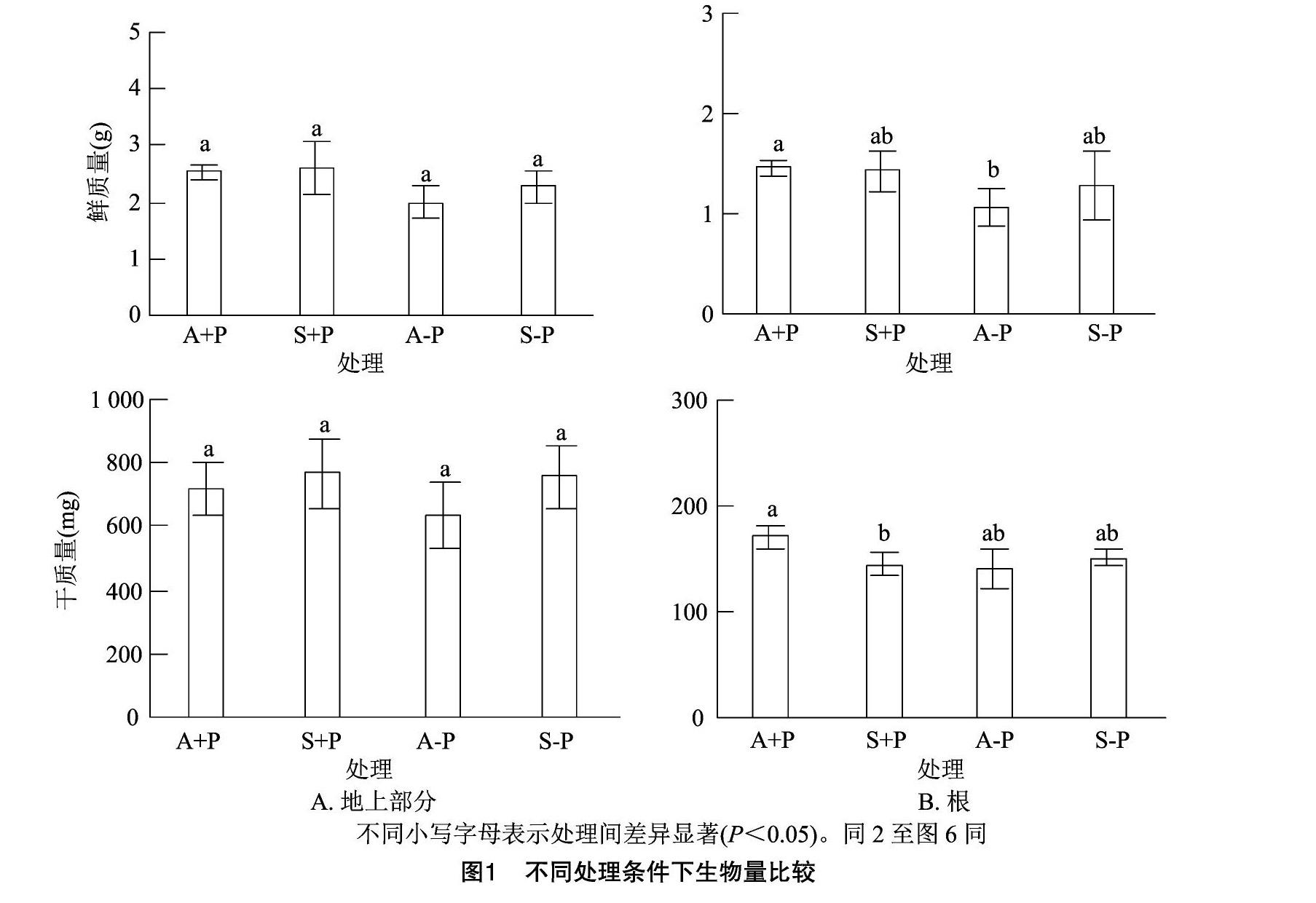
2.1 不同品种不同处理条件下生物量比较
Atlas 66和Scout 66 2个品种在不同处理条件下的生物量见图1,结果表明,缺磷处理后,2个品种的鲜质量和干质量均有所降低,但只有Atlas 66缺磷处理根部鲜质量显著降低。此外,除正常培养条件下,Scout 66的根部干质量显著小于Atlas 66且鲜质量略低外,其他各处理无论供磷水平如何Scout 66的鲜质量和干质量均大于Atlas 66,但品种间差异没达到显著水平(图1-B)。
2.2 不同品种不同处理条件下磷含量的差异
2个小麦品种在正常培养和缺磷培养条件下全磷和可溶性磷含量有所差异(图2)。Atlas 66在正常培养条件下根和地上部的全磷和可溶性磷含量大多大于Scout 66,但是品种间差异均未达到显著水平。而缺磷条件下,品种间差异趋势则相反,全磷和可溶性磷含量大多表现为Atlas 66小于Scout 66,但品种间差异不显著。
2.3 不同处理条件下根部磷相关基因表达量
分析结果表明,2个小麦品种在磷含量上存在着差异,那么在体内调控磷吸收转运的机制方面是否也存在着差异,我们对磷吸收转运相关基因进行表达量的测定。由图3可知,正常培养条件下,除TaPHT1;6基因外,Atlas 66的磷相关基因表达量均小于Scout 66,尤其是TaPHT1;1a/b、TaPHT1;2a/b、TaPHT1;8,品种间差异达到显著水平。缺磷条件下,除Scout66的TaPHT1;8基因略微下调外,2个供试品种的磷相关基因表达量均有所上调,且个别基因在不同磷供应水平下的表达量显著上调。另一方面,Atlas 66在缺磷条件下的各基因表达量均大于Scout 66,说明在缺磷条件下,Atlas 66对磷的需求明显要高于Scout 66,以此来满足自身的生长发育需求。
2.4 不同处理条件下细胞壁中有效磷含量
植物吸收磷以满足自身生长发育,而所吸收的磷相当一部分量储存于细胞壁中,基于本试验中2个品种在磷含量上存在着差异,因此对细胞壁的磷含量进行分析。结果(图4)表明,不同处理条件下Atlas 66的根和地上部分细胞壁的磷含量均大于Scout 66,尤其是在缺磷条件下品种间差异显著。说明相比于Scout 66,Atlas 66在缺磷时会有更多的磷作用于细胞壁中。
2.5 不同处理条件下果胶中的磷含量
果胶是细胞壁的重要组成成分,本试验处理条件下,根和地上部果胶中磷的含量差异趋势与细胞壁磷的差异趋势一致, 均表现为Atlas 66大于Scout66(图5)。
2.6 不同处理条件下根部果胶甲酯酶(PME)活性
果胶甲酯酶(PME)在细胞壁果胶去甲酯化这一过程中起重要作用,从图6可以看出,缺磷处理后,Scout 66根中的PME活性提高相比于Atlas 66较为明显,去甲酯化后裸露的羧基将结合阳离子进而释放更多的磷酸根用以磷的再利用。此外,2种磷供应水平下,Atlas 66的PME活性均高于Scout 66,但品种间差异不显著。
3 讨论与结论
磷是作物生长发育所必需的营养元素,植物对无机磷的吸收和代谢过程多伴有阳离子的参与,其中也包括植物不需要的阳离子,如Al3+、Cd2+等[19]。由于磷酸根的特性而导致可供植物吸收利用的无机磷非常少,所以在酸性土壤上,磷和铝2种元素同时限制植物的生长发育[20]。本试验所用供试材料Atlas 66和Scout 66是2个铝耐性不同的小麦品种,Atlas 66的耐铝性显著高于Scout 66[21]。近年来关于磷和铝之间关系的研究报道很多,一致认为耐铝则磷高效、而磷高效则耐铝[17-18,22]。那么在缺磷条件下,耐铝性不同的作物对磷的再利用能力是否存在差异?基于这一问题,本研究在正常条件下对铝耐性不同的2种小麦的磷含量进行了测定,发现Atlas 66地上部和根的可溶性磷和全磷含量大多高于Scout 66;进一步缺磷处理后,Atlas 66根和地上部分的可溶性磷和全磷含量大多低于Scout 66,而造成这一趋势的原因可能是由于缺磷后的生物量差异造成的。
在磷不足时,植物会诱导磷相关基因的表达来增加其对磷的吸收,并将吸收的磷利用以满足代谢及生长发育所需[10]。作为磷酸盐转运蛋白,PHT家族在磷的吸收和转运方面的功能也已经非常清楚,其家族所包含的大多数 PHT1 基因表达定位于植物根系且受到磷饥饿响应上调,然后负责增加土壤中磷的吸收和植物体内磷的迁移[23-25]。本研究也得到同样的结论,缺磷时2种材料的磷相关基因表达量显著上调。此外,在正常培养条件下Atlas 66的磷相关基因表达量大多小于Scout 66,而在缺磷时各基因的表达量大多显著大于Scout 66,说明在缺磷条件下,Atlas 66对磷的需求要明显高于Scout 66,以此来满足自身的生长发育需求。
植物吸收的磷90%以上都储存于细胞质中,而缺磷时细胞质中磷迁移的研究已经明确。近年来,新的观点认为,细胞壁中吸附的磷在植物磷不足时也可以进行再利用。在此之前,由于植物的细胞壁主要由纤维素、半纖维素、果胶等构成,其在帮助植物抵抗重金属胁迫中已有大量研究[14,26]。耐铝水稻品种Nipponbare在铝处理后根系细胞壁中果胶主要为高度甲酯化果胶,从而减少了对外界铝的吸附,缓解植物铝毒[27]。由于果胶带有负电荷的特性,其可在植物磷缺乏时将细胞壁中吸附的磷酸盐中的磷置换出来,进而供植物再利用,而同时体外的磷解析试验也证实了这一点[13-14]。基于本试验2种材料在铝耐性上的差异,我们对其细胞壁的磷含量进行了分析,Atlas 66的根和地上部细胞壁的磷含量均大于Scout 66,尤其是在缺磷条件下品种间差异显著,而地上部果胶中磷的含量差异趋势与细胞壁中磷的含量差异趋势一致,说明Atlas 66将更多的磷固定在细胞壁中,细胞壁不能释放的磷导致Atlas 66的磷再利用能力降低。
已有研究結果表明,高尔基体中合成的果胶具有高度的甲酯化,在果胶甲酯酶(PME)的催化下将甲酯基水解可以增加对细胞壁中阳离子的吸附,进而释放出无机磷[28]。本研究前期结果表明,缺磷条件下Scout 66具有相对较高的可溶性磷含量,而后面的结果表明,其细胞壁中的可溶性磷含量却相对较低,那么2种材料细胞壁果胶甲酯酶活性的差异是否是导致这一结果出现的原因呢?经试验发现,在缺磷处理后,2个品种根中的PME活性均提高。此外,我们发现在正常条件下Atlas 66的PME活性比Scout 66高出31.62%,而缺磷后Atlas 66的PME活性比Scout 66高出6.65%,说明缺磷处理后Scout 66的PME活性的提高幅度大于Atlas 66,这可能也是2种材料耐铝性差异的原因之一。
耐铝性小麦品种Atlas 66的鲜质量和干质量比铝敏感性小麦品种Scout 66低,全磷和可溶性磷含量也相对较低。但在缺磷条件下,Atlas 66的根和地上部细胞壁中的磷含量显著高于Scout 66;另一方面,缺磷后Scout 66的PME活性的提高幅度要大于Atlas 66,说明相比于Atlas 66,Scout 66细胞壁中的果胶在缺磷时会保持一个相对较低的甲酯化度,即释放更多的细胞壁磷,这可能也是2种材料耐铝性差异的原因之一。
参考文献:
[1]Osorio M B,Ng S,Berkowitz O,et al. SPX4 acts on PHR1-dependent and-independent regulation of shoot phosphorus status in Arabidopsis[J]. Plant Physiology,2019,181(1):332-352.
[2]Richardson A E,Simpson R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus[J]. Plant Physiology,2011,156(3):989-996.
[3]Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes:a review[J]. Plant and Soil,2001,237(2):173-195.
[4]Wang X,Shen J,Liao H. Acquisition or utilization,which is more critical for enhancing phosphorus efficiency in modern crops?[J]. Plant Science,2010,179(4):302-306.
[5]Clarkson D T,Hanson J B. The mineral nutrition of higher plants[J]. Annual Review of Plant Physiology,1980,31(1):239-298.
[6]Raghothama K G. Phosphate acquisition[J]. Annual Review of Plant Biology,1999,50(1):665-693.
[7]Lynch J P,Brown K M. Topsoil foraging-an architectural adaptation of plants to low phosphorus availability[J]. Plant and Soil,2001,237(2):225-237.
[8]Otani T,Ae N,Tanaka H. Phosphorus (P) uptake mechanisms of crops grown in soils with low P status:Ⅱ. Significance of organic acids in root exudates of pigeonpea[J]. Soil Science and Plant Nutrition,1996,42(3):553-560.
[9]Brundrett M C. Coevolution of roots and mycorrhizas of land plants[J]. The New Phytologist,2002,154(2):275-304.
[10]Rubio V,Linhares F,Solano R,et al. A conserved MYB transcription factor involved in phosphate starvation signaling both in vascular plants and in unicellular algae[J]. Genes & Development,2001,15(16):2122-2133.
[11]Theodorou M E,Plaxton W C. Purification and characterization of pyrophosphate-dependent phosphofructokinase from phosphate-starved Brassica nigra suspension cells[J]. Plant Physiology,1996,112(1):343-351.
[12]Yang S Y,Huang T K,Kuo H F,et al. Role of vacuoles in phosphorus storage and remobilization[J]. Journal of Experimental Botany,2017,68(12):3045-3055.
[13]Zhu X F,Wang Z W,Wan J X,et al. Pectin enhances rice (Oryza sativa) root phosphorus remobilization[J]. Journal of Experimental Botany,2015,66(3):1017-1024.
[14]Zhu X F,Lei G J,Jiang T,et al. Cell wall polysaccharides are involved in P-deficiency-induced Cd exclusion in Arabidopsis thaliana[J]. Planta,2012,236(4):989-997.
[15]Wright R J. Soil aluminum toxicity and plant growth[J]. Communications in Soil Science and Plant Analysis,1989,20(15):1479-1497.
[16]Kochian L V,Hoekenga O A,Pineros M A. How do crop plants tolerate acid soils ? Mechanisms of aluminum tolerance and phosphorous efficiency[J]. Annu Rev Plant Biol,2004,55:459-493.
[17]胡安永,趙学强,沈仁芳,等. 不同水稻品种磷利用效率与耐铝性的关系研究[J]. 土壤,2020,52(1):47-53.
[18]Yang L T,Jiang H X,Tang N,et al. Mechanisms of aluminum-tolerance in two species of citrus:secretion of organic acid anions and immobilization of aluminum by phosphorus in roots[J]. Plant Science,2011,180(3):521-530.
[19]Ma J F,Furukawa J. Recent progress in the research of external Al detoxification in higher plants:a minireview[J]. Journal of Inorganic Biochemistry,2003,97(1):46-51.
[20]Ma J F,Chen Z C,Shen R F. Molecular mechanisms of Al tolerance in gramineous plants[J]. Plant and Soil,2014,381(1):1-12.
[21]Tabuchi A,Kikui S,Matsumoto H. Differential effects of aluminium on osmotic potential and sugar accumulation in the root cells of Al-resistant and Al-sensitive wheat[J]. Physiologia Plantarum,2004,120(1):106-112.
[22]Iqbal T. A split-root experiment shows that translocated phosphorus does not alleviate aluminium toxicity within plant tissue[J]. Plant and Soil,2014,384(1):21-36.
[23]Nussaume L,Kanno S,Javot H,et al. Phosphate import in plants:focus on the PHT1 transporters[J]. Frontiers in Plant Science,2011,2:83.
[24]Gu M,Chen A Q,Sun S B,et al. Complex regulation of plant phosphate transporters and the gap between molecular mechanisms and practical application:what is missing?[J]. Molecular Plant,2016,9(3):396-416.
[25]Ai P H,Sun S B,Zhao J N,et al. Two rice phosphate transporters,OsPht1;2 and OsPht1;6,have different functions and kinetic properties in uptake and translocation[J]. Plant Journal,2009,57(5):798-809.
[26]Zhu X F,Wang Z W,Dong F,et al. Exogenous auxin alleviates cadmium toxicity in Arabidopsis thaliana by stimulating synthesis of hemicellulose 1 and increasing the cadmium fixation capacity of root cell walls[J]. Journal of Hazardous Materials,2013,263:398-403.
[27]Yang J L,Li Y Y,Zhang Y J,et al. Cell wall polysaccharides are specifically involved in the exclusion of aluminum from the rice root apex[J]. Plant Physiology,2008,146(2):602-611.
[28]Micheli F. Pectin methylesterases:cell wall enzymes with important roles in plant physiology[J]. Trends in Plant Science,2001,6(9):414-419.
