Cu2O微晶可控化制备、显微图像分析及可见光催化性能的研究
2021-09-26刘川枫刘家丞高培红梁军艳白艳红张雯向丹胡敏
刘川枫,刘家丞,高培红,梁军艳,白艳红,张雯,向丹,*,胡敏
1西安交通大学化学学院,西安 710049
2西安交通大学数学与统计学院,西安 710049
微纳材料具有一定优异的物理、化学性质,被认为是21世纪高新技术的龙头,受到世界各国的普遍关注和高度重视。微纳米功能材料的物理化学性质在很大程度上取决于他们的结晶形态、微观结构和尺寸大小。微纳米材料的控制合成为研究材料结构与性能以及它们之间的关系,揭示新规律与新原理提供基础,是促进材料学科与相关学科发展的重要动力[1]。Cu2O是一种P型半导体材料,因此它是一种可见光激发光催化剂[2]。这使Cu2O在处理环境污染方面成为了后起之秀[3]。与金属铜材料相比,Cu2O材料更易制备得到表面清洁、结构稳定且形貌规整均一的晶体,因而宏观上会形成不同颜色的胶体,色彩丰富的Cu2O溶胶能够引起学习者的兴趣。本实验设计包含纳米材料制备的一般方法,并通过改变体系的pH和反应物的投料比调节合成样品的形貌和尺寸,用生物显微镜对样品形貌进行表征,有利于帮助学生初步建立图像分析的基本概念和手段。实验内容是目前比较热门的无机纳米材料的制备、表征和应用,以期以化学之美让学生对化学产生兴趣,用化学应用培养学生的科研探索精神。本实验用化学方法合成样品,利用生物学上很常见的生物显微镜对样品进行表征,最后将样品应用于水质检测,是一个多学科交叉的实验,能有效培养学生的学习能力和提高学生的科研创新能力[4,5]。
1 实验内容
1.1 实验目的
(1) 通过查阅文献,了解纳米材料的应用前景和研究现状。
(2) 掌握纳米氧化亚铜溶胶的合成原理和方法。
(3) 掌握生物显微镜、光降解反应仪、紫外-可见分光光度计的使用方法。
1.2 实验原理
葡萄糖作为一种温和的还原剂,对环境不会产生污染且没有毒性。本研究在碱性水体系中,以葡萄糖为还原剂,将Cu2+还原成Cu2O溶胶的过程,具体的反应式如下[6]:
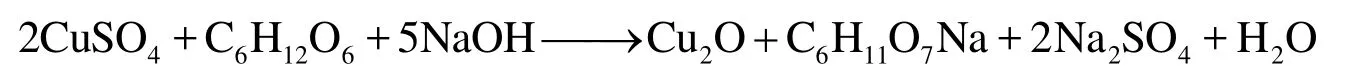
本实验中氧化亚铜晶体的制备是在液相环境中进行,Cu2O的析出过程经历了化学反应、成核及晶核长大等过程。其经历的过程是:① Cu2+与OH−混合形成稳定的含铜胶体物;② 溶液中游离的Cu2+离子被还原成Cu+离子;③ Cu+与OH−作用,生成CuOH (在溶液中极不稳定),迅速生成Cu2O核;④ Cu2O晶核逐渐长大。Cu2O属于立方晶系,图1为Cu2O的晶胞结构。其单晶外貌是由<1,0,0>晶面和<1,1,1>晶面方向生长速度不同造成的。图2显示出了立方晶系的几种基本形貌和所对应的晶面。从晶体生长动力学可知,晶体裸露面与各个晶面的生长速度有关,生长速度较小的晶面最终会形成裸露面,生长速度较大的晶面会在晶体生长中消失。图2中立方晶系的晶体外貌是<1,0,0>和<1,1,1>方向生长速度不同造成的。即R值不同(<1,0,0>和<1,1,1>生长速度比值不同),晶体的外貌发生变化,R值越大,<1,0,0>晶面生长速度越大。随着R值的增大,晶体外貌由立方体、削角立方体逐渐过渡到削角八面体和八面体[7]。
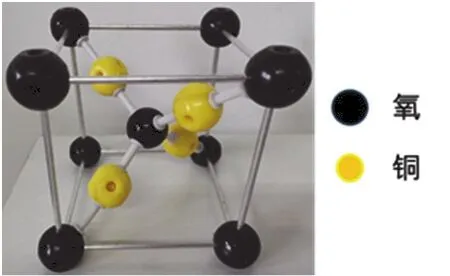
图1 Cu2O的单胞结构

图2 Cu2O晶体的不同晶型示意(自制模型)
1.3 主要仪器和试剂
1.3.1 试剂
五水硫酸铜(天津市津东天正精细化学试剂厂)、氢氧化钠(天津大茂化学试剂厂)、葡萄糖(天津大茂化学试剂厂)、碳酸钠(天津致远化学试剂有限公司)、二水柠檬酸三钠(天津大茂化学试剂厂)、亚甲基蓝(天津市津东天正精细化学试剂厂)、聚乙二醇2000(天津市津东天正精细化学试剂厂),所有试剂均为市售分析纯,未经纯化直接使用。实验用水为实验室自制超纯水。
1.3.2 仪器
生物显微镜(B302系列,重庆奥特光学仪器有限责任公司)、磁力加热搅拌器(MS-H280-Pro,北京大龙)、电热恒温鼓风干燥箱(DHG-9013A,上海一恒)、721型紫外-可见分光光度计(上海菁华)、光化学反应仪(YM-GHX-V,上海豫明)。
1.4 实验内容
1.4.1 晶体的制备
制备方法一:沸水浴条件下,向反应的试管中加入一定量的班氏试剂(3.00 g CuSO4·5H2O溶于60 °C热水中;2.00 g Na2CO3和3.46 g二水合柠檬酸三钠溶于12 mL 80 °C热水中。其中柠檬酸三钠的作用是形貌导向剂[8]。将上述2种溶液混合均匀,并加入20 mL热水稀释即可。新配制的班氏试剂呈深蓝色,澄清透明,稳定性好,可长期存放。)和40% (质量分数)葡萄糖,充分混合后,再向其中加入一定浓度的10 mL氢氧化钠溶液,反应5 min,用冷水冷却至室温停止反应。改变反应物的投料比合成系列样品。反应物的投料量与产物大致形貌如表1所示。
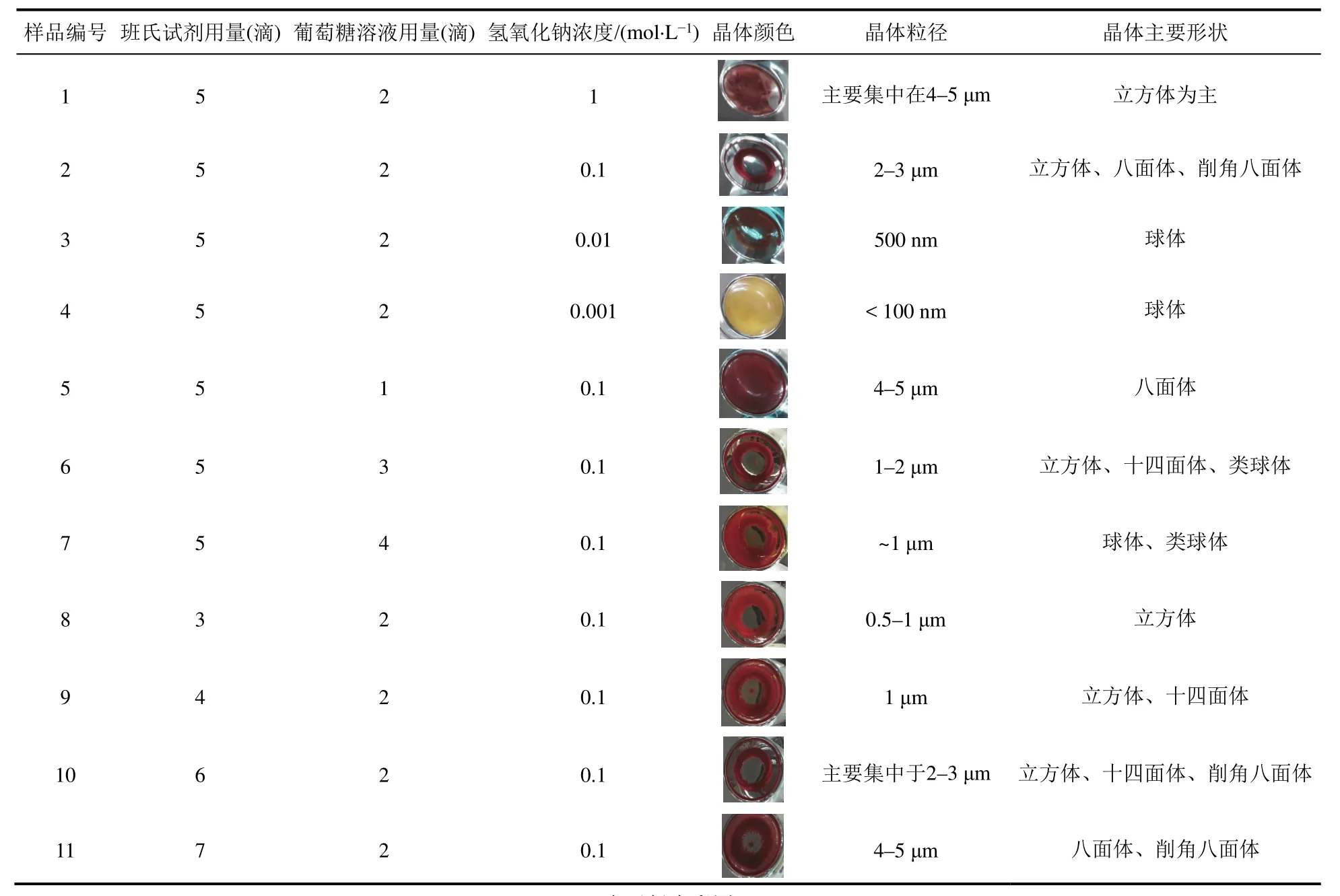
表1 不同投料比制备Cu2O及晶体基本情况
制备方法二:将20 mL 0.5 mol·L−1硫酸铜溶液和0.1 g聚乙二醇2000加入到250 mL单口烧瓶中,磁力搅拌下,将0.5 mol·L−140 mL氢氧化钠溶液加入到上述溶液中,搅拌30 min后加入50 mL 0.1 mol·L−1抗坏血酸溶液,继续搅拌30 min。反应结束后离心分离得到氧化亚铜,用去离子水和无水乙醇洗涤数次后置于烘箱中,80 °C下干燥2 h。样品为紫红色,为12号样品。
1.4.2 样品的丁达尔现象
丁达尔效应在液溶胶的光学性质分析中占有重要地位,是判别胶体属性的判据之一。如图3所示,合成的样品都有一定程度的丁达尔现象。

图3 部分样品的丁达尔现象
1.4.3 晶体的显微图像分析
微纳材料的表征包括单一个体和样品整体的分析。单一颗粒的分析包括颗粒的大小、形貌、晶体结构等;材料整体的特征包括颗粒的大小分布、形状分布等。光学和电子显微镜是研究微纳材料的重要工具,它通过检测微纳材料图像的形式展示材料的微观形貌,显微图像分析技术的开发和应用使微观形貌的检测由定性描述向定量表征跨越。人们对客观世界的观察和认识中,用肉眼能看清的最小细微物体约0.2 mm,若比这更小的物体,就要用放大镜或者显微镜观察。显微镜主要包括光学显微镜和电子显微镜。结合Cu2O微晶尺寸的大小,以及低年级实验教学资源特点,特选择应用更为广泛的生物显微镜作为图像检测仪,B302系列生物显微镜1000倍放大系数可检测到0.22 μm的分辨率,完全能满足对微米级样品的形貌检测。
1.4.4 晶体光催化性能的探究
可见光催化性能研究,用氙灯模拟太阳光,在光催化反应仪中进行。向试管中加入20 mL 0.025%(质量分数)亚甲基蓝溶液并按一定用量加入催化剂,在一定功率氙灯照射下进行光催化实验。取反应后的混合液,离心10 min并取上清液在660 nm波长下测量上清液吸光度,其中a= [(A0−A)/A0]×100%,A0为亚甲基蓝初始吸光度,A为测量时的吸光度,a为降解率[9]。
2 结果与讨论
2.1 晶体宏观外表与微观表征
(1) 不同氢氧化钠浓度影响下的Cu2O微晶的形貌如图4所示。
图4 1–4号样品的显微镜照片
图4a、4b、4c、4d分别对应表1中的1、2、3、4组样品,由图像可以观察到,在图4a中NaOH浓度为1 mol·L−1时,晶体形状以立方体为主,粒径最小为1 μm左右,最大大于5 μm,主要集中于4–5 μm,粒径分布较宽。在图4b中,NaOH浓度为0.1 mol·L−1时,晶体形状以立方体和八面体、削角八面体为主,粒径集中于2–3 μm,粒径分布较窄。在图4c中,NaOH浓度为0.01 mol·L−1时,晶体形状以球体为主,晶体粒径为500 nm左右。在图4d中,NaOH浓度为0.001 mol·L−1时,晶体形状以球体为主,晶体粒径小于100 nm。随着NaOH浓度的降低,晶体的尺寸逐渐变小。当NaOH浓度低的时候,体系中Cu+的过饱和度高,体系初期产生的晶核聚集生长,球形颗粒逐渐增大,最终得到的Cu2O颗粒的形貌为球形;当NaOH浓度高的时候,初期反应快速生成球形颗粒,随着反应的进行,由于NaOH浓度高,对晶核的吸附能力强,溶液中产生的微小的Cu2O晶体就会被OH−吸附,晶核以二维成核生长模式缓慢生长,产生立方体、八面体等形状的颗粒。在粒径方面,随着NaOH浓度的升高,反应速度加快,但是由于体系中游离的OH−的增加,导致了反应体系中初始Cu2+浓度的降低,在成核过程中成核数目反而逐渐减少,因此产物Cu2O颗粒的粒径随之增大[10]。
(2) 不同量葡萄糖的影响下的Cu2O微晶的形貌如图5所示。

图5 5–7号样品的显微镜照片
第5–7组实验与第2组实验形成对照,图5a、5b、5c分别对应表1中的5、6、7组样品,实验主要改变葡萄糖的用量。在图5a中,加入1滴葡萄糖溶液时,晶体形状以八面体为主,粒径主要集中于4–5 μm。八面体附近存在小的立方体、类球体颗粒,可能是制备过程中有脱水发生导致了二次成核的发生。在图5b中,加入3滴葡萄糖溶液时,晶体形状以立方体、十四面体、类球体为主,粒径集中于1–2 μm。在图5c中,加入4滴葡萄糖溶液时,晶体形状以球体、类球体为主,粒径集中于1 μm左右。当葡萄糖浓度较低时,则体系中存在过量的OH−离子,体系中产生的微小的Cu2O晶核就会被OH−选择性地吸附,以分子级生长为主要生长模式缓慢生长,晶体的<1,0,0>面生长速度相对较大时,晶体的<1,1,1>裸露面增大,晶体趋向于八面体。葡萄糖浓度较大时,体系中过量的葡萄糖会消耗OH−离子,则体系中被选择性吸附的OH−离子减少导致<1,0,0>面和<1,1,1>面生长速度比值的改变,从而形貌发生了变化,产物Cu2O颗粒的形貌由八面体过渡到类球形,最终转变成球形。且随着葡萄糖浓度的增加,还原速率加快,体系内Cu2O和Cu+的过饱和度均会不同程度地升高,此时聚集模式为Cu2O晶核的主要的生长方式,产物Cu2O颗粒的形貌为球形。又由于体系内Cu+的过饱和度升高,初期成核数量和聚集中心明显增多,在铜源总量一定的情况下,最终产物球形Cu2O颗粒的粒径逐渐减小[11]。
(3) 不同用量班氏试剂影响下的Cu2O微晶的形貌如图6所示。
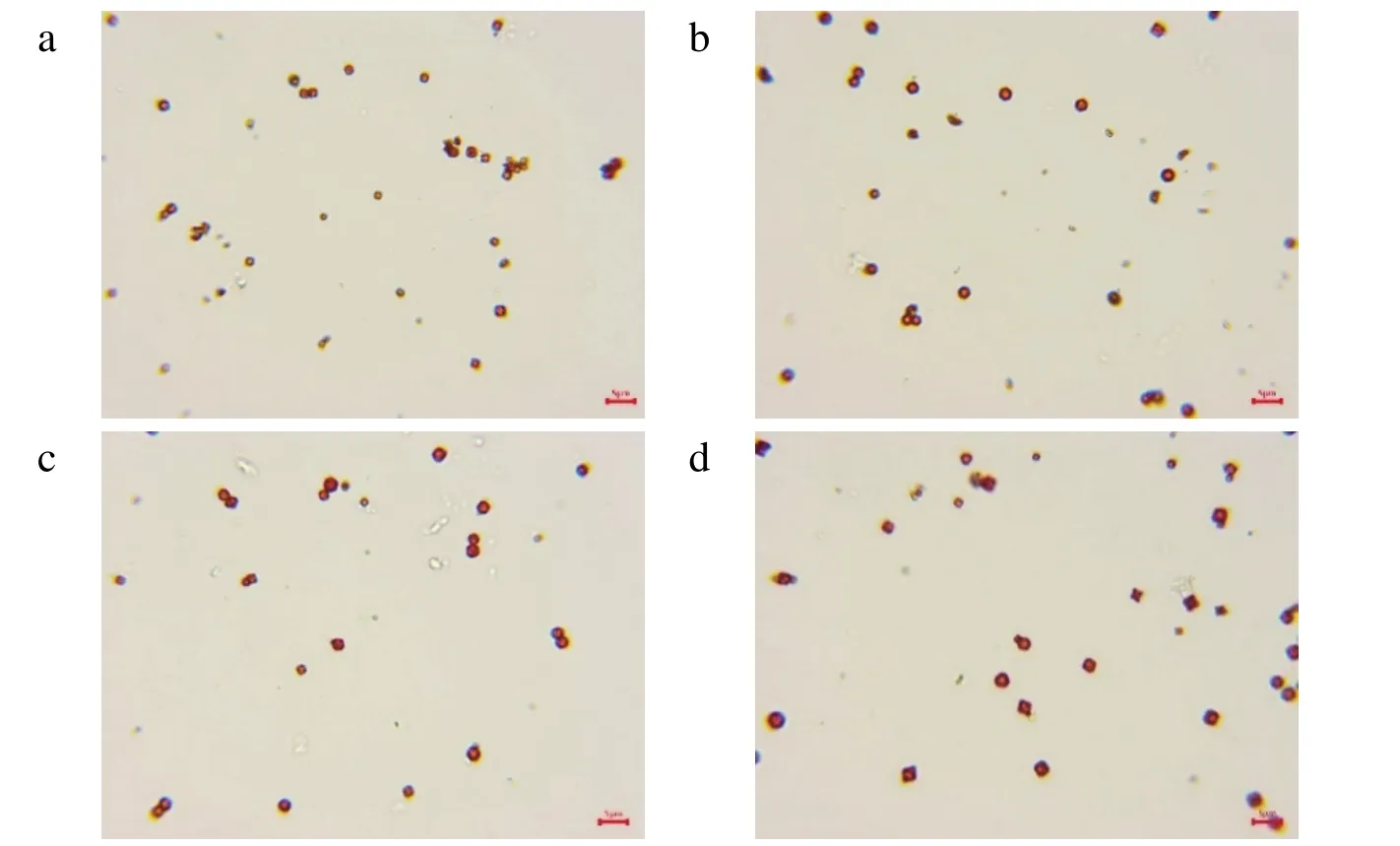
图6 8–11号样品的显微镜照片
图6a、6b、6c、6d分别对应表1中第8、9、10、11组样品。第8–11组实验与第2组实验形成对照,主要改变班氏试剂的用量。在图6a中,加入3滴班氏试剂时,晶体形状以立方体为主,粒径集中于0.5–1 μm。在图6b中,加入4滴班氏试剂时,晶体以立方体、十四面体为主,粒径集中于1 μm左右。在图6c中,加入6滴班氏试剂时,晶体形状包括立方体、八面体、十四面体等,粒径最小为1 μm左右,主要集中于2–3 μm,产生较小晶体也可能是二次成核导致的。粒径分布较宽。在图6d中,加入7滴班氏试剂时,晶体形状以八面体、削角八面体为主,粒径主要集中于4–5 μm。班氏试剂作为实验的铜源,主要起作用的是其中含有的硫酸铜。在对照实验第2组、第8–11组中,晶体均以分子级生长为主要生长模式,随着班氏试剂用量的增加,溶液中Cu2+浓度增加,<1,0,0>晶面和<1,1,1>晶面的生长速率的比值发生改变,<1,1,1>面生长速率降低,<1,0,0>生长速率增加,晶体逐渐由立方体过渡到十四面体、削角八面体与八面体。晶体粒径方面,由于Cu(OH)2溶解度很低,体系中的Cu2+的浓度很低,从而体系内Cu2+的浓度随CuSO4浓度的增加变化不大。在其他反应条件不变的情况下,反应速率的变化很小,因此晶核生长的聚集中心数量即体系内生成晶核数目变化不大。随着硫酸铜浓度的增加,即体系内的铜源总量逐渐增加,从而最终形成的Cu2O颗粒的粒径变大[12]。
2.2 晶体光催化性能的探究
20 mL 0.025%亚甲基蓝溶液中催化剂的添加量如表2所示,实验测得降解率如图7所示。
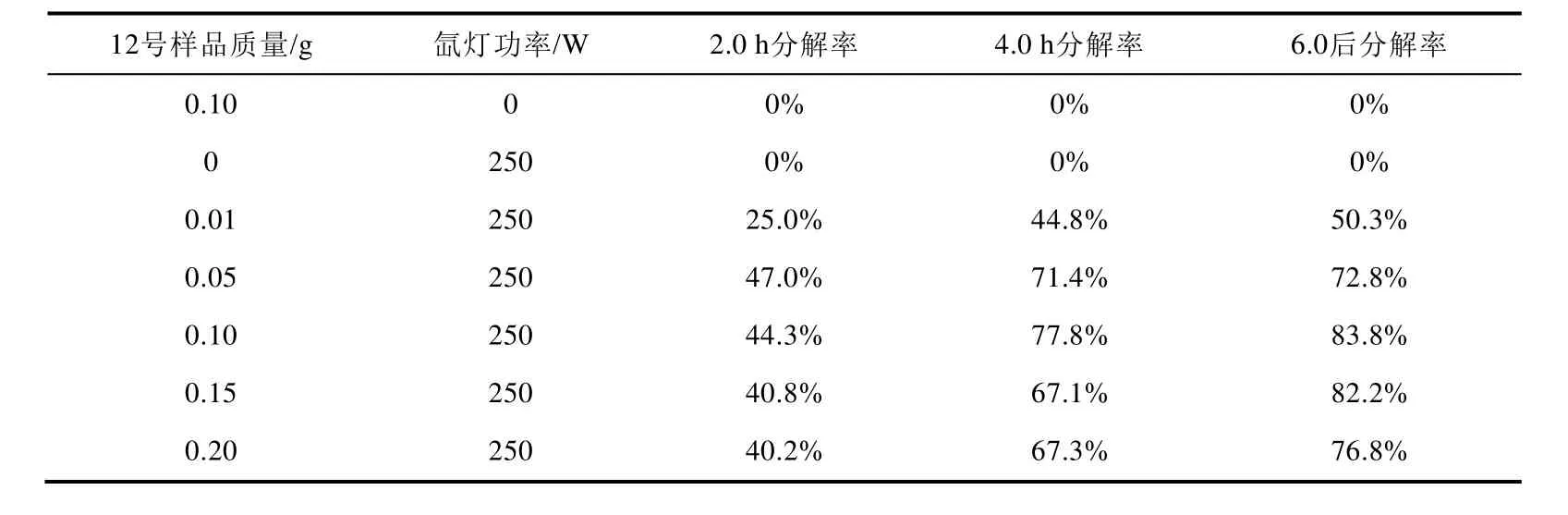
表2 制备方法二合成样品进行光催化性能研究
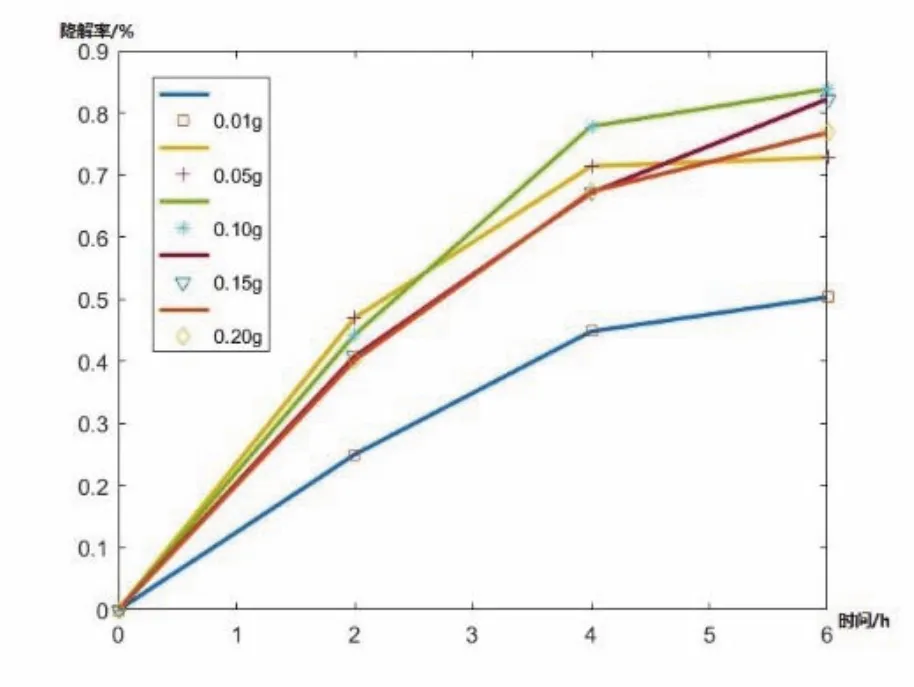
图7 氧化亚铜质量不同对降解率的影响
由图7可见,随着晶体催化剂用量的加大,总的催化速率先上升后下降。催化剂用量为0.1 g时催化效率最大,说明催化剂的用量并不是越多越好。催化剂用量的增加,会导致氧化亚铜晶体的大量聚集,氧化亚铜晶体会通过影响光生电子对的复合影响电子空穴对的形成。氧化亚铜晶体的载流子主要是光生电子空穴对,光生电子与溶解氧发生还原反应,光生空穴则与氢氧根离子、溶解氧、有机物等物质发生氧化反应,产生的羟基自由基、过氧化氢、过氧负离子均具有强氧化能力,有利于催化反应的进行。而电子空穴对与溶液中物质发生反应的前提条件是电子空穴对能够运动到晶体表面与溶液中物质相互接触[13]。而晶体的聚集增大了电子空穴对与溶液接触的难度,若有较多氧化亚铜晶体聚集,更多电子空穴对可能在与溶液接触之前就发生了复合,影响了光生电子空穴对的生成。使催化效率下降。
Cu2O光催化剂在催化降解有机物过程中,不会产生二次污染,稳定性良好,第二次重复使用降解率高达50%以上。Cu2O作为可见光催化剂有很大的应用前景,还有很大的研究空间。
3 实验安排和教学组织建议
本实验建议分段化实验教学,可以分为两个阶段进行学时安排,第一阶段是根据制备方法二合成大量的12号样品氧化亚铜微晶,以备后续的光降解实验使用,样品在干燥过程中,根据制备方法一合成1–11号样品,并进行显微图像分析,该阶段需要6小时;第二阶段用12号样品进行光降解实验,并对降解后的样品进行吸光度分析,需要8小时。该实验每个教学阶段参与学生人数上限为32人,两人一组。由于生物显微镜和紫外-可见分光光度计数量能供学生自由使用,所以学生可以根据自己的进度安排时间,但第二阶段光降解反应仪只有两台,同时可以进行16组样品,反应时间较长,要确保每次放样时间的统一,让学生协调好实验进度,一起放样。培养学生在实验过程中的配合和合作精神。
4 实验注意事项及安全须知
(1) 微纳材料的制备对反应器的清洁度要求很高,所以实验前应用稀盐酸对所用仪器进行清洗,并用超纯水多次润洗,方能实验。
(2) 用生物显微镜进行样品形貌检测过程中,将样品直接滴加在载玻片上,盖好盖玻片,用吸水纸将样品周围的水分吸的尽可能干,否则测量过程中会出现水带,并有大量样品堆积,不利于单个样品形貌的观测。
(3) 光降解反应仪使用过程中,一定要确保冷凝水的通畅,否则长时间的高瓦数的氙灯产生的热量对检测的结果有一定影响,同时对氙灯也有一定的损害。光降解一段时间后进行取样,一定要先关闭光源,带好线手套,防止在取样的过程中烫伤。
5 结语
通过改变参与反应的CuSO4、NaOH、葡萄糖的浓度、用量,制备出系列不同颜色的Cu2O微晶溶胶,利用生物显微镜对样品进行形貌表征,表征结果符合Cu2O晶体生长理论。同时,光催化实验表明,尺寸、形貌合适的Cu2O晶体在可见光照射下有一定的催化活性,随着反应的进行催化速率不断下降,同时对于实验所用氧化亚铜晶体催化剂而言,最合适的催化剂用量和有机染料的比值为0.1 g :20 mL。该实验从制备、表征到结果分析,体系完整,整个实验过程绿色环保、简单易行,非常适合一般院校低年级的无机实验教学,也非常适合科普教育。
