基于网络药理学和分子对接探究斑蝥治疗肝癌的作用机制
2021-09-26林晓彤黄重铭彭慧婷陈虹宇王文萍王思斯
林晓彤 黄重铭 彭慧婷 陈虹宇 王文萍 王思斯 曹 洋
1.广州中医药大学第一临床医学院,广东广州 510405;2.广州中医药大学第一附属医院肿瘤中心,广东广州 510405
近年来,恶性肿瘤成为影响全球人类健康的疾病之一。我国作为原发性肝癌发病率的高危国家之一,肝癌的死亡率高达23.7%,成为威胁国人健康的公共卫生问题[1-2]。中医药治疗肝癌具有增效减毒、改善生活质量、延长生存期等优势。斑蝥为芫菁科昆虫南方大斑蝥(Mylabris phalerata Pallas)的干燥体,是我国最早发现具有抗肿瘤作用的中药之一。现代药理学研究显示,斑蝥具有抗病毒、抗肿瘤、调节免疫等活性,已广泛应用于肿瘤临床治疗中[3]。目前斑蝥治疗肝癌作用机制尚未明确,本研究通过网络药理学分析和分子对接的方法来探讨斑蝥治疗肝癌的作用机制。
1 资料与方法
1.1 斑蝥成分的筛选
利用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)对“斑蝥”进行检索,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥18%为条件,筛选出斑蝥活性化合物。结合2010 年1 月至2020 年10 月中国知网、万方、维普数据库检索相关文献,筛选并汇总斑蝥的活性成分。通过SwissTargetPrediction 数据库对斑蝥活性成分的作用靶点进行预测,设置可能性>0.1 筛选出潜在的作用靶点。
1.2 肝癌的靶点收集及潜在靶点的预测
以“Liver Cancer”为关键词在GeneCards 数据库和OMIM 数据库进行检索,汇总去重后得到肝癌基因靶点。利用R 软件将斑蝥的作用靶点与肝癌基因靶点进行映射,获得斑蝥活性成分-肝癌潜在靶点的维恩图,得到斑蝥抗肿瘤的潜在靶点。
1.3 关键靶点蛋白蛋白质-蛋白质相互作用(proteinprotein interaction,PPI)网络的构建
将关键靶点蛋白输入String 数据库,限定物种为“Homosapiens”,导出保存TSV 文件。将TSV 文件导入Cytoscape,并绘制PPI 网络图。
1.4 斑蝥-活性成分-肝癌靶点网络的构建
利用Cytoscape 构建斑蝥-活性成分-肝癌靶点互作网络。其中,网络中节点代表着斑蝥、活性成分和关键基因靶点;边线代表着斑蝥与活性成分、活性成分与作用靶点、疾病与靶点的关系。
1.5 斑蝥的GO 分析和KEGG 通路富集分析
Bioconductor 是一个提供基因组数据分析和注释工具的R 语言软件包集合平台。安装Bioconductor 中的“ClusterProfiler”“DOSE”及“Pathway”软件包,运行R 先后绘制出斑蝥治疗肝癌潜在作用靶点的GO 富集分析气泡图与KEGG 通路富集分析柱状图。
1.6 分子对接验证
结合PPI 网络分析中关键靶点蛋白互作程度,选取互作程度最高前2 名靶点蛋白为关键靶点蛋白。ZINC 数据库中搜索斑蝥活性成分mol2 格式结构,利用PDB 数据库下载关键靶点蛋白的PDB 格式的结构。运用AutoDockTools 软件对靶点蛋白进行去除水分子、加氢等预处理,导入并设置成小分子配体,随后将靶点蛋白与小分子配体转换成pdbqt 文件,对其进行分子对接,获得两者对接所需的最低结合能。结合能代表活性成分与靶点蛋白结合所需能量,结合能越低,表明活性成分与靶点蛋白的结合力越强[4]。
2 结果
2.1 斑蝥的活性成分及靶点
结合数据库与文献查阅对斑蝥活性成分进行筛选,共获得6 个有效活性成分(表1);并得到145 个预测作用靶点。

表1 斑蝥有效活性成分信息
2.2 肝癌靶点的获取与潜在靶点的预测
数据库检索汇总去重后得到肝癌靶点1442 个,将145 个斑蝥作用靶点与1442 个肝癌相关基因靶点进行匹配,斑蝥与肝癌的潜在作用靶点44 个。见图1。
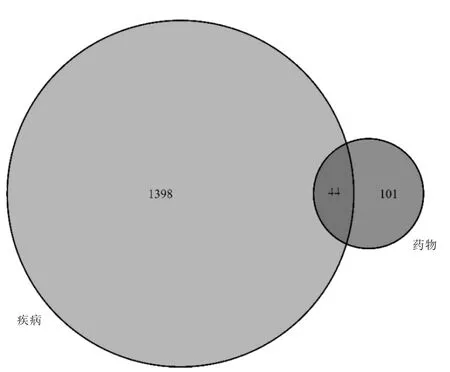
图1 斑蝥活性成分与肝癌潜在靶点的维恩图
2.3 PPI 网络分析
PPI 网络图包括44 个节点,233 条边。节点代表靶点蛋白,节点大小及颜色深浅代表靶点蛋白的degree值,其中degree 值越大则靶点颜色越深、面积越大。节点之间的连线代表着靶点蛋白之间关联性,连线的颜色越深、越粗意味着靶点蛋白间关联性越高。PPI 网络分析显 示IL-6、MAPK3、MAPK1、ESR1、PTGS2 属于斑蝥治疗肝癌的核心靶点蛋白。见图2。
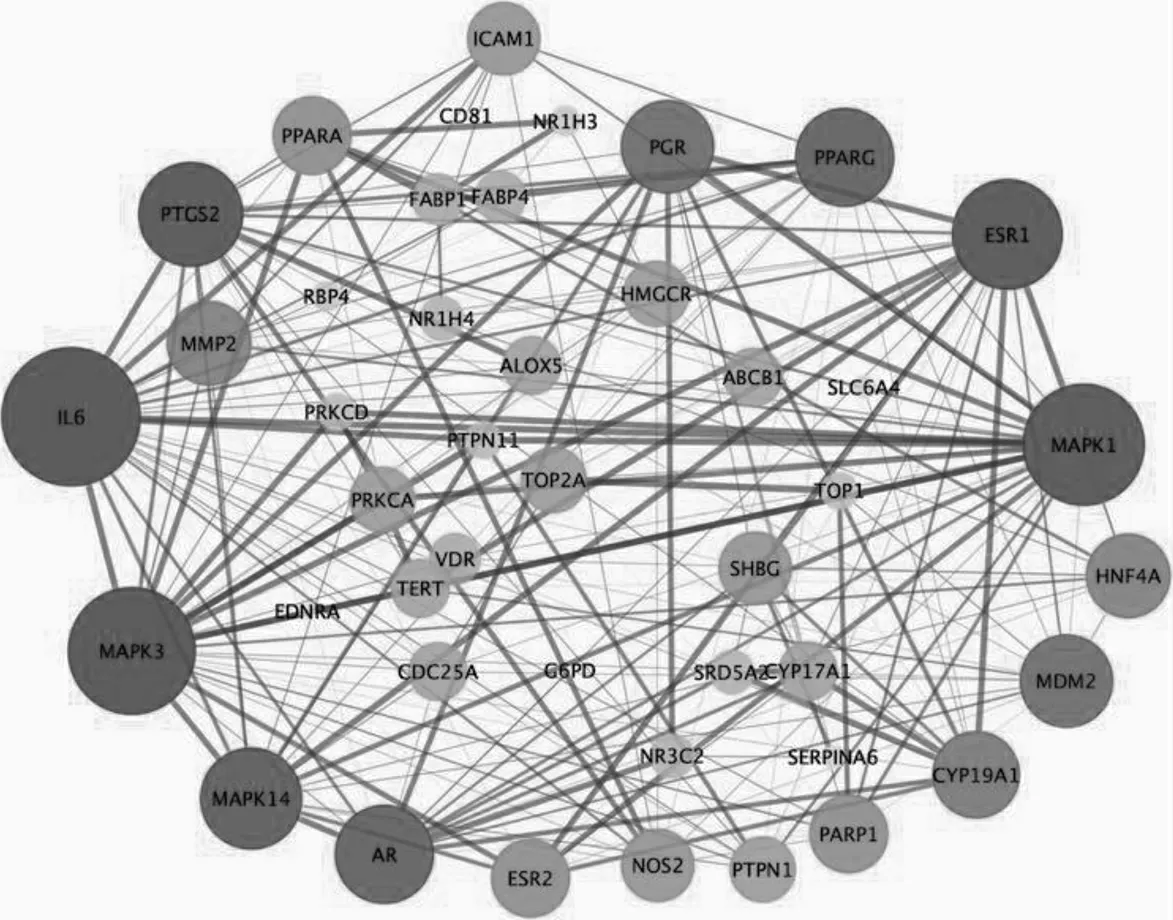
图2 斑蝥的关键靶点蛋白互作网络
2.4 斑蝥-活性成分-肝癌靶点互作网络分析
斑蝥-活性成分-肝癌的靶点互作网络图包含44 个关键靶点,97 条边。见图3。
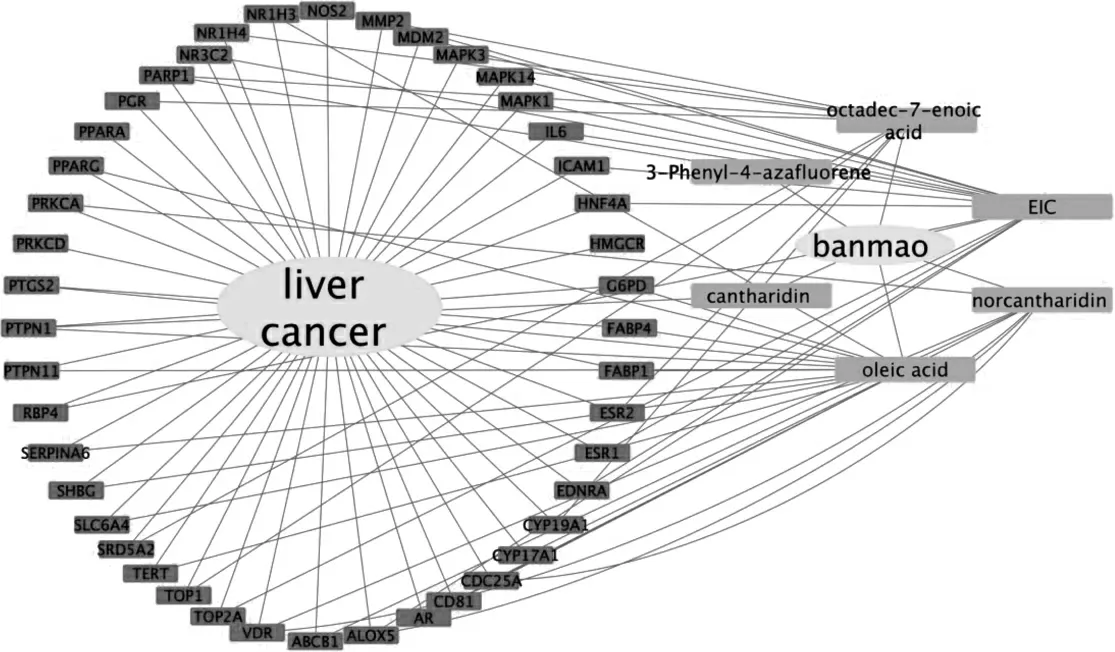
图3 斑蝥-活性成分-肝癌靶点网络图
2.5 GO 及KEGG的富集分析
GO 富集气泡图显示斑蝥治疗肝癌关键靶点的主要生物学功能涉及细胞增殖、体内激素分泌与调控、蛋白质转运等生物学过程。见图4(封三)。
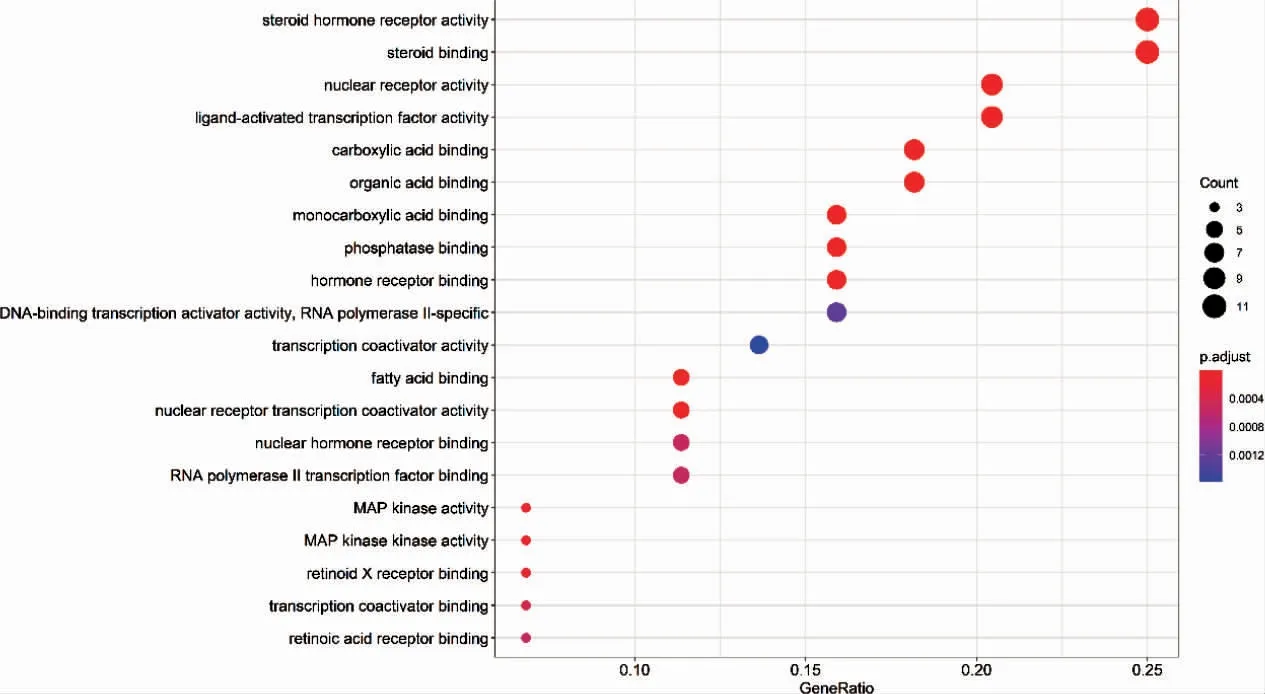
图4 GO 富集分析气泡图
KEGG 通路富集分析显示,斑蝥抗肝癌的关键基因靶点富集的通路主要与细胞增殖与凋亡、肿瘤血管新生、炎症介导及细胞黏附相关。见图5(封三)。
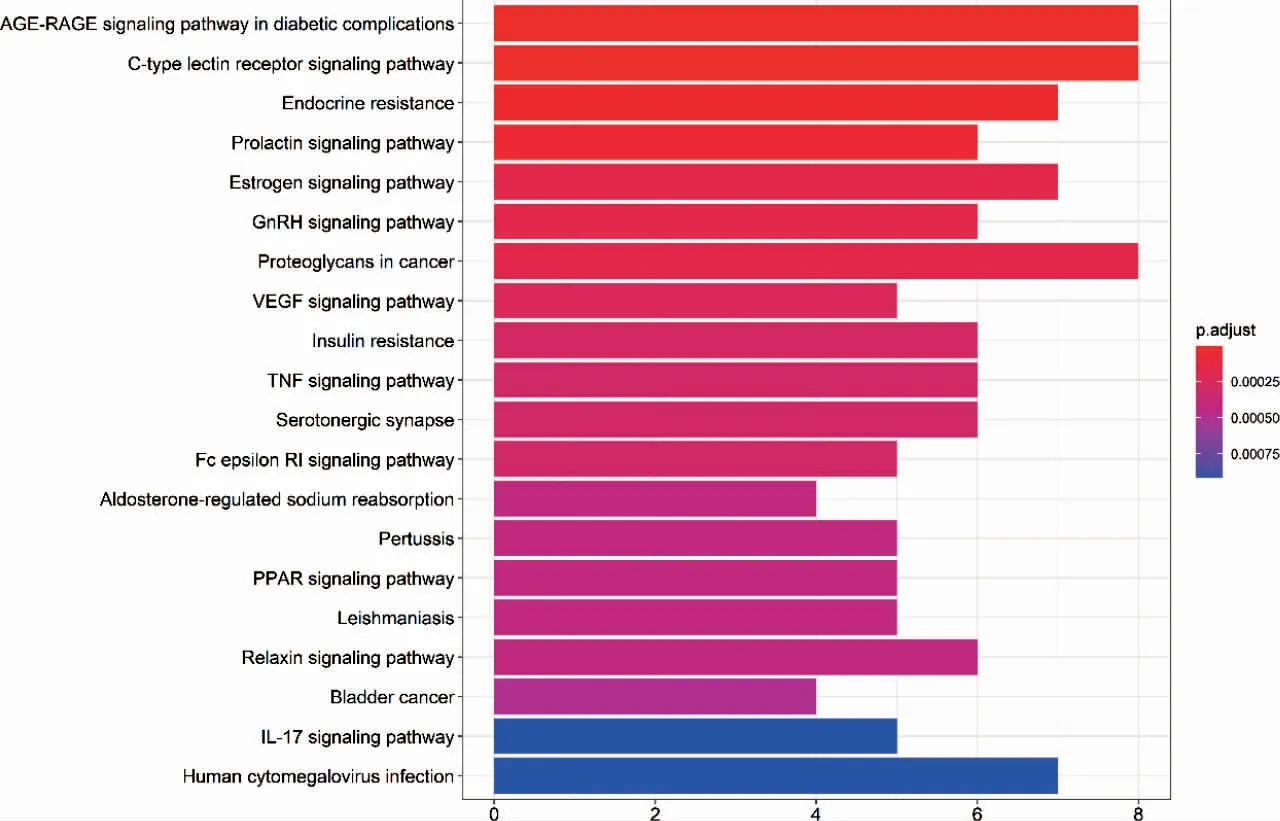
图5 KEGG 通路富集分析柱状图
2.6 分析对接结果
分子对接显示,IL-6、MAPK3 与所有活性成分都显示出良好的结合活性(表2)。其中,3-苯基-4-氮杂芴与IL-6 及MAPK3 对接显示出最好结合力。见图6~7。

表2 IL-6、MAPK3 与活性成分的分子对接结果(kJ/mol)

图6 IL-6 与3-苯基-4-氮杂芴分子对接图

图7 MAPK3 与3-苯基-4-氮杂芴分子对接图
3 讨论
油酸、亚油酸、十八碳七烯酸、去甲斑蝥素、3-苯基-4-氮杂芴、斑蝥素等成分可能是斑蝥治疗肝癌的物质基础。研究表明,斑蝥素可通过抑制β-连环蛋白和细胞周期蛋白D1的表达,将细胞周期阻滞在G2/M 期并诱导其凋亡[7]。去甲肾上腺素通过ERK1/2和NF-κB 信号通路的磷酸化下调MMP-9 和u-PA的表达,抑制HCC 细胞的迁移和侵袭能力[8]。
PPI 结果显示,IL-6、MAPK3、MAPK1、ESR1、PTGS2为互作程度最高的前5 个靶点。IL-6 可引起JAK 磷酸化激活STAT3 形成二聚体,诱导肿瘤新生血管形成,与肿瘤转移密切相关[9]。MAPK3 与MAPK1 均为MAPK家族成员,其中通过激活下游RAS/RAF/MAPK/ERK通路参与调控细胞的增殖分化的过程;还可以激活JNK 和p38/MAPK 通路在炎症和细胞凋亡中发挥重要作用[10-11]。PTGS2 其催化合成的前列腺素为肝损伤中重要的炎症介质,可促进肿瘤细胞增殖,抑制凋亡,增加肿瘤细胞的侵袭能力[12]。ESR1 为雌激素受体,乙型肝炎病毒(HBV)诱发ESR1 高甲基化,从而诱导肝炎的发生甚至进展成为肝癌[13]。中药斑蝥通过调控上述靶点的表达而发挥抗肿瘤的作用。
KEGG 通路富集显示,斑蝥抗肝癌的关键靶点基因所在的介导的通路可归纳为以下4 类:第1 类与细胞增殖与凋亡相关,如AGE-RAGE 结合可协同诱导MAPK 信号传通路的活化,加速细胞氧化应激,促进细胞增殖[14-15];AGEs-ROS 还能通过介导P38、MAPK和JNK 活化,引起促凋亡的caspase-3 级联反应,诱导细胞凋亡[16-17];TNF-α 通过内质网应激信号通路诱导肿瘤细胞自噬,促进肿瘤增殖[18-19]。第2 类与血管新生途径相关,如VEGF 通过刺激肿瘤血管内皮细胞增殖,调节小静脉血管的渗透性,加速肿瘤细胞的迁移[20-22];CLEC-2 诱导激活的血小板上调整合素和选择素表达使癌栓牢固地黏附于血管内皮,释放炎症因子进而增加血管的通透性,促进肿瘤细胞的外渗和转移[23-24]。第3 类与炎症介导相关,AGE-RAGE 结合促进NF-κB的活化,上调靶基因的转录活性,促进炎性细胞因子IL-6的释放[25-26]。第4 类与细胞黏附相关,如CLEC-2 与配体蛋白结合后,通过激活Ras 家族成员RhoA,促进细胞骨架重组及下调E-钙黏蛋白的表达水平,加速肿瘤的转移[27-28]。因此,斑蝥可能通过调控细胞增殖与凋亡、炎症微环境、血管新生途径及细胞黏附从而起到治疗肝癌的作用,反映了斑蝥多靶点、多通路抗肿瘤的特点。
综上所述,本研究发现斑蝥是通过多种活性成分,调控多个靶点,作用多条通路去实现促进细胞凋亡、抑制血管新生的抗肿瘤作用,其中AGE-RAGE 通路及C型凝集受体通路可作为未来研究斑蝥抗肝癌机制的方向。
