DON通过TNF信号通路诱导驴睾丸支持细胞凋亡的分子机制
2021-09-26张孝忠徐艳刘艺丹孙潇孙玉江张国梁
张孝忠,徐艳,刘艺丹,孙潇,孙玉江,张国梁
(1.青岛农业大学动物科技学院,山东青岛266109;2.荣成市崖头畜牧兽医站,山东荣成264300)
脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)是一种由禾谷镰刀菌产生的霉菌毒素,也被称为呕吐毒素(Vomitoxin)[1]。2017年,我国出台国标规定饲料原料中DON含量不得超过5 mg·kg-1,犊牛、羔羊、泌乳期精料补充料以及猪配合饲料中DON含量不得超过1 mg·kg-1[2]。但关于驴饲草料中DON含量标准一直没有明确规定。江苏奥迈生物科技有限公司2020年9月检测报告表明,全国范围内饲料原料中玉米及玉米副产品DON含量较高,达到1 564.24 μg·kg-1。动物摄入DON后会出现腹泻、呕吐、食欲废绝、肠道出血、代谢紊乱、繁殖性能降低、发育受阻等症状[3]。有报道表明,驴误食霉菌毒素后会发生肺水肿、肝出血、肾水肿、脾淤血、肠道积液等病变,严重时则会导致驴死亡[4-6]。DON具有胚胎毒性,可导致动物母体流产,出现畸胎或死胎[7-8]。DON能抑制蛋白质合成、DNA复制和RNA转录,同时干扰核糖体循环[9]。LAN等[10]的研究表明,DON能通过提高细胞内活性氧诱导小鼠卵母细胞凋亡。最为严重的是,DON具有致癌、致畸、致突变的“三致”作用[9]。1993年国际癌症研究中心将DON列为第三类致癌物质。
根据国家统计局2019年发布数据显示,我国现有驴品种24个,存栏量约260.07万头[11]。随着社会发展,我国驴存栏量逐年大幅下降[12]。目前我国驴的养殖由散养逐渐向集约化饲养转型。我国集约化饲养起步较晚,还有许多技术问题有待解决,而霉菌毒素尤其是DON在饲草料中污染,是驴集约化饲养所面临的主要问题之一。
睾丸支持细胞(Sustentacular cell,Sertoli cell,SC)具有支持、营养、释放、分泌、吞噬等多种功能,是组成血-睾屏障和生精上皮的重要组成部分[13-15],为精子发生和成熟提供了必要环境和营养,同时分泌多种物质确保精子发生[16]。任何影响支持细胞发育、损伤支持细胞功能的因素都会对精子发生产生严重影响[17]。已知DON对雄性动物生殖系统具有毒性作用,但DON毒性机制尚不完全清楚[18-21]。本研究利用RNA-seq分析评估10 μmol·L-1和30 μmol·L-1DON在驴睾丸支持细胞体外培养的毒性反应,为进一步研究DON毒性作用,为国家制定驴饲草料DON含量标准和研究DON对马属动物睾丸发育影响提供理论基础。
1 材料与方法
1.1 主要药品与试剂
DON (A606587-0001)购自生工生物工程股份有限公司;DMSO (D8371)、青-链霉素混合液(PS,P1400)、丙酮酸钠(SP,SP0100)、非必需氨基酸(NEAA,N1250)、透明质酸酶(H8030)、胶原酶Ⅳ (C8160)、Dnase Ⅰ (D8071)均购自索莱宝科技有限公司;FBS (ST30-3302)购自PAN;DMEM/HIGH GLUCOSE (SH30022.01)、0.25 mL·L-1胰酶(SH30042.01)购自Hyclone;TUNEL BrightRed Apoptosis Detection Kit (A113)购自诺唯赞生物科技有限公司;Annexin V-FITC/7-AAD凋亡试剂盒(APK10448-F)购自义翘神州生物技术有限公司;RNAex Pro Reagent (AG21101)购自艾科瑞生物工程有限公司。
1.2 驴睾丸收集与睾丸支持细胞培养处理
取屠宰公驴的睾丸,置于37 ℃含双抗的生理盐水中,30 min内运回实验室。生理盐水冲洗驴睾丸2~3次,无水乙醇中浸泡30 s,无菌磷酸盐缓冲溶液(Phosphate buffer saline,PBS)冲洗3遍,除去白膜,剪取一块睾丸实质,去除可见血管和结缔组织,用含双抗的PBS冲洗后将组织块儿剪碎成1~3 mm2碎块,移入50 mL离心管中,加入3倍体积胶原酶IV与0.2 mL·L-1透明质酸酶混合消化液,37 ℃消化15 min,随时观察曲细精管分散情况;将消化液移入50 mL离心管,加入等体积DMEM/HIGH GLUCOSE培养基,1 200 r·min-1离心5 min,弃上清,重复2次;加入5倍体积37 ℃预热的10 μg·mL-1DNase I与 0.25 mL·L-1胰酶混合消化液,37 ℃培养箱消化5 min,期间每分钟震荡一次,随时观察消化情况;加入等体积含10 mL·L-1FBS的培养液终止消化;通过200目和300目不锈钢细胞筛过滤得到细胞悬液;将得到的细胞悬液1 200 r·min-1离心5 min,使用含10 mL·L-1FBS的DMEM/HIGH GLUCOSE培养液于37 ℃、5% CO2培养8 h后换液。使用10 μmol·L-1和30 μmol·L-1DON连续处理细胞72 h。
1.3 TUNEL检测
收集细胞,使用4 mL·L-1多聚甲醛室温固定30 min,取悬液于APES处理载玻片上,并涂抹均匀,置于42 ℃热台烤干。1 × PBS洗2次,每次5 min。去除多余液体,0.5 mL·L-1Triton X-100通透10 min。1×PBS洗3次,每次5 min。去除多余液体,置于湿盒中保持湿润。按照TUNEL试剂盒说明书进行TUNEL标记,使用Hoechst 33342复染,最后滴加100 μL抗荧光淬灭封片剂,加盖玻片,4 ℃避光保存。620 nm ± 20 nm荧光下观察BrightRed红色荧光,在460 nm荧光下观察Hoechst 33342。
1.4 流式细胞仪检测细胞凋亡
收集细胞,用4 ℃预冷的1×PBS洗细胞2次,300 r·min-1离心5 min弃上清,1×Binding Buffer重悬细胞至细胞密度为1 × 106个·mL-1。设置阴性对照组、单染对照组、试验对照组和试验处理组。取100 μL细胞悬液,加入5 μL Annexin V-FITC及5 μL 7-AAD,轻轻混匀,25 ℃避光孵育15 min。加入400 μL 1×Binding Buffer终止反应,上机检测。
1.5 RNA提取和转录组分析
1 mL RNAex Pro Reagent裂解并收集样本,7 500 r·min-14 ℃离心5 min。取上清加同体积异丙醇,上下颠倒混匀后室温放置10 min。12 000 r·min-14 ℃离心10 min,弃上清。加1 mL 75 % DEPC水配置酒精。短暂涡旋后7 500 r·min-14 ℃离心5 min,弃上清,风干10 min。加30 μL DEPC水溶解RNA。RNA测序由Novogene(中国北京)使用Hiseq 4 000平台进行,每组有3个生物学重复。
1.6 差异表达基因的数据预处理和鉴定
测序数据分组为对照(CTRL)组、10 μmol·L-1处理组、30 μmol·L-1处理组,使用NovoMagic平台对驴睾丸支持细胞进行分析、鉴定差异表达基因(Differential expression gene,DEGs)。使用DEseq2检测差异表达基因。测序时每组有3个生物学重复,设置参数|log 2 FoldChange|>1,Padj<0.05。使用NovoMagic平台对DEGs进行差异表达分析和功能富集分析。
2 结果与分析
2.1 DON暴露诱导驴睾丸支持细胞的凋亡
使用10 μmol·L-1和30 μmol·L-1浓度DON处理体外培养的驴睾丸支持细胞72 h (图1)。TUNEL结果(图1A,图1C)显示DON暴露可导致驴睾丸支持细胞凋亡,其凋亡率:CTRL组为0.7 %±0.1%;10 μmol·L-1DON处理组为11.1 %±0.4%;30 μmol·L-1DON处理组为19.5 %±0.3%,与DON浓度呈正相关。利用流式细胞仪检测凋亡显示DON处理72 h后,10 μmol·L-1DON处理组凋亡率达到2.75%±0.06%,30 μmol·L-1DON处理组凋亡率达到4.22%±0.07%(图1B)。这一结果同样说明DON诱导驴睾丸支持细胞凋亡比例随浓度增加逐渐升高。
2.2 DON暴露改变了驴睾丸支持细胞基因表达
为探究DON对驴睾丸支持细胞中基因表达的影响,我们利用RNA-seq的方法筛选DEGs。与CTRL组相比较,在10 μmol·L-1处理组检测到7 190个DEGs,其中上调DEGs共3 742个,下调DEGs共3 466个;30 μmol · L-1处理组检测到9 336个差异表达基因,其中上调DEGs共5 393个,下调DEGs共3 943个。与10 μmol·L-1DON处理组相比较,在30 μmol·L-1DON处理组中共检测到2 259个DEGs,其中上调DEGs共1 608个,下调DEGs共651个(图2A,2D)。主成分分析(PCA)显示30 μmol·L-1DON处理组比10 μmol·L-1DON处理组距离CTRL组更远(图2B),DEGs热图结果显示30 μmol·L-1DON处理组基因表达差异比10 μmol·L-1DON处理组更显著(图2C),VENN分析结果显示30 μmol·L-1DON处理组差异基因、与10 μmol·L-1DON处理组差异基因存在明显差异(图2D)。因此,30 μmol·L-1DON处理组比10 μmol·L-1DON处理组差异更显著。
2.3 差异表达基因功能分析
为阐明差异表达基因的功能,我们将30 μmol·L-1DON处理组中上调的5 393个DEGs和3 943个下调的DEGs分别进行KEGG (Kyoto Encyclopedia of Genes and Genomes)信号通路富集分析(表1,表2),根据padj<0.05的标准筛选显著性高的信号通路(图3),上调的KEGG信号通路包括TNF信号通路(Padj=0.000 000 251,计数:47)、核因子-κB(Nuclear factor κB,NF-κB)信号通路(padj=0.002 053 236,计数:35)、白介素-17 (IL-17)信号通路(padj=0.000 156 991,计数:35)等信号通路,对KEGG分析结果绘制气泡图(图3A)。下调的信号通路包括内质网中蛋白质合成(padj=0.000 506 098,计数:46)、磷酸戊糖途径(padj=0.010 584 056,计数:12)、类固醇生物合成(padj=0.003 737 77,计数:10)、细胞周期(padj=0.030 698 793,计数:31)等38条信号通路,对前20条信号通路绘制气泡图(图3B)。对TNF信号通路相关基因:TNF,NF-κB信号通路相关基因:NF-κB,内质网中蛋白质合成通路相关基因:二烷基二磷酸低聚糖蛋白糖基转移酶(Dolichyl-Diphosphooligosaccharide-Protein Glycosyltransferase,DDOST)、蛋白二硫化物异构酶A4(Protein disulfide isomerase A4,PDIA4),磷酸戊糖途径相关基因:葡萄糖-6-磷酸脱氢酶(Glucose 6-phosphate dehydrogenase,G6PD),类固醇合成通路相关基因:24-脱氢胆固醇还原酶 (24-dehydrocholesterol reductase,DHCR24)。细胞周期相关基因:细胞周期依赖蛋白CDK2,睾丸癌标志物LIN28A、生长停滞DNA损伤可诱导蛋白Β(growth arrest and DNA damage-inducible geneβ,GADD45B)绘制热图(图4),结果显示30 μmol·L-1DON处理组基因表达差异显著。

表2 KEGG富集分析下调差异表达基因信号通路表Table 2 Differentially expressed gene signaling pathway of KEGG down-regulated enrichment analysis
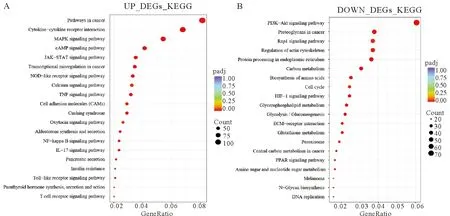
(A)30 μmol·L-1 DON处理组上调DEGs KEGG信号通路富集分析气泡图;(B)30 μmol·L-1 DON处理组下调DEGs KEGG信号通路富集分析气泡图(A)Up-regulated DEGs KEGG signal pathway enrichment analysis bubble map in 30 μmol·L-1 DON processing group;(B)Down-regulated DEGs KEGG signal pathway enrichment analysis bubble map in 30 μmol·L-1 DON processing group图3 对 30 μmol·L-1 DON处理组驴睾丸支持细胞差异表达基因进行KEGG信号通路富集分析结果Fig.3 The results of KEGG signal pathway enrichment analysis on the differential genes expression of donkey sertoli cells in 30 μmol·L-1 DON treatment group
3 讨论
我国是世界上唯一集驴养殖、屠宰、精加工及销售消费于一体的全产业链国家[22]。随着社会发展,驴使役作用降低,全国驴存栏总量迅速下降,饲养方式由散户养驴向集约化饲养迅速转变。集约化养驴为驴养殖业减少成本,提高养驴效率,使得我国养驴业具有较高经济价值与扶贫价值,为我国经济发展作出贡献[23]。同时,我国集约化养驴也伴随着诸多缺陷,饲料中的霉菌毒素特别是 DON 污染对集约化养驴造成了阻碍。本研究使用10 μmol·L-1和 30 μmol·L-1浓度DON体外处理驴睾丸支持细胞72 h,利用RNA-seq分析探究DON体外诱导驴睾丸支持细胞凋亡的分子机制,并通过TUNEL检测,流式细胞检测验证DON诱导驴睾丸支持细胞凋亡率。
TUNEL检测结果和流失细胞检测结果均显示处理组驴睾丸支持细胞凋亡率与DON浓度呈正相关。这一结果与廖美芳[24]等人利用DON处理IPEC-J2细胞诱导凋亡结果一致,也与王琨[25]利用DON处理猪巨噬细胞诱导凋亡结果一致。这一结果说明,DON 对驴睾丸支持细胞呈剂量依赖性趋势发挥毒性作用。流式细胞检测结果在第1象限(即7-AAD单阳性象限)有细胞被检测到,说明该象限应无细胞,故推测这是由于操作不当引起的细胞机械性死亡,与药物处理无关,计算凋亡率应计算第2、3象限(即Annxiv-V、7-AAD双阳性象限和Annxiv-V单阳性象限)之和。细胞凋亡发生途径分为:线粒体途径、死亡受体途径和内质网途径[26]。TNF是激活NF-κB的主要细胞因子,同时TNF也能诱导细胞凋亡和坏死[27-28]。DDOST是内质网中蛋白折叠酶[29]。PDIA4属于蛋白质二硫键异构酶家族,通过羟基-二硫键氧化还原反应参与蛋白质合成过程二硫键形成。TNF信号通路是维持组织稳态和防止炎症病理的关键,与细胞存活和凋亡相关[30]。NF-κB信号通路诱导抗凋亡基因的转录[27]。内质网应激 (包括蛋白合成下降、错误折叠等)会导致细胞内钙超载或失去稳态,进而引起细胞凋亡[31]。DON能通过激活NF-κB/iNOS信号通路诱导细胞凋亡[32]。KEGG分析结果表明TNF信号通路、NF-κB信号通路显著上调(表1,图1),内质网中蛋白质合成信号通路显著下调(表2,图2)。TNF、NF-κB相对mRNA表达量显著升高,DDOST、PDIA4相对mRNA表达量显著降低(图4)。这些结果充分说明DON能通过TNF/NF-κB信号通路诱导驴睾丸支持细胞凋亡,也能通过降低内质网蛋白质合成信号通路,进而引起内质网应激,导致驴睾丸支持细胞凋亡,最终破坏血睾屏障,并影响精子发生。
睾丸支持细胞可分泌多种激素[33]。磷酸戊糖途径能分泌供胆固醇、类固醇等激素合成所需的NADPH+H+,在睾丸中较为活跃[34]。G6PD是磷酸戊糖途径氧化反应阶段的关键酶,能催化葡萄糖-6-磷酸(Glucose 6-phosphate)形成6-磷酸葡萄糖酸-δ-内脂(6-Phosphoglucono-δ-lactonase),进而使NADP+还原形成NADPH+H+[35]。DHCR24催化胆固醇的合成[36]。KEGG分析结果表明,DON显著下调磷酸戊糖途径和类固醇生物合成通路(表2)。G6DP、DHCR24相对mRNA表达量均显著下降(图4)。由此可得,DON能通过抑制磷酸戊糖途径,尤其是NADPH+H+的分泌降低驴睾丸支持细胞类固醇激素合成,抑制睾丸内激素分泌,最终影响睾丸生殖功能。
肿瘤的发展与细胞周期相关[37-38]。KEGG分析结果中细胞周期通路在DON处理组中显著下调(表2),细胞周期依赖蛋白CDK2相对mRNA表达量显著降低(图4)。这一结果与ZHANG等[39]通过玉米赤霉烯酮(Zearalenone,ZEA)处理小鼠卵巢颗粒细胞,导致细胞周期停滞在G1/S期,进而引发颗粒细胞肿瘤发生结果一致。说明DON能通过干扰细胞周期通路,影响细胞周期,诱导驴睾丸支持细胞癌向变化,导致睾丸癌变风险增加。滕鑫等[40]的研究表明LIN28A是睾丸肿瘤标志物。GADD45B基因参与调控细胞周期停滞、DNA损伤修复、细胞生存与凋亡,并与肿瘤转移密切相关,在多种肿瘤中检测到高表达状态[41]。LIN28A、GADD45B基因热图(图4)结果表明其相对mRNA表达量均显著升高,也证实DON能诱导睾丸发生癌向变化。
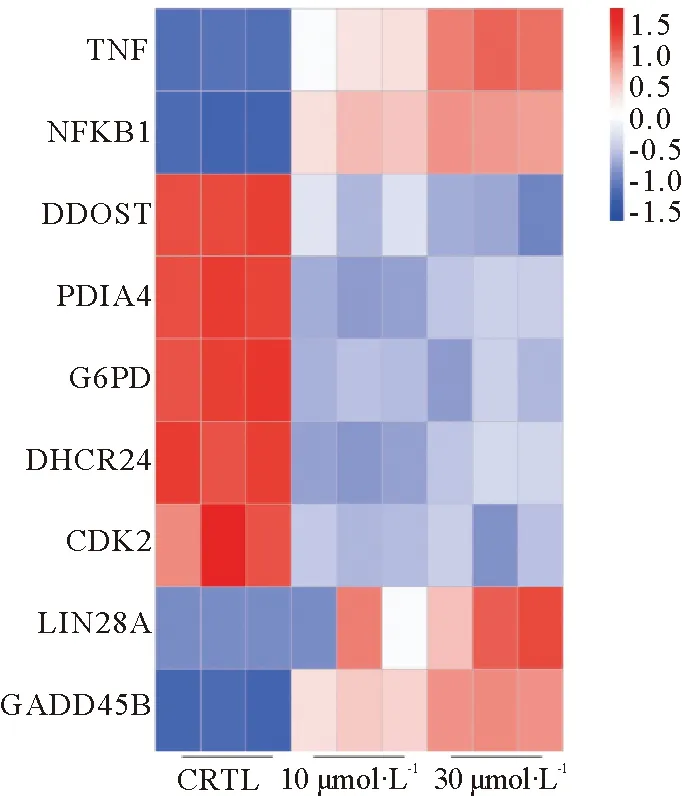
图4 CTRL 组、10 μmol·L-1 DON处理组和30 μmol·L-1 DON处理组中TNF、NF-κB、DDOST、PDIA4、G6PD、DHCR24、CDK2、LIN28A、GADD45B基因热图Fig.4 Gene heat maps of TNF、NF-κB、DDOST、PDIA4、G6PD、DHCR24、CDK2、LIN28A、GADD45B in CTRL group,10 μmol·L-1 treatment group and 30 μmol·L-1 treatment group
KEGG分析结果得知,DON可引起IL-17信号通路、T细胞受体信号通路等炎症相关信号通路上调。此外,KEGG结果显示DON显著下调细胞代谢及DNA复制相关信号通路(表2),诸如:半胱氨酸和蛋氨酸代谢、谷胱甘肽代谢、DNA复制、同源重组等。这些结果表明DON能引起驴睾丸支持细胞的炎症反应,并干扰细胞正常代谢和DNA复制,但其机制有待进一步研究。
综上所述,本次研究首次利用RNA-seq测序分析阐释了DON能通过TNF/NF-κB信号通路和内质网蛋白质合成通路诱导驴睾丸支持细胞凋亡,且呈剂量依赖性发挥毒性作用。DON暴露增加驴睾丸支持细胞激素分泌异常,增加癌向变化风险。DON还能增加睾丸炎症发生,诱导基因突变。提示我们DON暴露会导致公驴血睾屏障破坏,引起生殖功能障碍和精子发生异常,并增加睾丸癌风险,本研究将为后期国家制定驴饲草料DON含量标准提供理论借鉴,并对研究DON对雄性动物睾丸发育影响提供新的研究思路。
