FABP7与TLR4在糖尿病周围神经病变模型小鼠脊髓中的表达
2021-09-26简娇敏
简娇敏,陈 冲,朱 涛
(1.鹰潭市人民医院麻醉科,江西 鹰潭 335000; 2.南京医科大学上海松江临床医学院麻醉科,上海 201600; 3.上海市松江区中心医院麻醉科,上海 201600)
糖尿病周围神经病变(diabeticperipheralneuropathy,DPN)是一种常见的糖尿病并发症,严重影响糖尿病患者的生活质量。CHEN等[1]研究表明位于背根神经节的Toll样受体4(Tolllikereceptor4,TLR4)信号通路参与DPN过程,引起周围神经系统的微炎症反应。脂肪酸结合蛋白7(Fatty acid binding protein 7,FABP7)参与细胞脂肪酸的摄取与运输,维持细胞脂代谢平衡,从而参与细胞代谢与信号转导过程。许多研究[2-3]表明脂肪酸结合蛋白家族(FABPs)参与TLR4信号通路的调控。本研究观察FABP7及TLR4在DPN模型脊髓组织中的表达,为进一步探究FABP7在DPN发展中的作用机制提供参考。
1 材料与方法
1.1 实验动物与分组
SPF级雄性C57BL/6小鼠20只,6周龄,体重18~22 g。均由上海交通大学附属第一人民医院南院实验动物中心提供。动物合格证号:SYXK(沪)2009-0086。在动物中心适应性饲养3 d后,采用随机数字表法分为2组:对照组(Ctrl组)、糖尿病周围神经病变组(DPN组),每组10只。
1.2 主要仪器与试剂
RIPA裂解液、蛋白酶抑制剂和12%聚丙烯酰胺凝胶预制胶购于上海碧云天公司;pH6.0柠檬酸钠抗原修复液购于上海生工公司;GTVision Ⅲ型免疫组织化学检测试剂盒购于上海基因科技公司,货号:GK500705;TNF-αELISA试剂盒购于武汉博士德公司,货号:EK0527;链脲佐菌素购于美国sigma公司,货号:S0130;PGP9.5和FABP7单抗购于英国Abcam公司,货号:ab108986、ab32423;TLR4单抗购于美国Santa cruz公司,货号:sc-293072;actin单抗购于上海碧云天公司,货号:AA128。
1.3 DPN模型的建立
在实验动物中心适应性饲养3 d后,首次测2组小鼠随机血糖、机械缩足反应阈和热缩足潜伏期。禁食12 h后DPN组小鼠腹腔注射链脲佐菌素(STZ)100 mg·kg-1(溶解于pH=4.5柠檬酸钠缓冲液),连续2 d注射[4-5]。第二次腹腔注射STZ后5 d,测小鼠随机血糖>16.9 mmol·L-1(C57BL/6小鼠糖尿病诊断标准为随机血糖>16.9 mmol·L-1)[6]则为糖尿病模型造模成功,将不符合此标准的小鼠排除在外。血糖检测结果显示DPN组10只小鼠随机血糖均>16.9 mmol·L-1,小鼠糖尿病模型造模成功率为100%。明确糖尿病造模成功后,测小鼠行为学机械痛阈、热痛阈的变化,将其与Ctrl组以及自身给药前对比,当差异出现统计学意义时,判断DPN组小鼠发生周围神经病变,继续饲养至给药后10周,以模拟机体长期的高血糖环境。1%戊巴比妥钠溶液(6 mg·kg-1)麻醉下处死小鼠,心脏取血,留取脊髓。Ctrl组小鼠连续2 d腹腔注射与DPN组等容量柠檬酸钠缓冲液,饲养、观察指标同DPN组,饲养10周后处死。
1.4 小鼠体重和随机血糖的检测
体重检测:使用动物体重称对小鼠进行称重,先将动物笼架在体重称上去皮,再将小鼠置于动物笼架内,即得到小鼠的体重。随机血糖的检测:小鼠不禁食禁饮,在每次测量当天上午的9~11点对小鼠进行随机血糖的检测,使用酒精消毒小鼠的尾部,待酒精挥发后使用手术刀片切去小鼠尾端大概1 mm的部分,静待尾端末梢血滴形成,使用血糖仪(美国罗氏公司)检测血糖值,即得到该小鼠随机血糖数值。
1.5 疼痛行为学的测定
于造模前、造模后2、4、6、8、10周参照文献[7]中的方法测定小鼠热缩足潜伏期(TWL)和机械缩足阈(MWT)。TWL测定:使用BME-410C型全自动热痛刺激仪(中国医学科学院生物医学工程研究所)对小鼠后足底部进行照射,记录从开始照射到小鼠出现阳性反应的时间,重复测量3次,每次间隔5 min,取其平均值为TWL。MWT测定:将小鼠置于底部带有铁丝网的有机玻璃箱中,适应15 min后,待小鼠处于安静状态后,使用纤毛刺激针(美国North Coast公司)垂直地作用于后肢足底表面,使纤毛针弯曲并持续2~4 s,直到出现缩足躲避反应,从0.16 g纤维针开始测试,若无阳性反应则用更大一级纤维刺激针刺激,反之则用更小一级纤维刺激针,从第一次出现阳性反应后继续测定5次,每次测定间隔5 min,采用up and down法推算50%MWL。
1.6 免疫组织化学法测定足底表皮神经纤维密度
每组随机选取6例样本。小鼠麻醉后,用直径为2 mm的皮肤活检器转取小鼠左后爪的皮肤组织,常规固定、脱水、石蜡包埋,切10 μm厚度石蜡切片,70 ℃温箱烤片2.0~2.5 h,脱蜡至水,pH 6.0柠檬酸钠抗原修复液微波中火修复12 min,0.3%过氧化氢避光封闭内源性过氧化物酶12 min,PGP9.5一抗(稀释度1:1000,abcam,英国)4 ℃孵育过夜,复温45 min后加入二抗,DAB显色,苏木素复染,脱水,树胶封片。使用ImageProPlus6.0软件分析免疫组化图片,在400倍光镜视野下,每一个样本随机选择不少于6个视野。根据KOSKINEN等[8]的计算方法得到足底表皮纤维神经密度(IENFD)。
1.7 Westernblot法测定脊髓组织FABP7和TLR4的表达
最后一次小鼠行为学测试后,取小鼠脊髓。检测时加入预冷的RIPA裂解液和蛋白酶抑制剂(上海碧云天生物技术有限公司),匀浆,4 ℃下12 000 r·min-1离心20 min,取上清,BCA蛋白定量后分装,-80 ℃保存。12%聚丙烯酰胺凝胶电泳分离蛋白质,并转移到膜上;5%脱脂奶粉室温封闭2 h;4 ℃一抗(FABP7 1:250;TLR4 1:200;Actin 1:1000)孵育过夜,洗膜后二抗(1:10 000)孵育2 h,ECL显色,Bio-Rad凝胶成像系统检测分析。
1.8 ELISA法测定血浆与脊髓组织中TNF-α的水平
小鼠麻醉后,心脏取血,4 ℃下3000 r·min-1离心15 min,取上清-80 ℃保存;脊髓组织裂解、匀浆、离心后取上清液,BCA蛋白定量后分装。按照TNF-α ELISA试剂盒(博士德生物工程有限公司)说明书使用ELISA法检测血浆与脊髓组织中TNF-α的水平。
1.9 统计学方法
2 结果
2.1 2组体重与随机血糖的比较
0周时,2组小鼠体重差异无统计学意义(P>0.05);2、4、6、8和10周DPN组小鼠体重均小于Ctrl组(P<0.01)。0周时,2组小鼠随机血糖差异无统计学意义(P>0.05);2、4、6、8和10周时DPN组小鼠随机血糖显著高于Ctrl组(P<0.01)。见图1。
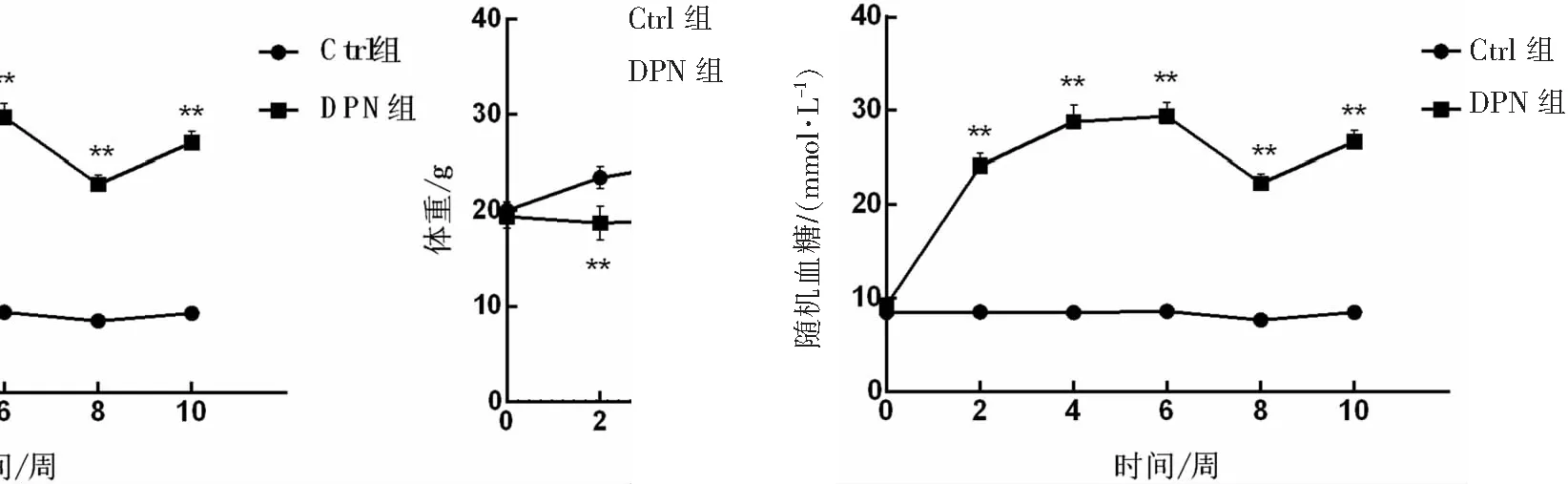
**P<0.01与Ctrl组比较。n=10。
2.2 2组TWL和MWT的比较
0和2周时2组小鼠TWL差异无统计学意义(P>0.05);4、6、8和10周时DPN组小鼠TWL明显高于Ctrl组(P<0.01)。造模后2、4、6、8、10周DPN组小鼠MWT明显低于Ctrl组小鼠(P<0.05)。见图2。

*P<0.05、**P<0.01与Ctrl组比较。n=10。
2.3 2组IENFD的比较
每组选取6例样本,Ctrl组和DPN组IENFD分别为(549.88±179.47)根·mm-2、(324.28±114.45)根·mm-2,2组比较差异有统计学意义(P<0.05)。见图3。
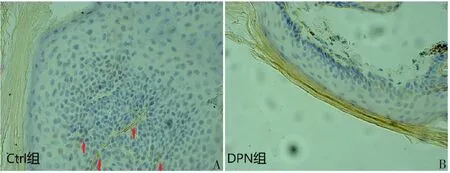
A:Ctrl组;B:DPN组。红色箭头所指为皮内神经纤维显色。
2.4 2组脊髓组织中FABP7、TLR4蛋白的表达
Western blot结果显示,与Ctrl组比较,DPN组脊髓组织中FABP7、TLR4表达均升高(均P<0.05)。见图4。
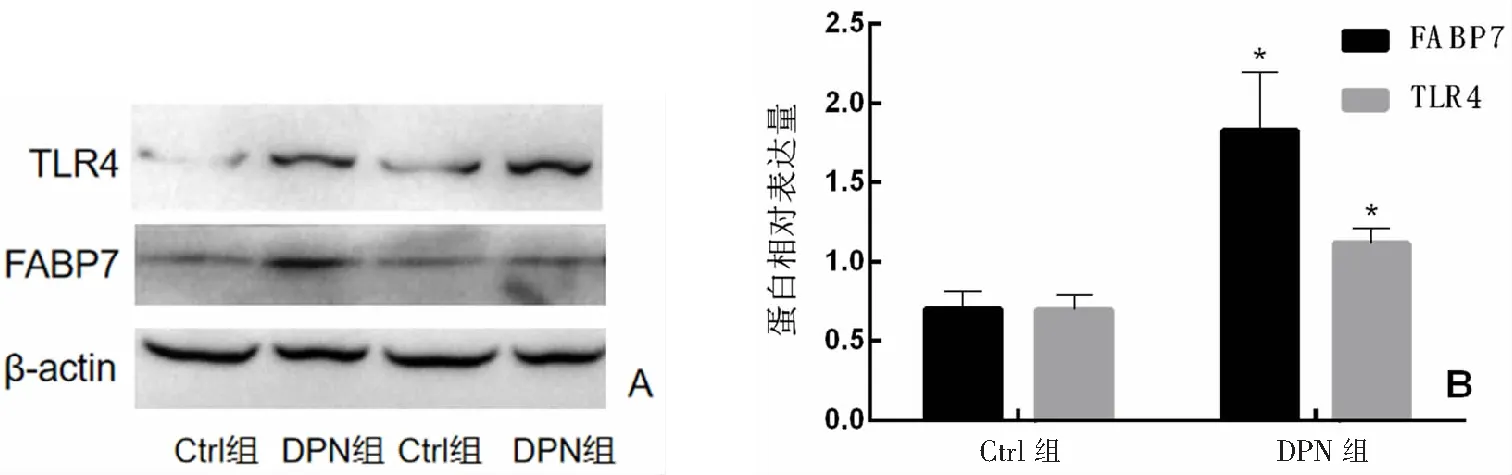
A:Western blot图;B:蛋白相对表达分析柱状图,*P<0.05与Ctrl组比较,n=10。
2.5 2组血浆与脊髓组织中TNF-α水平
ELISA结果显示,与Ctrl组比较,DPN组血浆与脊髓组织中TNF-α水平明显升高(均P<0.05)。见图5。
3 讨论
FABP7蛋白主要分布于中枢神经系统的星型胶质细胞以及少突胶质细胞,其目前研究的方向主要集中于胞内脂代谢的平衡方面,而DPN又是糖尿病患者非常常见且严重影响生活质量的并发症。本课题组前期研究[9-10]证实TLR4信号通路在DPN患者与动物模型中呈活化状态,而有研究[2]表明FABP7可调节TLR4信号通路的活化,提示在DPN病变中FABP7蛋白可能也起着非常重要的作用。
本研究采用连续2 d腹腔注射STZ的方法[4]制备I型DPN小鼠模型。与Ctrl组比较,DPN组小鼠随机血糖升高、TWL明显升高、MWT明显下降以及足底表皮内的IENFD明显降低,这些结果表明DPN组小鼠存在周围神经病变,DPN模型造模成功。
多项研究[9-10]证实TLR4信号通路参与DPN的进展。CHEN等[1]研究显示DPN模型大鼠的背根神经节中TLR4信号通路激活。本课题组先前的研究[9]也证实DPN患者外周血单核细胞上TLR4受体发生活化。本研究结果显示DPN模型小鼠脊髓组织中TLR4受体表达升高,表明TLR4参与DPN。KAGAWA等[2]研究表明FABP7可增加小窝蛋白1(caveolin,CAV-1)的表达来调控脂筏的功能,进而促进细胞膜脂筏上TLR4的募集以及TLR4信号通路的激活。本研究结果显示,DPN小鼠脊髓中FABP7和TLR4表达均升高,笔者推测,FABP7可能是通过调节CAV-1的表达进而调控TLR4信号通路以参与DPN进程。
脊髓中星型胶质细胞与小胶质细胞的活化参与DPN发生与发展过程。有研究[11]表明TLR4与星型胶质细胞的活化相关,TLR4可使小鼠脊髓组织中星型胶质细胞活化,参与小鼠慢性神经病变过程;敲除星型胶质细胞上的TLR4后星型胶质细胞的活性受抑制,改善了中枢神经系统损伤与炎症[12]。KAMIZATO等[13]研究认为,FABP7可能通过调节星型胶质胞内纤连蛋白的产生从而调控星型胶质细胞的活性。本研究结果显示DPN组小鼠脊髓组织FABP7、TLR4表达量升高,其可能原因是FABP7调节星型胶质细胞上的TLR4下游相关通路被激活,星形胶质细胞活化,从而参与DPN病程。TLR4活化后相关下游炎症通路活化,炎症因子的释放使得细胞炎症反应加重。本研究结果显示DPN组脊髓组织中TNF-α较Ctrl组升高;血浆的TNF-α表达显著升高。提示存在脊髓组织与外周血中炎症状态激活,脊髓组织中的神经炎症反应参与DPN病变;外周血中释放的炎症因子经循环可作用于周围神经及血管,促进及加重周围神经病变的形成。
FABP7表达于成熟中枢神经系统的星型胶质细胞与前体少突胶质细胞胞质中,参与多不饱和细胞脂肪酸的摄取与运输,维持细胞脂代谢平衡,进而参与细胞代谢与信号转导过程。MIAO等[14]研究表明,脂肪细胞FABP的特异性拮抗剂可通过调节TLR4信号通路的功能来减轻高脂饮食动物模型的炎症状态。饱和的长链脂肪酸可激活TLR4及其下游通路[15],引起细胞的炎症反应。而多不饱和脂肪酸二十二碳六烯酸(DHA)通常起抑炎作用,DHA是一种n-3型多不饱和脂肪酸。有研究表明[16]当外源性地添加DHA时,DHA会特异性的聚集于细胞磷脂膜上,可竞争性地抑制胞膜上LPS的配体TLR4的募集,进而起到抑制炎症反应的作用。本研究结果显示模型组FABP7表达增高,可能导致胞膜上的不饱和脂肪酸运输加快,胞膜上聚集的不饱和脂肪酸减少,导致其对胞膜上TLR4受体的抑制募集作用减弱,从而引起TLR4及其下游通路的激活。
综上所述,DPN小鼠模型中脊髓组织FABP7、TLR4表达均增高,提示FABP7参与DPN发病,可能与FABP7调控TLR4受体有关。基于FABP7调控TLR4可能通过多种机制影响DPN的进程,其更深入的作用机制仍需要进一步研究。
