哌柏西利联合内分泌治疗晚期激素受体阳性乳腺癌的真实世界研究
2021-09-26徐君南曹慧姜雨君李欢董方圆段羊羊井明晰郭翔宇孙涛
徐君南 曹慧 姜雨君 李欢 董方圆 段羊羊 井明晰 郭翔宇 孙涛
乳腺癌是我国女性发病率最高的恶性肿瘤[1]。近年来,CDK4/6抑制剂等新药的出现开启了晚期乳腺癌靶向联合内分泌治疗的新篇章。CDK4/6抑制剂在内分泌敏感和内分泌耐药人群的Ⅲ期临床试验中均显示出临床获益。在Ⅲ期双盲PALOMA-2试验中,未接受全身治疗的HR+/HER2−晚期乳腺癌(advanced breast cancer,ABC)患者接受哌柏西利和来曲唑治疗后显著延长了中位无进展生存期(mPFS)(24.8个月vs14.5个月)[2]。在Ⅲ期双盲 PALOMA-3试验中,先前内分泌治疗期间进展或复发的患者采用氟维司群联合哌柏西利或氟维司群联合安慰剂治疗后中位总生存期(mOS)分别为34.9个月和28.0个月[3]。基于这些结果,NCCN指南和中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2020)提出CDK4/6抑制剂联合内分泌治疗是无内脏危象的HR+/HER2-ABC患者的优选方案[4]。但是PALOMA-2和PALOMA-3试验的疗效结局在亚洲患者(分别为95例和105例)和非亚洲患者(分别为571例和416例)中无显著差异[5-6]。哌柏西利(Palbociclib,Ibrance)在国内上市已接近3年,国内外的真实世界研究也陆续报道哌柏西利表现出较好的疗效和耐受性。本研究回顾性分析83例HR+/HER2-ABC患者的临床资料,探讨哌柏西利联合内分泌治疗在国内真实世界研究的疗效,为哌柏西利联合内分泌治疗的进一步临床应用提供依据。
1 对象与方法
1.1 病例选择
采用本科室乳腺癌病案随访系统,以“哌柏西利”或“爱博新”为关键词进行检索,回顾性收集2018年9月15日至2020年10月30日于辽宁省肿瘤医院接受哌柏西利联合内分泌治疗的HR+/HER2-ABC患者。入组标准:⑴经组织病理学检查确诊为乳腺癌;⑵局部复发或远处转移,其中也包括脑转移和仅有骨转移;⑶经穿刺再活检或既往手术病理证实雌激素受体阳性;⑷经过多线内分泌治疗、化疗和依维莫司等治疗;⑸具有完整的医疗病史记录。排除标准:⑴哌柏西利用药时间因经济原因2个周期内未评价疗效,即出现哌柏西利用药中停;⑵随访时间短于3个月的未评价疗效患者;⑶失访或无法获取完整信息的患者。
1.2 治疗方案
哌柏西利的初始剂量取决于患者的病情和身体状态,从最初剂量125 mg或100 mg开始,持续21 d,停7 d(28 d为1个周期)。若不良反应无法耐受,则考虑减量或停药。内分泌药物的选择由临床医师根据患者情况决定,其中芳香化酶抑制剂(aromatase inhibitor,AI)为来曲唑、阿那曲唑、依西美坦,选择性雌激素受体下调剂(selective estrogen receptor down-regulators,SERD)类药物为氟维司群,选择性雌激素受体调节剂(selective estrogen receptor modulators,SERM)类药物为他莫昔芬、托瑞米芬。
1.3 疗效评价
治疗前进行影像学检查,2~3个月复查1次。根据实体瘤疗效评价标准(RECIST)1.1版[7]评价疗效,包括完全缓解(CR):所有靶病变消失;部分缓解(PR):基线病变直径总和减少≥30%;疾病进展(PD):基线病变直径总和增加≥20%或出现新病灶;稳定疾病(SD):不符合标准PR或PD。客观有效率(ORR)=(CR+PR)×100%;疾病控制率(DCR)=(CR+PR+SD)×100%,其中SD持续时间至少16周。采用病例系统随访或电话随访。无进展生存期(PFS)定义为开始使用哌柏西利治疗至第一次发生疾病进展或因任何原因死亡的时间。总生存期(OS)定义为开始使用哌柏西利治疗至死亡或末次随访之日的时间。
1.4 统计学方法
采用SPSS 22.0软件进行数据分析。采用Kaplan-Meier法绘制生存曲线,组间比较采用log-rank检验。采用Cox比例风险回归模型进行风险比(HR)计算以及PFS的多因素分析。采用χ2检验比较初始剂量组间不良反应(AEs)的分布差异。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 基线特征
2018年9月至2020年10月,本中心共接收103例接受哌柏西利联合内分泌治疗的HR+/HER2−ABC患者。随访截至2020年12月15日,中位随访时间为15.5个月(范围:2.0~33.5个月),失访率为8.7%(9/103),其中4例患者因用药时间短(因经济原因哌柏西利用药小于2个周期)、7例患者因随访时间不足未纳入分析,最终共83例患者纳入本研究。入组83例患者中位年龄为57岁(范围:33~81岁);哌柏西利联合内分泌一线治疗25例,二线治疗38例,三线或后续治疗20例;联合AI 44例,联合氟维司群36例,联合托瑞米芬或他莫西芬3例。哌柏西利的初始剂量取决于患者病情和身体状态,其中79例患者初始剂量为125 mg,每日1次;体质指数(BMI)较低的4例患者初始剂量为100 mg,每日1次。18.1%(15/83)的患者因经济原因使用哌柏西利超过2个周期后出现中停哌柏西利用药,继续内分泌单药治疗。见表1、图1。

表1 HR+/HER2-ABC哌柏西利真实世界研究人群的基线特征[n(%)]Tab.1Baseline characteristics of the HR+/HER2-ABC Palbociclib real world research population[n(%)]
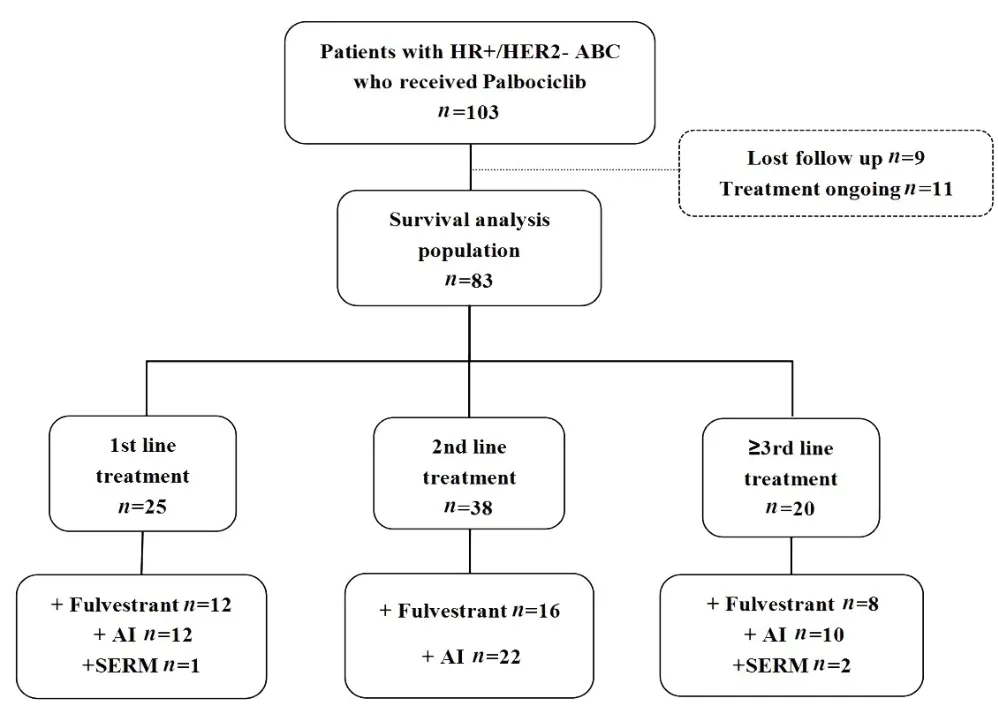
图1 83例HR+/HER2-ABC患者的入组情况Fig.1 Flowchart of 83 patients with HR+/HER2-ABC
2.2 近期疗效
83例患者均完成疗效评估,接受哌柏西利一线治疗的25例患者中,获PR 12例(48.0%)、SD 12例(48.0%)、PD 1例(4.0%),ORR为48.0%(12/25),DCR为96.0%(24/25)。二线治疗的38例完成疗效评估患者中,获PR 17例(44.7%)、SD 17例(44.7%)、PD 4例(10.5%),ORR为44.7%(17/38),DCR为89.5%(34/38)。三线及后续治疗的20例患者中,获PR 6例(30.0%),SD 10例(50.0%),PD 4例(20.0%),ORR为30.0%(6/20),DCR为80.0%(16/20),一线和二线应用哌柏西利联合内分泌治疗的患者ORR较三线及后续治疗患者高,但差异无统计学意义(P=0.466);三组患者的DCR比较差异也无统计学意义(P=0.337)。见图2。
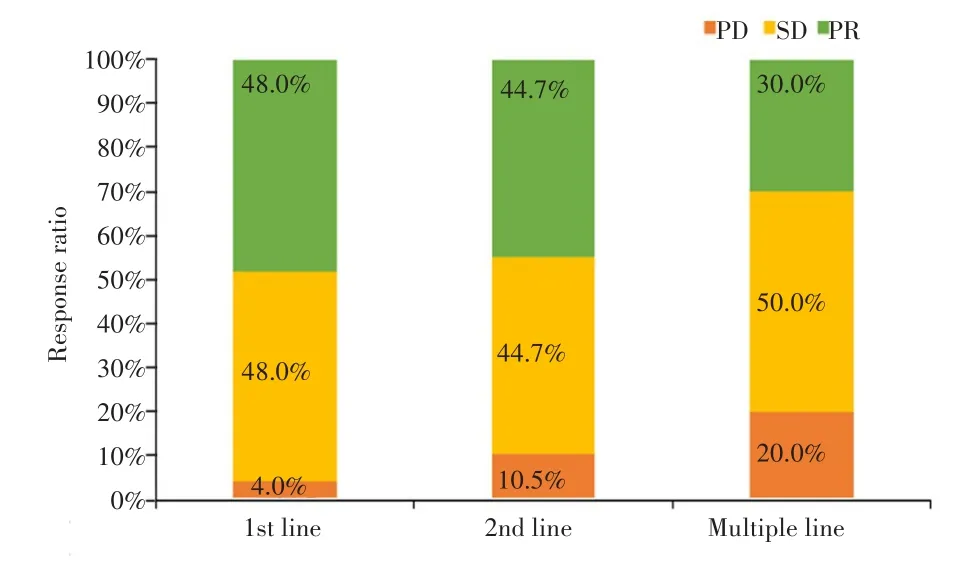
图2 83例HR+/HER2-ABC患者接受哌柏西利联合内分泌治疗的疗效Fig.2 Response to Palbociclib combined with endocrine therapy of 83 patients with HR+/HER2-ABC
2.3 哌柏西利联合内分泌治疗线数与HR+/HER2−ABC患者PFS的关系
全组患者接受哌柏西利联合内分泌治疗的mPFS为13.0个月(95%CI:11.4~14.6个月),见图3A。患者接受哌柏西利联合氟维司群治疗的mPFS为11.0个月,接受哌柏西利联合AI或SERM治疗的mPFS为15.0个月(HR=0.73,95%CI:0.42~1.29,P=0.15),见图3B。一线、二线及多线(三线及以上)接受哌柏西利联合内分泌治疗患者的mPFS分别为20.0个月、14.0个月、5.0个月,一线、二线较多线治疗患者获益更多(P<0.001),见图3C。

图3 哌柏西利联合内分泌治疗线数与HR+/HER2-ABC患者PFS的关系Fig.3 The relationship between the number of lines of Palbociclib plus endocrine therapy and PFS of HR+/HER2-ABC patients
2.4 哌柏西利联合内分泌治疗患者转移灶状况与PFS的关系
在整个队列中,无内脏转移患者的mPFS优于存在内脏转移患者,但差异无统计学意义(20.0个月vs13.0个月;HR=0.65,95%CI:0.35~1.22,P=0.38),见图4A。肝转移患者(n=21)和非肝转移患者(n=62)的mPFS差异亦无统计学意义(13.0个月vs14.0个月;HR=0.93,95%CI:0.49~1.76,P=0.43),见图4B。肺转移(n=35)和无肺转移(n=48)患者的mPFS均为13.0个月,两组差异无统计学意义(HR=1.00,95%CI:0.55~1.82,P=0.57),见图4C。22例仅骨转移患者的mPFS较非骨转移患者获益更显著(未达到vs13.0个月;HR=0.42,95%CI:0.22~0.84,P=0.01),见图4D。
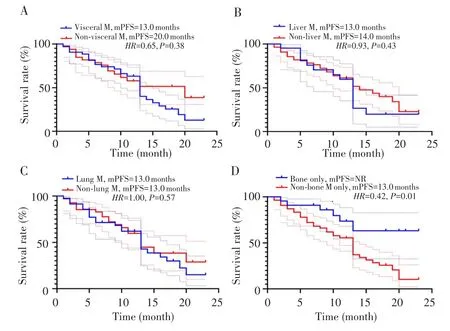
图4 不同转移部位患者接受哌柏西利联合内分泌治疗的无进展生存曲线Fig.4 Kaplan-Meier curves of progression-free survival in different metastases sites for Palbociclib plus endocrine therapy
2.5 依维莫司进展后哌柏西利治疗的PFS
本研究中,多线治疗患者既往应用内分泌治疗方案多样,其中9例患者既往曾应用依维莫司,进展后用哌柏西利联合内分泌治疗,44.4%(4/9)的患者从多线哌柏西利联合方案中仍获益超过9个月,mPFS为5个月,见图5。其中从哌柏西利治疗获益最长PFS(20个月)的患者,既往二线依维莫司联合依西美坦治疗PFS仅为1个月,因不能耐受停药后继续采用依西美坦治疗,结果获益2年,后续采用氟维司群和托瑞米芬治疗分别获益11个月和15个月;其余3例患者分别从依维莫司获益7个月、6个月和19个月后,多线应用哌柏西利1~2个月出现进展,回顾其中2例患者既往二代测序技术(NGS)检测结果,发现应用依维莫司前患者均存在FGFR1扩增。
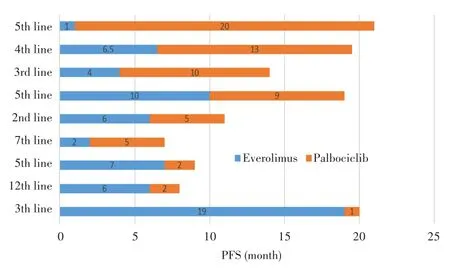
图5 依维莫司治疗进展后采用哌柏西利治疗的PFSFig.5 Progression-free survival of patients treated with Palbociclib after the progress of Everolimus treatment
2.6 安全性
83例患者中,出现不良反应82例,最常见和严重(3~4级)的不良反应均是中性粒细胞减少症。76例(91.6%)出现中性粒细胞减少,其中3级中性粒细胞减少26例(31.3%),4级中性粒细胞减少2例(2.4%)。基于前期临床试验不良反应的精细管理经验和地榆升白片等升白药物的同步使用,共12例(14.5%)因不良事件减少哌柏西利剂量。其他血液学毒性包括贫血(16例,19.3%)和血小板减少(39例,47.0%),非血液学毒性包括乏力、脱发和口炎,主要为1~2级,见表2。
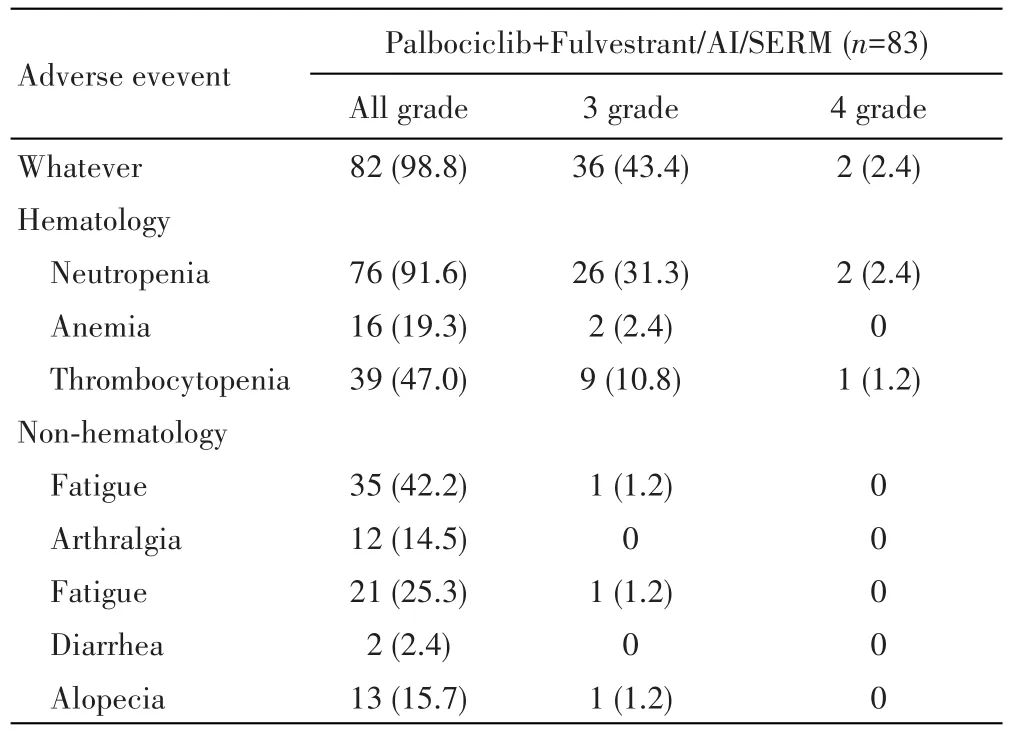
表2 哌柏西利联合内分泌治疗的不良反应[n(%)]Tab.2 Adverse events in population treated with Palbociclib plus endocrine therapy[n(%)]
3 讨论
在临床实践中,伴随的医疗条件和依从性问题,患者的管理相对复杂。与严格监控的前瞻性临床试验设置不同,真实的数据更能反映临床实践中应用新药患者的疗效和急性/慢性不良事件的准确信息。本研究主要分析本中心HR+/HER2−ABC患者采用哌柏西利联合内分泌治疗的真实一/二线及多线治疗的疗效及毒性数据。在83例HR+/HER2−ABC应用哌柏西利联合内分泌治疗的真实世界研究中,本研究发现这一方案临床疗效显著,尤其是一/二线治疗取得良好疗效,安全性也良好。在PALOMA-2研究中哌柏西利联合AI的mPFS(27.6个月)明显延长,毒性可耐受,且生活质量与单独AI相似[2,8]。MONALEESA-3和MONALEESA-7研究也证实与单纯内分泌治疗相比,CDK4/6抑制剂Ribociclib联合治疗能显著延长OS[9-11]。一项Ⅲ期研究 MONARCH 3也证实Abemaci-clib联合AI可以显著延长患者的mPFS(28.18个月vs14.76 个月,HR=0.54)[12]。此外,一项哌柏西利联合来曲唑对照来曲唑的真实世界研究也证实联合治疗可以显著提高患者的OS(未达到vs43.1个月)[13]。国内陆续发表的真实世界研究中,一线哌柏西利联合治疗的PFS更佳,其中刘宣辰等[14]报道78例HR+/HER2−ABC一线治疗的mPFS未达到,二线及多线治疗的mPFS分别为7个月和3个月。
本真实世界研究中一/二线应用哌柏西利联合治疗ORR高达48.0%和44.7%,与PALOMA-2研究中意向治疗人群的ORR(42.1%)以及亚洲人群(49%,n=65)相当。与一/二线治疗组相比,本队列中20例以哌柏西利作为多线治疗的患者尽管疾病控制仍然显著,但获益明显降低。相比之下,PALOMA-3试验显示意向治疗人群的ORR为19%,临床受益率约为65%,mPFS为9.5个月。LIU等[15]则报道一线治疗的ORR为30.8%,二线和多线ORR仅为2.6%和2.2%。刘宣辰等[14]也报道一线治疗的ORR高达71.4%,而二线及后线治疗仅为6.3%。本研究多线治疗的疗效与PALOMA-3、国内真实世界研究相比略高,可能与本研究样本量相对较小有关。在选择联合内分泌治疗药物上,本研究选择氟维司群或AI,结果发现两者联合的疗效无明显差异,与PARSIFAL研究结论一致,ISIR等真实世界研究也显示相似结果[16]。其中我国的真实世界研究中,总体mPFS为9.2个月,哌柏西利联合SERD药物的mPFS最佳(14.2个月)、联合AI次之(9个月),而联合SERM类的mPFS仅为2.9个月[15]。
研究显示,乳腺癌内分泌治疗后耐药可能与PI3K/AKT/m-TOR信号传导通路激活有关。BOLERO-2研究证实依维莫司联合依西美坦的mPFS明显延长(11个月vs4.1个月)[17]。SHAO等[18]报道国内真实世界研究中携带PIK3CA突变的7例患者mPFS仅为3个月,显著低于总人群mPFS(8个月)。本研究中,9例患者既往曾应用依维莫司,进展后用哌柏西利联合内分泌治疗,其中44.4%的患者从多线哌柏西利联合方案中仍获益超过9个月以上。有研究报道,携带FGFR1扩增可能是哌柏西利耐药的原因,在PALOMA-3生物标志物分析中也显示,FGFR1扩增与哌柏西利原发耐药相关[19-21],MONALEESA 研究耐药分析也发现携带FGFR1扩增的患者abemaciclib疗效不佳[22]。本研究回顾多线应用哌柏西利治疗1~2个月后进展的2例患者,既往NGS检测也发现依维莫司应用前存在FGFR1扩增[23]。以上说明,需要针对罕见突变及疗效预测进行大样本研究,尤其是NGS检测后出现的多基因并行变异,值得进一步深入探讨。
安全性方面,在内分泌治疗中加入CDK4/6抑制剂可以显著改善临床预后,但也会随之增加不良事件的发生率。本研究中,哌柏西利的初始剂量(125 mg QD)应用比例较高,仅4例患者初始应用100 mg。基于前期参与多项CDK4/6抑制剂临床试验不良反应的精细管理经验,并同时使用地榆升白片等,本研究中仅有12例(14.5%)因不良事件减少哌柏西利剂量。在研究中严重不良事件的发生率为43.4%,低于PALOMA-2和PALOMA-3研究中在亚洲人群及真实世界研究中观察到的情况[5,6,24]。
综上所述,本研究结果显示一线/二线使用哌柏西利联合内分泌治疗HR+/HER2−ABC患者具有显著疗效;既往曾接受依维莫司治疗或多线治疗进展患者仍能从哌柏西利治疗中获益。但本研究为单中心、小样本研究,且随访时间较短,因此研究结论仍有待进一步证实。
