基于生物信息学方法鉴定宫颈癌的生物标志物微管相关蛋白7
2021-09-25欧婷瑜莫丽何琦
欧婷瑜,莫丽,何琦
(广西壮族自治区南宁市第二人民医院 妇科,广西 南宁 530031)
0 引言
宫颈癌是最常见的妇科恶性肿瘤之一,也是女性癌症死亡的第四大原因。2020年全球统计数据显示,每年有近60.4万宫颈癌新发病例,34.2万例宫颈癌患者死亡[1]。其主要病理类型包括鳞状细胞癌、腺癌、腺鳞癌等。尽管通过手术、放疗等手段不断提高了宫颈癌的早期治愈率,但仍有近30%的患者因复发或远处转移而死亡[2]。对于复发和转移的病例治疗手段有限,且治疗效果不理想。因此,寻找宫颈癌进展的生物标志物及其确切分子机制有助于疾病的诊断和治疗策略的选择。
近年高通量测序和微阵列技术的出现推动了精准医疗的发展,不断增加的大数据积累开辟了新的研究途径。识别新的生物标志物,使得宫颈癌的个性化治疗策略成为一个重要话题,也是对复发或转移高危宫颈癌患者群体进行分层选择靶向治疗的先决条件。微管相关蛋白(microtubule associated protein,MAP)是一种细胞骨架与微管相互作用形成的蛋白质,其微管相互结合并与微管表面相互作用有着稳定微管的功能[3],参与细胞分裂和分化等重要的细胞过程。MAP7在微管成束和动态调控中起着至关重要的作用。据报道,MAP7表达上调与结直肠癌、急性粒细胞性白血病、胃癌等多种癌症预后相关[4]。本研究通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库鉴定MAP7在宫颈癌中的表达特征,并深入分析其生物学功能。
1 资料与方法
1.1 数据获取与预处理。从TCGA官网下载宫颈鳞状细胞癌和宫颈腺癌(CESC)转录组数据以及临床信息,通过R 4.0.4软件将芯片信息转换为基因名称,与样品名合成基因表达矩阵,并提取生存时间、生存状态、疾病状态、年龄、病理分级、组织学类型、临床分期、TMN分期等相关临床信息。
1.2 基因差异分析。利用R 4.0.4软件“limma”工具包提取MAP7基因的表达数据,采用wilcox检验对比分析正常组织与宫颈癌组织中的基因表达差异,P<0.05提示有统计学意义。并利用人类蛋白质图谱(the Human Protein Atlas,HPA)网站比较正常组织与肿瘤组织的MAP7蛋白表达差异。
1.3 生存分析。根据MAP7基因表达情况以中位值为界限,分为高、低表达两组,并通过R4.0.4软件“survival”工具包对进行Kaplan-Meier分析,P<0.05提示有统计学意义。
1.4 临床相关性分析。整合基因表达与样品临床信息,并将各临床病理特征整理划分为二分类变量,运用R 4.0.4软件logit函数进行逻辑回归分析,探索MAP7与各临床特征的相关性,P<0.05提示有统计学意义。
1.5 独立预后分析。采用单因素和多因素Cox比例风险回归分析,检测整个宫颈癌患者队列中临床病理特征及MAP7的基因表达是否是疾病预后的独立变量,并通过R 4.0.4软件“survival”工具包实现。P<0.05提示有统计学意义。
1.6 功能富集分析。对MAP7进行基因功能集富集分析(Gene Set Enrichment Analysis,GSEA),利用GSEA_4.1.0软件及“c2.cp.kegg.v7.4.symbols”为背景,以P<0.05并且FDR校正P<0.05为条件筛选出显著富集的通路。
2 结果
2.1 MAP7在宫颈癌组织中的表达情况。与正常组织(n=3)相比,MAP7在宫颈癌组织(n=306)中高表达(P=0.003,图1A)。HPA数据库的免疫组织化学(immunohistochemistry,IHC)分析结果显示MAP7在宫颈癌组织中表达较高,在正常组织中表达较低(图1B)。
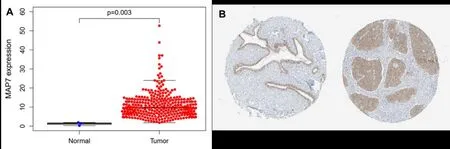
图1 MAP7在正常组织及宫颈癌组织中的表达情况
2.2 不同MAP7表达水平宫颈癌患者的生存分析。我们以MAP7表达中位值为截断,将宫颈癌患者划分为高、低表达两个亚组,结合总生存时间(overall survival,OS)进行Kaplan-Meier分析,结果表明MAP7高表达组总生存率更低,MAP7低表达组具有更长的生存时间(P=0.011,图2),说明MAP7的表达水平与宫颈癌预后相关。
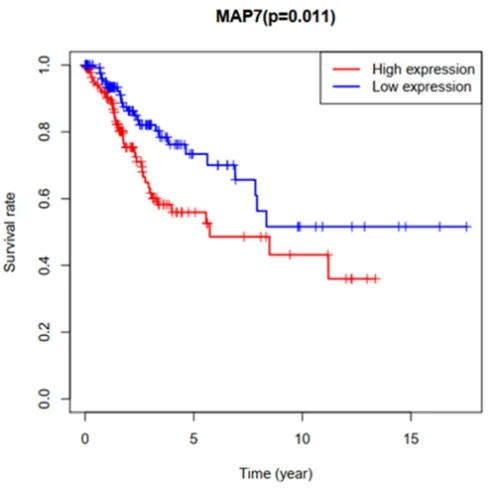
图2 MAP7高、低表达组宫颈癌患者的生存分析
2.3 MAP7与宫颈癌的临床相关性。逻辑回归分析结果显示,MAP7的表达与疾病状态(无病生存,复发或进展)密切相关(P<0.05)。然而,MAP7在年龄、病理分级、组织学类型、临床分期、TMN分期不同亚组中的表达比值比(odds ratio,OR)(P>0.05,表1),说明MAP7的表达水平与疾病进展相关。
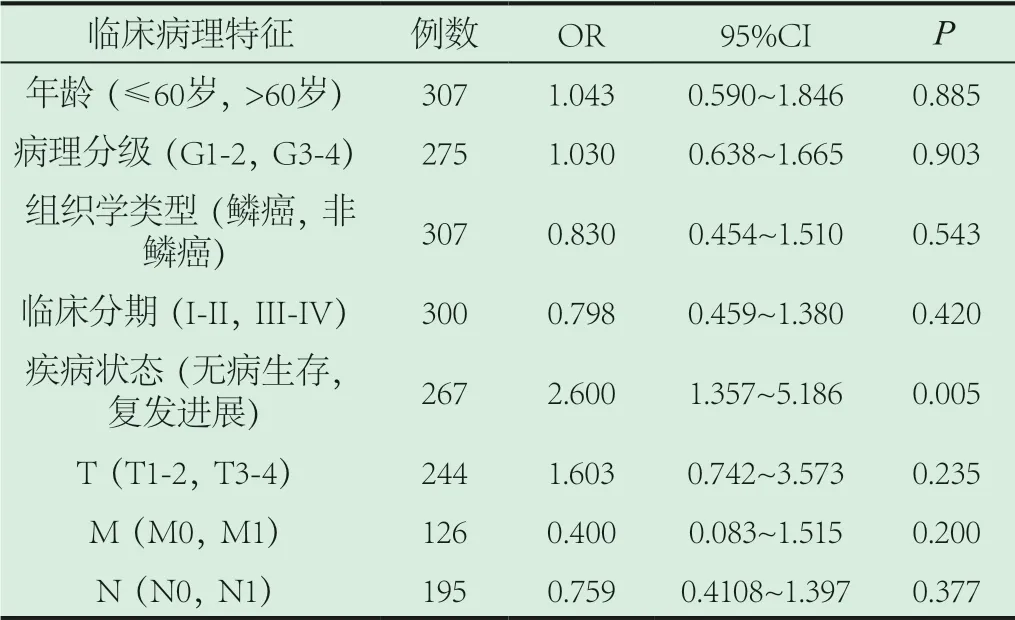
表1 MAP7与宫颈癌临床病理特征的关系
2.4 MAP7在宫颈癌中的预后价值。在单因素Cox回归分析中,临床分期与MAP7与生存相关,MAP7的风险比(hazard ratio,HR)及95%可信区间(confidence interval,CI)为1.039(1.012~1.066,P<0.05)。在多因素Cox回归分析中,该基因的HR为1.041,95%CI 1.012~1.070(P<0.05,表2)。结果说明MAP7可作为宫颈癌的独立预后因子。
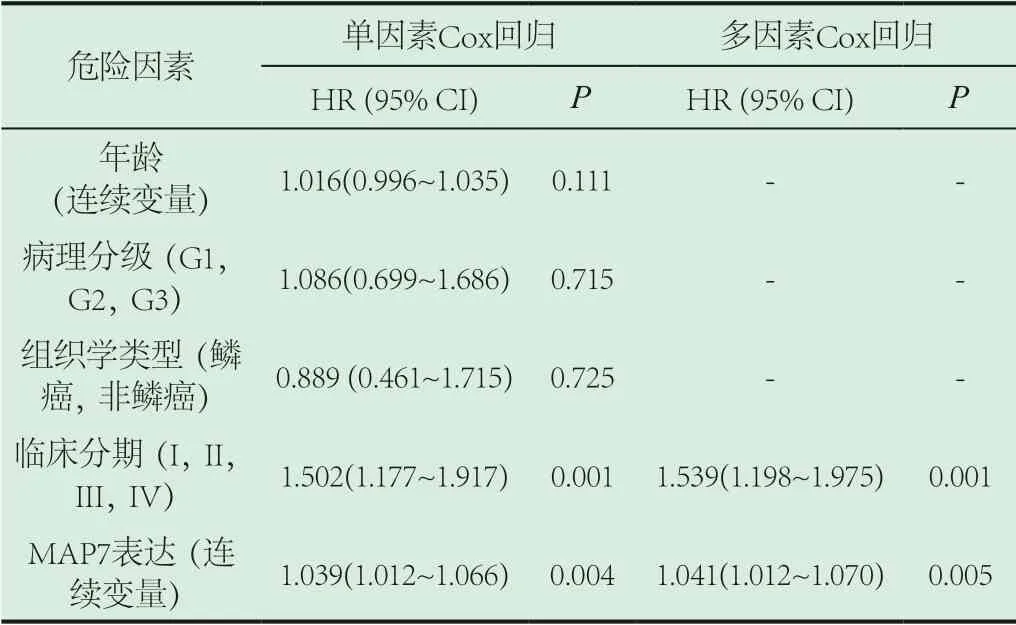
表2 MAP7与宫颈癌临床病理特征的独立预后分析结果
2.5 MAP7的相关分子机制。通过GSEA分析挖掘MAP7潜在的功能信号通路及生物学作用。结果显示,在MAP7高表达组中,黏着连接、ERBB信号通路、泛素介导的蛋白水解作用、基底转录因子、磷酸肌醇代谢、神经营养因子信号通路、TGF-β信号通路显著富集。同时,MAP7的表达上调促进子宫内膜癌、慢性粒细胞白血病、甲状腺癌等多种癌症的通路,同时抑制自身免疫性甲状腺疾病、系统性红斑狼疮、同种异体移植物排斥、移植物抗宿主病、1型糖尿病、原发性免疫缺陷、产生IgA的肠道免疫网络、哮喘、氧化磷酸化、核糖体等通路。
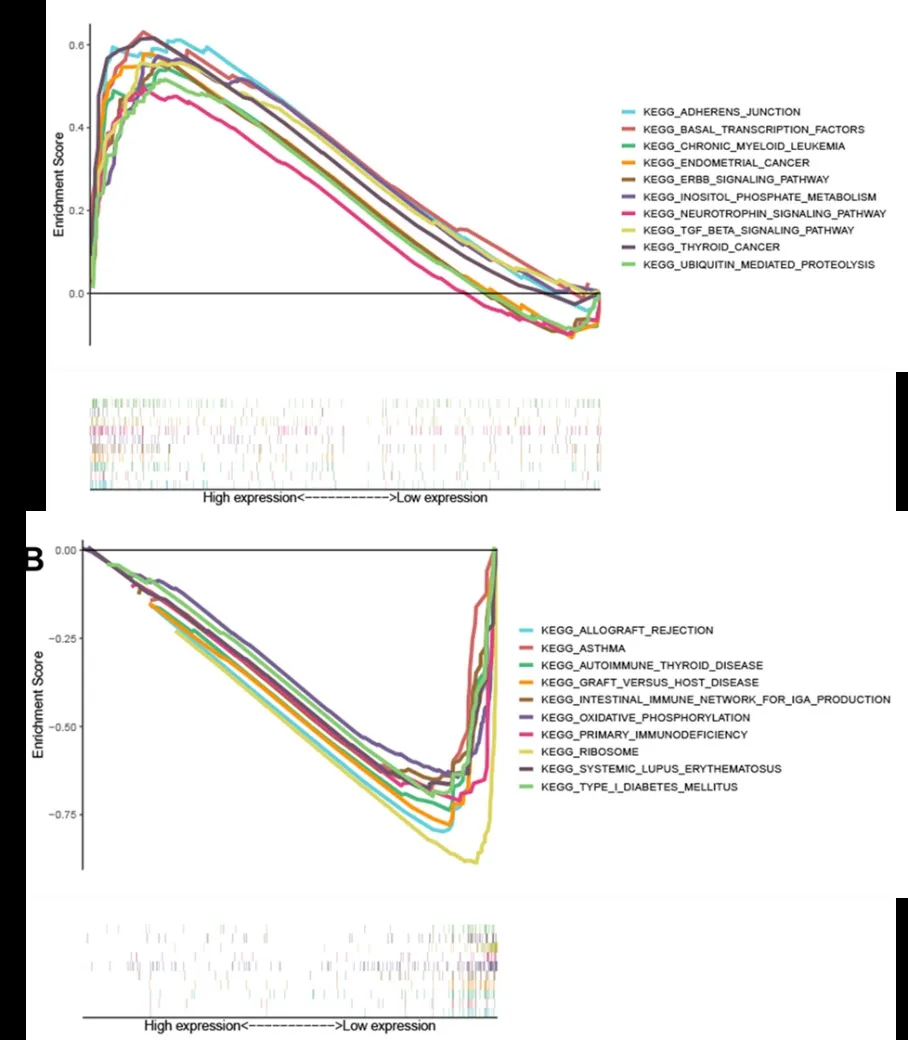
图3 MAP7在宫颈癌中的KEGG功能富集结果
3 讨论
近年来,手术和放疗模式的不断革新以及免疫治疗的兴起,晚期宫颈癌患者仍然存在复发和转移风险。因此,需要探寻更多新的生物标志物和治疗靶点。MAP参与微管动力学,在细胞分裂、运动、分化和其他重要的细胞和细胞内活动中不可或缺。微管的形成对有丝分裂至关重要,微管通过交替生长不断地重塑和收缩他们的末端,这被称为动态不稳定性[7]。MAP7是一种非运动MAP,它与微管之间存在着独特的相互作用,它最初是从HeLa细胞裂解物中鉴定出来的,主要在上皮细胞中表达。研究表明,MAP7通过直接与微管结合,促进微管的稳定,在神经元微管的形成中发挥了重要的作用[8]。在大鼠胚胎感觉神经元的结构功能分析中发现,MAP7有两个独特的微管结合位点,具有解离动力和支链形成的双重作用,并且动态招募蛋白激酶1到微管上,导致细胞器运输行为的改变[9]。在果蝇实验中发现MAP7有助于干细胞的自我更新[10]。然而,关于MAP7在癌症中的作用研究仍较少。在细胞遗传学正常的年轻急性髓系白血病患者中,MAP7表达上调,预示着较差的预后[5]。也有研究表明,MAP7介导加速胃癌细胞的增殖、迁移和侵袭促进疾病的进展[6]。然而,MAP7在宫颈癌中预后预测的价值仍未有报道。我们通过TCGA数据库CESC数据整合,鉴定了MAP7在宫颈癌中的表达特征,生存分析证实了基因高表达预示着不良结局,并运用临床相关性分析发现MAP7与疾病的进展或复发有密切关系,并能够作为独立预后因素。在功能富集分析中,基因高表达显著富集在慢性粒细胞白血病、神经营养因子信号通路,与上述既往研究结果一致。同时在ERBB信号通路、泛素介导的蛋白水解作用、TGF-β信号通路显著富集,可以成为未来新的机制研究方向。我们还注意到,MAP7表达上调在促癌的同时,有抑制免疫系统疾病的可能。在研究中,我们通过新兴的生物信息学技术鉴定了宫颈癌新的生物标志物MAP7,但也存在一定的局限性。本研究的发现仅为大数据挖掘,仍有待进一步实验验证。
综上所述,我们的研究表明,MAP7在宫颈癌中呈高表达,并且与不良预后有关,参与多种生物过程,是宫颈癌的潜在预后标志物,有望成为理想的治疗靶点。
