瘢痕疙瘩成纤维细胞源性P物质在瘢痕疙瘩发病机制中的作用
2021-09-25李香兰黄哲浩姜日花池光范
李香兰,黄哲浩,姜日花*,池光范
(1.吉林大学中日联谊医院 a.皮肤科;b.神经外科,吉林 长春130033;2.吉林大学病理生物学教育部重点实验室)
P物质(SP)是含有11个氨基酸的神经肽。研究表明,感觉神经通过释放SP等神经肽[1],参与皮肤炎症和创伤后修复[2]。软组织损伤刺激这些传入神经末梢释放SP,影响神经源性炎症和成纤维细胞增殖[3]。Nilsson等的研究发现增生性瘢痕中SP阳性神经纤维增多,提示SP可能参与了病理性瘢痕的形成[4]。本研究基于观察瘢痕疙瘩成纤维细胞源性SP对瘢痕疙瘩成纤维细胞外基质沉积的作用及对成纤维细胞迁移的影响,探讨其机制及相关治疗方案。
1 材料与方法
1.1 收集瘢痕疙瘩组织及正常皮肤组织
收集了2017年至2019年就诊于吉林大学中日联谊医院患者的瘢痕疙瘩组织样本20例,包括前胸、后背的瘢痕疙瘩10例,耳部瘢痕疙瘩10例。同时收集了前胸及后背正常皮肤组织样本10例,组织样本均来自本院皮肤科。所获取的组织经福尔马林固定制作蜡块组织标本及组织切片,进行HE染色及组织免疫化学染色。收集了3例新鲜瘢痕疙瘩组织及3例正常新鲜皮肤组织,用于分离培养瘢痕疙瘩及正常皮肤成纤维细胞。
1.2 主要实验试剂及仪器
SP免疫组织化学试剂盒(中国福州迈新生物技术有限公司),DAB显色液(中国福州迈新生物技术有限公司),DMEM培养液(美国Gibco公司),胎牛血清(以色列 BI 公司)。
1.3 实验方法
1.3.1HE染色及免疫组织化学染色 所获取的组织经福尔马林固定制作蜡块组织标本及组织切片,进行组织免疫化学染色。
1.3.2皮肤成纤维细胞的分离培养 手术中切下的瘢痕疙瘩或正常皮肤组织移至无菌培养皿中;加入0.2%中性蛋白酶溶液,4℃,4-8小时;表皮层和真皮层分离,将真皮层反复剪切至泥状,加入Ⅰ型胶原酶溶液,37℃摇床,3-5小时;加入等量培养基终止消化,反复吹吸,80目滤网过滤;离心,保留沉淀,培养基重悬细胞;接种细胞至培养瓶中,置入37℃含有5%CO2的培养箱中培养。
1.3.3细胞免疫荧光染色 取对数期生长的成纤维细胞;使用6孔板铺板;24小时后使用 4%多聚甲醛固定细胞;0.1%Triton-X100孵育20 min;BSA封闭30 min;SP抗体封闭过夜(1∶50,Santa Cruz);去除一抗,加入荧光二抗(1∶200,abcam),避光,孵育2 h;用含DAPI的封闭液封片;在倒置显微镜下,观察照相。
1.3.4TAC1 siRNA转染 使用lipofectamine2000(lipo2000,Invitrogen)转染,转染按照试剂盒说明书操作。TAC1 siRNA 由广州锐博生物提供,siG000006863B,序列为AAGACGTTAATAAACTACC,转染浓度为50 nM。
1.3.5Western Blot 提取蛋白、测蛋白浓度;配胶,煮蛋白上样;进行蛋白质电泳浓缩、分离和转膜,5%脱脂奶粉封闭;一抗孵育:Substance P(1∶500,Novus),Collagen I(1∶5 000,Abcam),Collagen III(1∶5 000,Abcam),4℃过夜;二抗(山羊抗兔Ig G-HRP 抗体,1∶5 000,中国北京中杉金桥生物有限公司)孵育;ECL显色液反应显色,在凝胶图像分析仪拍照。
1.3.6细胞划痕实验 瘢痕疙瘩成纤维细胞进行TAC1 siRNA转染24 h后,用20 μl无菌枪头沿培养板底部划一 直线,PBS缓冲液冲洗以去除漂浮细胞,加入无血清培养基继续培养24小时,倒置显微镜观察划痕区相对距离。
1.3.7统计学方法 GraphPad prism 5.0软件进行统计学分析,组间差异比较采用t检验,数据采用平均值±SD 表示。
2 结果
2.1 瘢痕疙瘩组织的病理学特点
瘢痕疙瘩组织具有过度生长、病变的发展超出原损伤界限、呈瘤样增生等特征。HE染色提示瘢痕疙瘩组织中成纤维细胞过度增生,细胞外基质成分增加,胶原蛋白过度沉积(图1)。
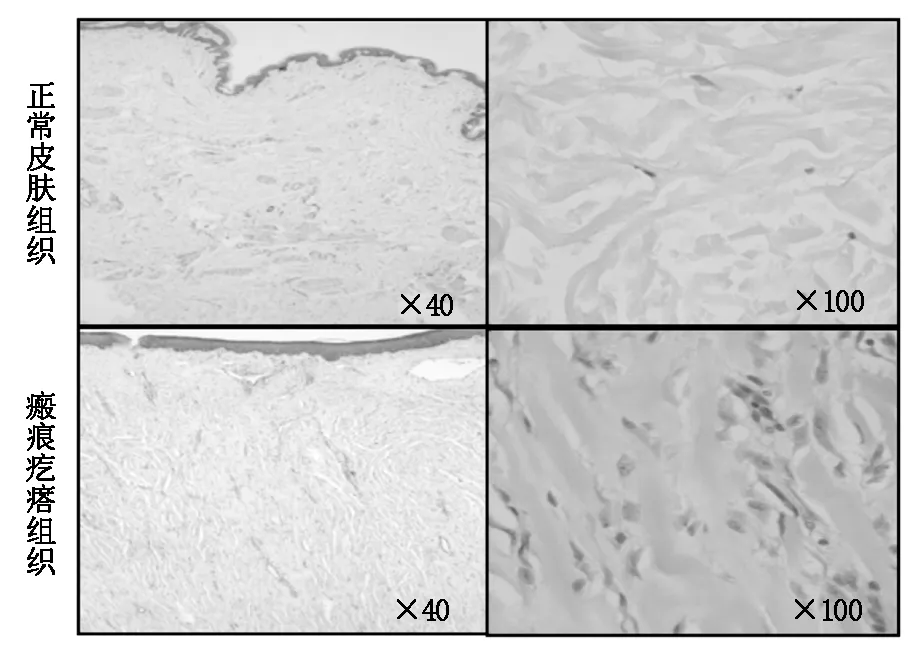
图1 H&E染色 瘢痕疙瘩组织中成纤维细胞过度增生,细胞外基质成分增加,胶原蛋白过度沉积
2.2 瘢痕疙瘩组织中SP表达增加
免疫组织化学染色结果显示,与正常皮肤组织相比瘢痕疙瘩组织SP抗原抗体反应显著阳性,主要表达在真皮层瘢痕疙瘩细胞外基质和纤维细胞的细胞质中。定量分析结果显示与正常皮肤组织相比有显著的统计学意义(P<0.01,图2)。
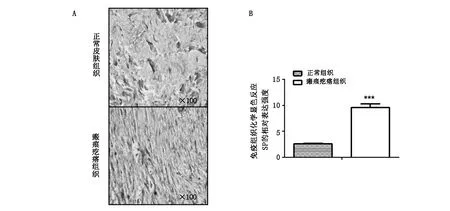
A:瘢痕疙瘩组织高表达SP。B:与正常皮肤组织相比均有显著的统计学意义,P<0.01。
2.3 瘢痕疙瘩成纤维细胞的形态观察
在倒置相差显微镜下,培养得到的瘢痕疙瘩成纤维细胞表现为形态肥大,体积明显大于正常的成纤维细胞(图3)。

图3 倒置相差显微镜显示的瘢痕疙瘩成纤维细胞形态,该细胞形态肥大,体积明显大于正常的成纤维细胞
2.4 瘢痕疙瘩成纤维细胞中SP高表达
细胞免疫荧光染色显示,与正常皮肤组织相比瘢痕疙瘩组织SP抗原抗体反应显著阳性,主要表达在成纤维细胞的细胞质中。定量分析结果显示与正常皮肤组织相比有显著的统计学意义(P<0.01,见图4)。
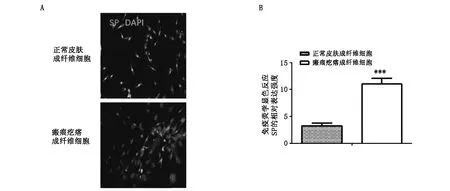
A:瘢痕疙瘩成纤维细胞高表达SP。B:与正常皮肤成纤维细胞相比有显著的统计学意义,P<0.01。
2.5 敲减TAC1基因后瘢痕疙瘩成纤维细胞SP、Ⅰ型胶原蛋白及Ⅲ型胶原蛋白表达减少
TAC-1基因转录翻译为SP蛋白。应用siRNA干扰技术敲减TAC-1基因表达后,与正常成纤维细胞相比瘢痕疙瘩成纤维细胞显著减少SP、Ⅰ型胶原蛋白(Collagen I)及Ⅲ型胶原蛋白(Collagen Ⅲ)的表达,均有显著的统计学意义(P<0.01,见图5)。

敲减TAC-1基因后,瘢痕疙瘩成纤维细胞减少表达SP、Ⅰ型胶原蛋白及Ⅲ型胶原蛋(P<0.01)。
2.6 敲减TAC1明显抑制瘢痕疙瘩成纤维细胞的移行能力
未敲减 TAC1的瘢痕疙瘩成纤维细胞(对照组)与敲减 TAC1的瘢痕疙瘩成纤维细胞(实验组)相比,在划痕形成24小时后,已有大量成纤维细胞向划痕处移行,划痕界面已基本愈合,但是实验组仍然观察到了无细胞的明显的划痕界面,划痕面积统计结果显示有显著的统计学意义(P<0.01,图6)。
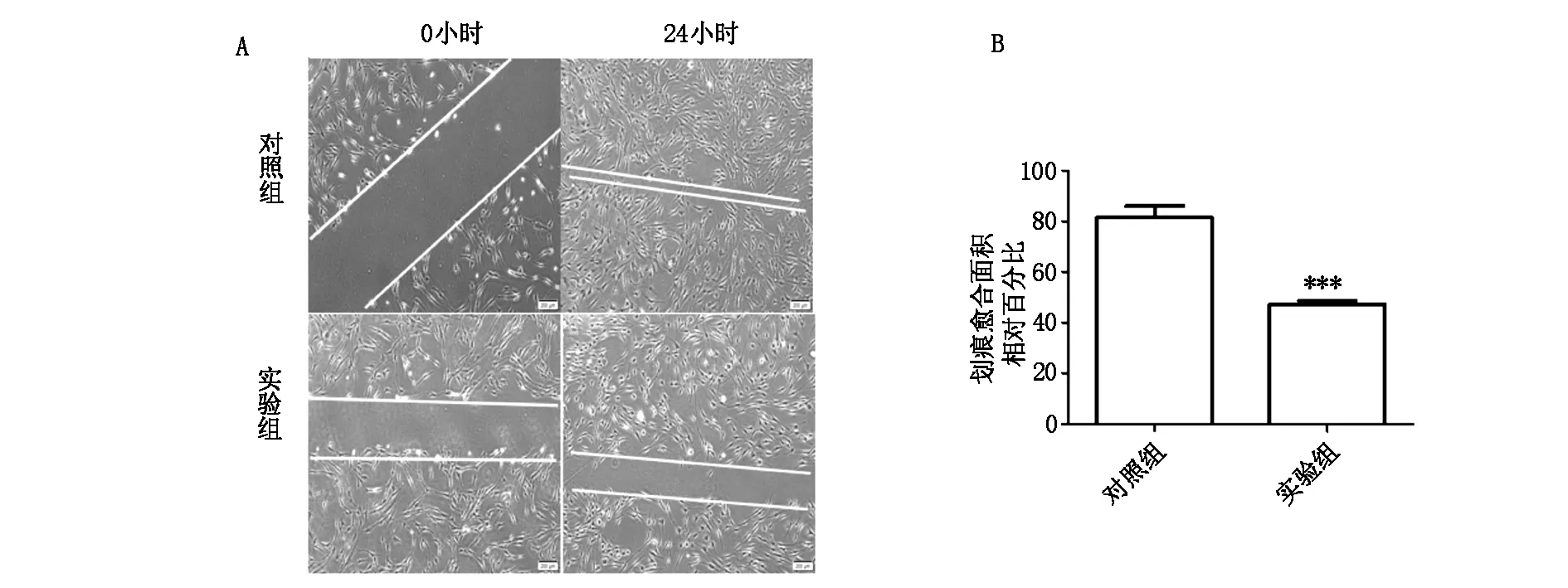
敲减 TAC1的实验组划痕愈合能力明显低于对照组,有统计学意义,P<0.01
3 讨论
瘢痕疙瘩是一种与遗传及免疫功能等因素有关的皮肤成纤维细胞异常增生性疾病[5]。此次实验中,瘢痕疙瘩组织HE染色表现为成纤维细胞过度增生,细胞外基质成分增加,胶原蛋白过度沉积,呈瘤样增生等特点,与以往的其他研究结果相一致。
SP在人类和啮齿动物中广泛表达,并在各种生物过程中发挥多种作用。Euler和Gaddum[6]首次报道了SP对胃肠道平滑肌的舒张和收缩作用。随后的研究表明,SP是一种与疼痛传递相关的神经元感觉介质,因为它在脊髓背根高度集中,SP还与神经元组织[7]、炎症[8]和痛觉的生长发育有关[9]。本研究免疫组织化学染色中,瘢痕疙瘩组织细胞外基质和成纤维细胞细胞质均高表达SP,提示SP不仅来源于真皮中的神经,与患者的瘙痒和疼痛等临床症状正相关,还有瘢痕疙瘩成纤维细胞自身也合成分泌SP,通过自分泌和旁分泌作用调控瘢痕疙瘩中成纤维细胞的细胞特性,促进瘢痕疙瘩病理发展。SP在皮肤组织损伤后的病理生理作用,包括修复和异常增殖中的作用已被报道[10]。陈静等在研究中发现在 SP 通过调控成纤维细胞凋亡相关基因-PCNA、bcl-2的表达而参与病理性瘢痕形成,该作用由 SP受体介导[11]。但这些研究主要集中在外来SP对成纤维细胞的影响。本研究发现敲减瘢痕疙瘩成纤维细胞的TAC-1基因后,瘢痕疙瘩成纤维细胞减少SP、Ⅰ型胶原蛋白和Ⅲ型胶原蛋白的表达,推测瘢痕疙瘩成纤维细胞分泌的SP通过调控Ⅰ型及Ⅲ型胶原蛋白的表达进而介导细胞外基质的沉积,进一步促进瘢痕疙瘩的病理发展。
瘢痕疙瘩有向周边侵袭生长的特性,这与成纤维细胞迁移能力有关。划痕实验中发现,敲减 TAC1的瘢痕疙瘩成纤维细胞划痕界面中迁移能力显著降低,提示瘢痕疙瘩成纤维细胞分泌的SP对瘢痕疙瘩成纤维细胞的移行能力有显著性促进作用。国内其他学者认为[12]SP对成纤维细胞的促增殖作用可被它的神经激肤1(NK1)受体拮抗剂 spanitde 抑制或部分抑制,提示SP诱导的成纤维细胞增殖作用与NK1功能有关。说明应用NK1受体抑制剂,阻断SP的作用不仅达到抑制瘢痕疙瘩成纤维细胞迁移,还能抑制瘢痕疙瘩成纤维细胞增殖和Ⅰ型及Ⅲ胶原细胞外基质的合成分泌,抑制瘢痕疙瘩生长和过度扩张,从而达到缓解治疗瘢痕疙瘩的目的。
此次研究发现瘢痕疙瘩成纤维细胞合成分泌SP并进一步揭示了瘢痕疙瘩成纤维细胞来源SP在瘢痕疙瘩组织中的作用机制,为瘢痕疙瘩新药物的开发研究提供了新的方向。
