黄绿青霉素对神经细胞PC-12损伤作用的研究
2021-09-25曹罗元董文婿林应华黄宝英富显果
杨 菁,曹罗元,董文婿,林应华,黄宝英,富显果*
(1.宁德师范学院附属宁德市医院 细胞分子生物学实验室,福建 宁德352100;2.福建省病原真菌与真菌毒素重点实验室(福建农林大学),福建 福州350002)
黄绿青霉素(CIT)是由于大米、玉米等粮食作物和饲料发霉而产生的一种具有很强生物活性的次级代谢产物,主要由黄绿青霉菌、赭鲑色正青霉菌及土霉菌产生[1-2]。世界上有许多国家和地区以大米为主要粮食,不当的储存条件如潮湿、时间过长会导致黄绿青霉菌迅速生长,产生大量的CIT。据联合国粮食及农业组织(FAO)估计,全球约有1/4-1/3的谷物受到真菌毒素的污染,饲料污染的情况则更为严重[3],CIT是造成污染的真菌毒素之一,因此,这是一个不可忽视的公共卫生问题。毒理学研究表明,CIT对人和动物(包括小鼠、大鼠、兔子等)有急性神经毒性作用,如体温降低、呼吸衰竭、循环衰竭、麻痹和抽搐等[4],但其具体作用机制并不明确。目前,氧化应激反应被认为是神经细胞结构或功能损伤的重要诱因,常常与某些神经性疾病病因相关[5]。已有的研究中,Yuntao Bai[6]等人通过检测细胞内活性氧(ROS)和还原型谷胱甘肽(GSH)的生成,证实了CIT能够诱导人肝源性肝癌细胞株HepG2细胞的DNA损伤,最有可能是通过氧化应激机制进行的。因此,本研究通过将CIT作用于神经细胞PC-12,检测细胞活性及相应的氧化应激指标,明确黄绿青霉素是否通过氧化应激机制损伤神经细胞。
1 材料与方法
1.1 仪器与试剂
二氧化碳培养箱(Thermo、BB15),全波长酶标仪(Molecular Devices、SPECTRA MAX 190),低温高速离心机(Beckman、Allegra X-22R),倒置荧光显微镜(OLYMPUS、IX71)。
黄绿青霉素(纯度≥97%,货号ALX-630-118-M001,购于ENZO公司),MEM培养基、胎牛血清(FBS)、PBS缓冲液(Hyclone),胰酶(Gibco),CCK-8试剂盒、脂质氧化(MDA)检测试剂盒、乳酸脱氢酶(LDH)试剂盒、一氧化氮(NO)试剂盒、BCA蛋白定量试剂盒、NP-40裂解液(碧云天),ROS试剂盒、GSH试剂盒、SOD检测试剂盒(南京建成)。
1.2 细胞培养和分组
PC-12细胞(鼠肾上腺嗜铬细胞),购于中国科学院细胞库。PC-12细胞用含10%FBS的MEM培养基常规培养至对数生长期,加入CIT,除LDH检测采用无血清培养基加CIT,其余实验均用含10%FBS的培养基加CIT,共培养时间均为 24 h,参照Yuntao Bai[6]与Yuexia Wang[7],将实验分为四组:低剂量组(CIT浓度2.5 μmol/L),中剂量组(CIT浓度5 μmol/L),高剂量组(CIT浓度10 μmol/L),空白对照组用DMSO处理,倒置显微镜下观察细胞形态的变化。
1.3 CCK-8法检测细胞活性
将PC-12细胞浓度调整为5×107个/L,每孔100 μl接种至96孔板,培养24 h后细胞贴壁,加入不同浓度CIT再共培养24 h。检测时加入10 μl CCK-8溶液,放置培养箱内孵育1 h,450 nm测吸光度。对照组存活率设为100%,药物组存活率=测定OD值/对照OD值。
1.4 LDH释放率检测
PC-12细胞浓度为5×107个/L,每孔100 μl接种至96孔板,24 h后细胞贴壁,吸去培养液,用PBS洗一次。换成200 μl无血清培养液,加入不同浓度CIT,共培养24 h。到检测时间前1 h,在“样品最大酶活性对照孔”中加入20 μl LDH释放试剂,混匀后继续在细胞培养箱中孵育。到达检测时间,取细胞培养液在400 g离心5 min。每孔取上清液120 μl,加到新的96孔板,各孔分别加入60 μl LDH检测工作液,混匀,室温避光孵育30 min。490 nm处测定吸光度,600 nm作为参考波长进行双波长测定。LDH释放率=(样品孔OD值-背景空白对照孔OD值)/(最大酶活性对照孔OD值-最大酶活性空白孔OD值),ΔLDH 释放百分率=样品组LDH 释放百分率-空白对照组 LDH 释放百分率。
1.5 MDA、ROS、NO含量检测
PC-12细胞接种至六孔板,每孔细胞数1×106个,每孔2 ml培养基,培养24 h待细胞贴壁后,加入不同浓度CIT共培养24 h。细胞培养液1 500 g离心5 min,取上清液加入MDA检测试剂混匀,沸水浴15 min,532 nm测吸光度,计算MDA含量。
培养液换成2 ml无血清培养基,一组正常培养的细胞不加探针,只加培养基设为阴性对照,一组正常培养的细胞加入供氢体(终浓度24 μmol/L)设为阳性对照孔,所有孔都加入DCFH-DA探针(终浓度10 μmol/L),37℃培养箱孵育30 min到1 h,吸去培养液,加入PBS将细胞吹打下来,再用PBS洗1-2遍,离心去上清收集沉淀,按照FITC荧光检测条件检测ROS荧光值。
细胞浓度为5×107个/L,每孔100 μl接种至96孔板,贴壁生长24 h后,加入不同浓度CIT,共培养24 h。取细胞培养液在400 g离心5 min。每孔取50 μl在新的96孔板中加入标准品及样品,然后加入检测试剂,在540 nm处测吸光度,根据标准品曲线计算出样品中NO的浓度。
1.6 GSH含量、SOD活力的检测
PC-12细胞接种至六孔板,每孔细胞数1×106个,每孔2 ml培养基,培养24 h待细胞贴壁后,加入不同浓度CIT共培养24 h。弃去培养液,用冰浴过的PBS洗3遍,加入NP-40裂解液(PMSF终浓度为1 mM),4℃裂解30 min,4℃下3 500 g离心10 min,取100μl上清液按照GSH检测试剂盒说明书,420 nm处测定吸光度,用BCA蛋白定量试剂盒定量,GSH含量(μmol/gprot)=(样品孔OD值-空白孔OD值)/(标准孔OD值-空白孔OD值)×标准管浓度(20 μmol/L)×样本前处理稀释倍数(2)÷待测样本蛋白浓度(gprot/L)。
按照SOD检测试剂盒说明书,450 nm处测定吸光度,SOD 抑制率(%)=[(对照孔OD值-对照空白孔OD值)-(样品孔OD值-样品空白孔OD值)]/(对照孔OD值-对照空白孔OD值)×100%,SOD活力(U/mgprot)=SOD 抑制率÷50%×反应体系稀释倍数(0.24 ml/0.02 ml)÷待测样本蛋白浓度(mgprot/mL)。
1.7 统计学处理
2 结果
2.1 黄绿青霉素对细胞形态的影响
CIT处理PC-12细胞24 h后,细胞出现聚集现象。随着CIT浓度的增大,细胞聚集成团的程度也越高,并开始脱落,出现空斑,而对照组未出现明显变化。见图1。

图1 黄绿青霉素对PC-12细胞形态的影响(×100)
2.2 CIT抑制细胞活性
随着CIT浓度的增大,细胞活力明显下降,呈现剂量效应关系,所有的CIT组与对照组相比,差异均具有统计学意义(P<0.01),说明CIT能够明显抑制细胞活性。见图2。

图2 CIT对细胞活性的影响
2.3 CIT对LDH释放率的影响
与对照组相比,所有CIT处理组的LDH释放率均明显升高(P<0.01)。见表1。
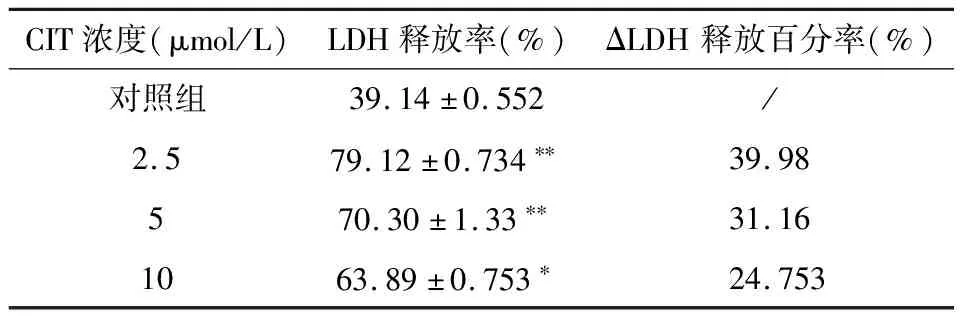
表1 CIT对LDH释放率的影响
2.4 CIT对MDA、ROS、NO含量的影响
与对照组相比,CIT组的MDA含量均显著升高(P<0.01),见图3;ROS含量均比对照组显著升高,在2.5 μmol/L和5 μmol/L组中效果极为显著(P<0.01),10 μmol/L组中效果较为显著(P<0.05),见图4;随着CIT浓度增大,细胞外的NO含量下降,呈剂量效应关系。与对照组相比,2.5 μmol/L组及5 μmol/L组下降显著(P<0.05),10 μmol/L组下降的极为显著(P<0.01),见图5。

图3 CIT对MDA含量的影响

图4 CIT对 ROS含量的影响 图5 CIT对NO含量的影响
2.5 CIT对GSH含量、SOD活力的影响
细胞内的GSH含量随CIT浓度增大呈下降趋势,在2.5 μmol/L和5 μmol/L组中效果不显著(P>0.05),10 μmol/L组中效果显著(P<0.05),见图6。

图6 CIT对GSH含量的影响 图7 CIT对SOD活力的影响
细胞内的SOD活力随CIT浓度增大而上升,各组与对照组比较均有极显著差异(P<0.01),2.5 μmol/L组、5 μmol/L组与10 μmol/L组之间比较无明显差异(P>0.05)。见图7。
3 讨论
本研究采用LDH法检测黄绿青霉素对神经细胞的毒性作用,LDH在胞浆内含量丰富,正常时不能通过细胞膜,只有在细胞受损伤或死亡时才被释放到细胞外,细胞培养液中LDH活性与细胞死亡数成正比。因此,LDH释放被看做细胞膜完整性的重要指标,被用于细胞毒性检测。当ΔLDH 释放百分率≤20%,表明存在细胞轻度损伤,当ΔLDH释放百分率为20%-50%时则为细胞中度损伤,而当ΔLDH释放百分率≥50%时,则表明存在细胞重度损伤[8]。结合CCK-8结果,提示CIT对细胞有明显的损伤作用,并能够抑制细胞活性。
氧化应激反应是由于自由基过度产生无法及时清除,体内氧化与抗氧化作用失衡,导致机体的细胞和组织被损伤[9],是应激性损伤的主要机制之一[10]。MDA是重要的氧自由基代谢产物,自由基作用于脂质发生过氧化反应,其氧化最终产物就是MDA,因此,MDA的含量可反映机体脂质过氧化的程度,间接反应细胞损伤的程度。ROS是有氧代谢的副产物,正常状态下,ROS的产生与消耗处于平衡状态[11]。但当机体受到各类有害刺激时,机体内ROS生成量增加,从而与体内抗氧化体系发生持续失衡,导致组织损伤[10]。
NO是一种反应性极强的自由基,起到神经递质和信号分子的作用,能够反应氧化应激的水平,参与多种生理和病理过程[12]。在合成NO的过程中,电子从一个单二聚体上的黄素还原酶结构域转移到另一个单二聚体的氧化酶结构域,后者包含一个铁结合血红素活性位点。在血红素位点,电子被用来还原和激活O2,O2又氧化生成NO,这个过程需要结合四氢生物蝶呤(BH4)进行偶联,ROS可使BH4氧化导致解偶联,使O2转化为超氧化物自由基,降低NO生成量[13]。本研究结果表明,CIT能显著提高细胞外MDA含量,在CIT浓度为5 μmol/L后,MDA含量就基本不变,这提示了CIT在低剂量就能够引起脂质氧化;流式细胞仪检测结果表明CIT显著提高细胞内ROS含量,说明CIT能够引起细胞氧化体系失衡;CIT会降低细胞外NO含量,进一步提示可能因为ROS含量增多引起的NO减少。
目前机体对抗氧自由基主要依赖自身的抗氧化酶系统,其中 SOD 和 GSH 是机体主要的抗氧化酶[14]。GSH能够与体内的自由基结合使其转化为代谢的酸类物质,同时也可以加速自由基的排泄和保护器官避免受到损伤[15]。SOD 能够维持细胞膜的正常结构和功能,通过歧化作用降低体内过多的氧自由基,减少脂质过氧化反应[16],维持细胞内氧化和抗氧化平衡,SOD 活力的高低反映的是机体抗氧化应激的能力[17]。有研究报道,在氧化应激的刺激下,细胞内为了处理过量的ROS,SOD的合成量会上升[18]。本研究结果表明,CIT处理细胞后,GSH水平呈下降趋势,并在高剂量时显著下降;各剂量组SOD的活力均显著升高,这些结果都提示了CIT能降低细胞清除自由基的能力。
4 结论
黄绿青霉素能够抑制PC-12细胞活性,并降低LDH释放率及NO含量,对细胞具有明显毒性作用;细胞外的MDA、细胞内ROS水平和SOD活力显著上升,细胞内GSH含量呈下降趋势。因此,黄绿青霉素能够诱导神经细胞发生氧化应激,其分子机制还有待进一步研究证实。
