抗中性粒细胞胞浆抗体相关性血管炎肾损伤临床及病理研究
2021-09-25王淑平刘树军李起奉王雁德
王淑平,刘树军,李起奉,王雁德*
(1.松原吉林油田医院 血液净化中心,吉林 松原138000;2.吉林大学第二医院 肾病内科;3.吉林市人民医院 肾病内科)
抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV)是一种自身免疫性疾病,可累及多系统及器官,其中以肾脏及肺脏受累最为多见,肾脏受累率高达60%[1]。肾脏受累主要表现为血尿、蛋白尿、水肿、血压升高、肾脏功能进行性恶化等。不及时确诊及治疗,可快速发展至终末期肾病(ESRD),严重降低患者的生活质量。有研究表明,AAV肾损伤5年发展至ESRD可高达27%[2]。目前对AAV肾损伤的发病机制、治疗及预后研究较多,而对AAV肾损伤的病理特点研究较少。
1 资料与方法
1.1 研究对象2003年1月至2020年10月间收住松原地区各医院及吉林大学第二医院肾病内科,且行肾穿刺活检病理诊断为原发性AAV肾损伤的患者142例,其中男68例,女74例,男∶女=1∶1.09,年龄区间(14-84)岁,平均年龄(58.16±7.92)岁。所有入选患者均符合1990年美国风湿学会(ACR)诊断标准及2012年Chapel Hill会议AAV分类标准。排除系统性红斑狼疮、过敏性紫癜等自身免疫病,排除继发性AAV(如药物、感染、肿瘤等),同时排除其他肾脏病。
1.2 方法查阅病历,收集并登记所有患者的发病年龄、性别、血压等一般资料,血常规、肾功、肾小球滤过率(eGFR)、ANCA、C-反应蛋白(CRP)、补体(C3、C4)、24小时尿蛋白定量等实验室资料及肾脏病理资料。ANCA检测项目(ELISA法):ANCA-MPO[靶抗原为髓过氧化物酶(MPO)],ANCA-PR3[靶抗原为蛋白酶3(PR3)]。依据AAV分类标准将142例患者分为显微镜下型多血管炎(MPA)、肉芽肿性多血管炎(GPA)及嗜酸细胞性肉芽肿性多血管炎(EGPA)三组,其中,MPA组115例,GPA组18例,EGPA组9例。
1.3 肾脏病理学检查所有病例肾穿刺活检穿出肾组织均分三部分,分别做免疫荧光检查(IgA、IgG、IgM、C3、C4、C1q及Fib)、光镜检查(HE、PAS、PASM-Masson及Masson)及电镜检查。
1.4 统计学方法应用SPSS22.0 统计软件进行统计学分析,所有数据集中趋势以均数±标准差表示,组间差异采用t检验。计数资料用例数(n,%)表示,用Fisher检验。P<0.05为有统计学意义。
2 结果
2.1 三组AAV肾损伤患者临床资料比较所有患者中,MPA组患者明显多于GPA组和EGPA组,占全部病例的80.99%;高血压患者占50.00%。ANCA-MPO(+)的患者占58.45%,ANCA-PR3(+)的患者占9.86%。MPA组患者的年龄明显大于GPA组及EGPA组(P<0.001),MPA组患者的白细胞明显低于GPA组及EGPA组(P<0.05),MPA组患者的血红蛋白及补体C3明显低于GPA组及EGPA组(P<0.001),其中低C3患者58例(40.85%)。GPA组患者的血小板明显高于MPA组及EGPA组(P<0.001),MPA组患者的肾功能损害程度明显重于GPA组及EGPA组,主要体现在血肌酐、24小时尿蛋白明显升高及eGFR明显下降(P<0.001),见表1。
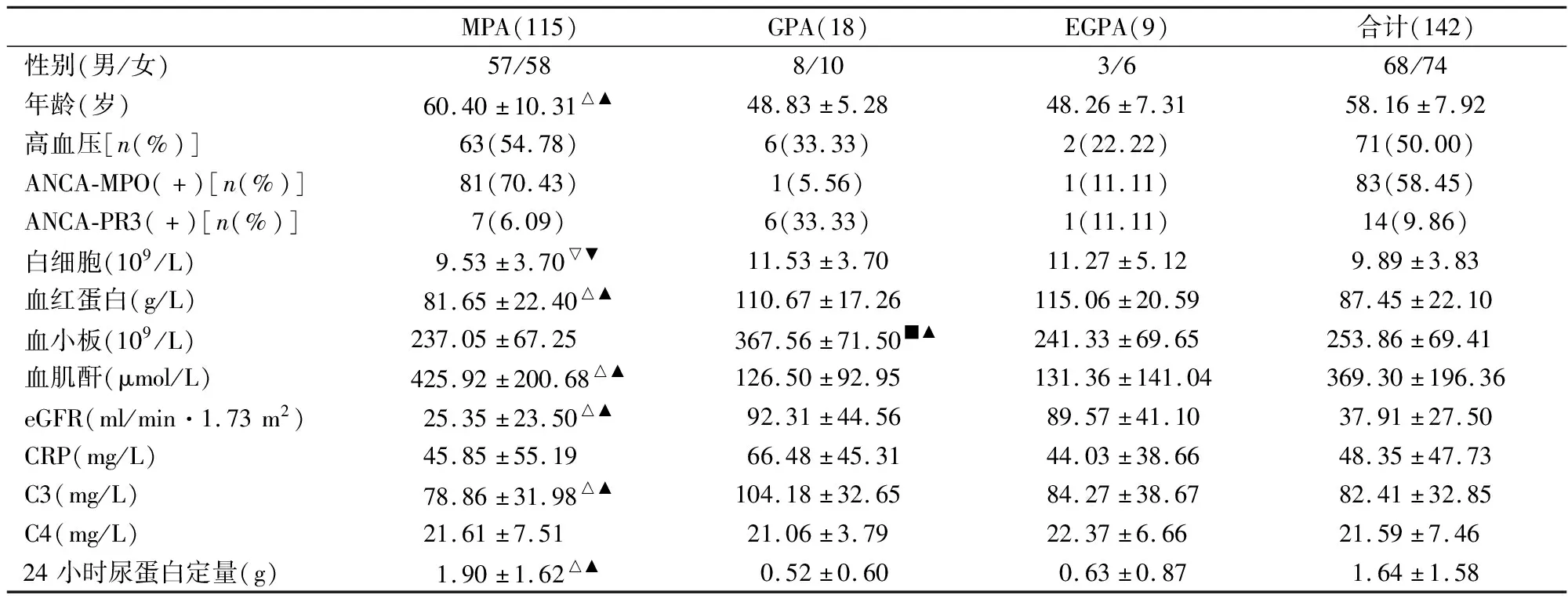
表1 三组AAV肾损伤患者临床资料比较
2.2 三组AAV肾损伤患者的病理资料比较所有患者中,肾脏病理主要表现为新月体性肾小球肾炎47例,占33.10%。其次是硬化性肾小球肾炎40例,占28.17%。MPA组患者最主要的肾脏病理类型是新月体性肾小球肾炎45例,占MPA患者的39.13%,详见表2。
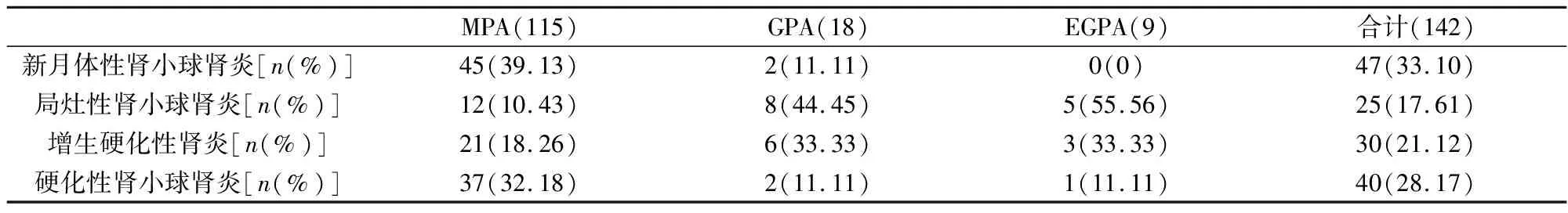
表2 三组AAV肾损伤患者的病理资料比较(n,%)
3 讨论
根据分类标准AAV可分为MPA、GPA及EGPA,三者导致肾脏损害分别可高达90%、80%、45%左右,肾脏损害的主要病理改变是新月体形成及纤维素样坏死,临床上可表现为肾功能急进性恶化[3]。因此临床上诊断为AAV,且有肾功能损害的患者,均应尽早行肾穿刺活检,以明确诊治方案。
本研究中,142例AAV肾损伤患者平均年龄58.16±7.92岁,男∶女比例为1∶1.09,与Herly研究[4]的结果基本一致。MPA患者所占比例最高,与Shi研究[5]结果相似,但本研究中MPA比例明显更高,这可能与本研究收录病例均为肾病科患者有关。高血压患者占全部病例的50%,考虑与AAV导致的肾损伤有关,肾小球滤过率下降致水钠潴留,肾脏血管受损导致RAAS系统激活等均可导致血压升高。本研究显示,AAV肾损伤患者可表现为血红蛋白降低,白细胞及血小板升高,MPA患者的贫血更为严重,这可能与MPA患者更易形成新月体,导致肾脏损害,从而致促红细胞生成素生成不足所致。还有研究报道[6],AAV的发病机制与ANCA-MPO介导的中性粒细胞活化密不可分,而这可能是导致血红蛋白降低的原因。MPA患者的白细胞计数更低可能与中性粒细胞活化后崩解有关。由于ANCA-MPO可以刺激活性氧产生,因此更易导致纤维化[7],同时MPA患者更易形成新月体,因此MPA患者的肾功能损害更为严重,本研究中主要表现为血肌酐、24小时尿蛋白定量的升高及eGFR的降低。另外MPA患者C3下降更为明显,也表明病情活动更为严重。
AAV肾损伤主要病理改变是新月体形成及纤维素样坏死,本研究中新月体性肾小球肾炎47例(33.10%),与有关报道[3]基本一致。有研究表明,硬化性肾小球肾炎预后差,局灶性肾小球肾炎预后较好,MPA预后较GPA及EGPA差[8],这与本研究中MPA患者肾脏病理多表现为新月体性肾炎及硬化性肾炎的结果相符合。新月体的形成导致肾功能快速恶化,而ANCA-MPO易导致纤维化[7],因此可导致纤维性新月体快速形成,最终导致预后严重不良。
综上,AAV易导致肾损伤,且病情进展快。尤其是MPA患者,肾脏病理类型主要是新月体性肾小球肾炎及硬化性肾小球肾炎。AAV患者出现肾功能异常,应尽早考虑行肾穿刺活检,明确病理类型,以指导临床诊治。本研究为单中心、回顾性研究,结果具有局限性,要想对AAV肾损伤更深入的了解,则需要多中心、大样本、前瞻性的研究,同时加强实验室分子机制的研究。
