外泌体治疗椎间盘退变的研究进展
2021-09-24刘明强陈海伟张广智康学文
刘明强,陈海伟,张广智,康学文*
1兰州大学第二医院骨科,兰州 730030;2甘肃省骨与关节疾病重点实验室,兰州 730030
下腰痛(low back pain,LBP)是一种常见疾病,全世界约80%的人在其一生中出现过LBP的症状,引起LBP的原因主要有脊柱病变、软组织病变、神经病变及非特异性疼痛等。研究发现,椎间盘退变(intervertebral disc degeneration,IDD)引起的椎间盘突出和椎管狭窄可能是导致LBP的最主要原因,给家庭和社会带来了巨大的经济负担[1]。椎间盘组织由中心胶冻状的髓核、外围的纤维环和椎体上下缘的软骨终板(cartilage endplate,CEP)组成。髓核位于椎间盘的中心位置,主要由富含Ⅱ型胶原、蛋白聚糖、弹性蛋白的细胞外基质(extracellular matrix,ECM)组成,是椎间盘承载和缓冲压力载荷的重要功能成分[2],在IDD过程中髓核最先发生改变。目前对IDD的治疗仅可缓解患者的临床症状,不能延缓或逆转IDD的进程。因此,寻找新的更有效的IDD治疗方法一直是该领域的研究热点[3-4]。
近年来,随着对干细胞疗法、基因靶向治疗及组织工程等再生医学领域的深入研究,外泌体对骨科疾病的治疗价值越来越受到关注[5-7]。来源于干细胞及其他细胞的外泌体是一类可以包裹多种生物活性物质如蛋白质、核酸等的细胞外囊泡[8]。外泌体容易获得,无免疫原性且与靶细胞具有独特的亲和性,可参与机体多种病理生理过程,如细胞凋亡、异常血管生成、炎症反应、凝血反应,以及蛋白质、脂质和RNA等物质的转移,从而调节细胞通信和表观遗传修饰,目前已被应用于IDD的重塑研究[9]。本文就不同细胞来源外泌体的生物学特性和功能及其在IDD治疗中的作用及机制进行综述,以期为后续研究提供新的思路。
1 外泌体的生物学特性及功能
几乎所有细胞都可在正常和异常状态下释放细胞外囊泡到细胞外空间。细胞外囊泡是被磷脂双层膜包围的小颗粒,根据其生物发生途径、大小、蔗糖密度梯度、脂质组成、沉降力和内容物可分为微囊泡、凋亡小体与外泌体[10]。微囊泡和凋亡小体主要通过细胞膜出芽的方式形成。外泌体来源于细胞内,主要是由细胞膜内陷形成的多泡体(multivesicular bodies,MVBs)与细胞膜融合,并向外释放其包含的腔内囊泡(intraluminal vesicles,ILVs),这些被释放到细胞外的ILVs即外泌体[11-12]。三种细胞外囊泡的主要特征如表1所示。
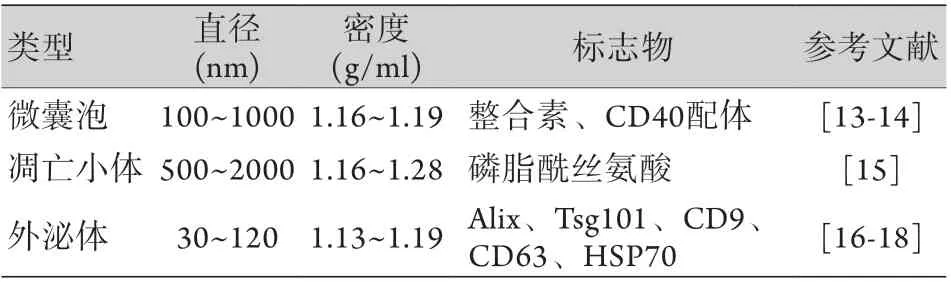
表1 细胞外囊泡的分类及主要特征Tab.1 Classification and main characteristics of extracellular vesicles
外泌体是具有脂质双层膜结构的参与细胞间通讯的纳米级膜状囊泡,呈膜性扁平状,由干细胞等多种类型的细胞分泌,可通过超速离心、密度梯度离心、聚乙二醇沉淀等方法提取,并可用纳米粒子跟踪分析、动态光散射、流式细胞术等方法进行鉴定[19]。外泌体广泛存在于血液、唾液、精液、滑液、羊水、母乳及体外的细胞培养基中,可通过有效转运生物活性蛋白、信使核糖核酸(mRNA)和微核糖核酸(miRNA)在细胞间通讯和组织再生调节中发挥重要作用[20]。
外泌体的功能主要取决于其内容物,不同细胞来源的外泌体包裹的蛋白质、脂质、核酸、细胞因子等生物活性成分的含量和种类不同,其中脂质、蛋白质及核酸是外泌体中的主要功能成分。脂质膜可促进受体细胞对外泌体的吸收,并阻止其内容物在运输过程被损坏,如保护miRNA免受RNA酶的降解,参与调控靶细胞的信息传递。外泌体中包含一系列蛋白质,如四次跨膜蛋白、热休克蛋白及与外泌体来源相关的Tetraspanins蛋白等,这些蛋白可参与膜运输及融合,并可作为表面标志物用于鉴定体外外泌体[21]。外泌体可转运核酸,如mRNA、非编码RNA,成熟的miRNA通过碱基互补配对原则与靶基因mRNA结合可抑制靶基因的转录后翻译。此外,外泌体还可诱导干细胞分化、促进自噬、促进血管生成及调节免疫功能。综上,外泌体的主要功能可能是通过保护并运输其内容物而介导细胞间的通讯[22]。
2 外泌体与IDD的关系
随着人口的老龄化,IDD已成为临床多发疾病,且近年来其发病呈现年轻化趋势。IDD是导致中老年人腰腿疼痛的主要原因之一,但其具体发病机制仍不清楚,是当前临床亟待解决的一大难题。现有的研究表明,IDD的发病机制与炎性因子的累积、ECM的异常分解代谢、细胞凋亡等关系密切[23]。外泌体作为细胞间相互调控的囊泡,主要通过其内容物调控基因的表达及细胞功能,从而延缓甚至逆转IDD的发生与发展。
Lu等[24]将来源于骨髓间充质干细胞的外泌体与退变的髓核细胞共培养发现,随着共培养时间延长,细胞增殖明显增加;蛋白聚糖及Ⅱ型胶原等ECM的表达量与共培养时间呈正比,退变相关基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达量随着培养时间的延长而逐渐下降,表明骨髓间充质干细胞来源的外泌体可促进髓核细胞增殖及维持ECM平衡。
髓核细胞过度凋亡是IDD的主要病理特征。将尿液干细胞来源的不同浓度的外泌体与压力载荷诱导的髓核细胞共培养,采用Western blotting及TUNEL染色检测细胞凋亡情况,结果显示,髓核细胞凋亡率随外泌体浓度的增加而降低[25]。Luo等[26]分别用正常与退变终板软骨干细胞来源的外泌体处理过氧化氢(H2O2)诱导的髓核细胞,结果显示,与退变终板软骨干细胞来源的外泌体比较,正常终板软骨干细胞来源的外泌体明显降低了凋亡蛋白cleaved caspase-3和Bax的表达以及TUNEL染色阳性率,增加了抗凋亡蛋白Bcl-2的表达。Zhang等[27]的研究发现,脂多糖(lipopolysaccharide,LPS)与外泌体共处理组髓核细胞中NLRP3、caspase-1和cleaved GSDMD的表达水平明显低于脂多糖单独诱导组。上述研究结果提示外泌体可减轻髓核细胞的凋亡反应。
此外,外泌体在治疗IDD的其他方面也发挥了重要作用。例如干细胞来源的外泌体可降低CEP细胞凋亡蛋白caspase-3、7、9及钙化相关蛋白runt相关转录因子2(Runx2)的表达,即外泌体可抑制CEP细胞的凋亡和钙化反应[22]。脊索细胞来源的外泌体可抑制脐静脉内皮细胞的迁移及血管管道的形成,且抑制效果与外泌体的给药剂量呈正比;将非退变纤维环细胞外泌体与人脐静脉内皮细胞共培养,结果显示外泌体可降低内皮细胞的迁移速度。由此可见,外泌体可抑制椎间盘组织中异常血管再生,延缓IDD的发生[28-29]。干细胞来源的外泌体减少了H2O2诱导的髓核细胞炎性因子[一氧化氮合酶(iNOS)、白细胞介素-6(IL-6)]的表达,提示外泌体可减轻炎症反应[30]。
IDD的主要特征是异常应力、炎症反应等不利因素的刺激引起髓核细胞数量减少和ECM降解。外泌体通过促进髓核细胞增殖,抑制髓核细胞凋亡/焦亡、椎间盘异常血管增生以及炎性因子的产生而增加有活性髓核细胞的数量,改善椎间盘的炎症微环境。因此,外泌体可能是延缓甚至逆转IDD的潜在选择。
3 外泌体治疗IDD的潜在机制
3.1 促进干细胞向类软骨样髓核细胞转化 近年来,促进干细胞向类软骨样髓核细胞转化是IDD治疗研究的一个重要方向。将正常髓核细胞来源的外泌体与干细胞共培养,检测干细胞中蛋白聚糖、Ⅱ型胶原基因和蛋白的表达,发现干细胞中蛋白聚糖和Ⅱ型胶原等ECM的表达量与共培养时间呈正比,即共培养时间越长,ECM的表达量越多,提示髓核细胞来源的外泌体可诱导干细胞向类软骨样髓核细胞分化,从而促进有活性的髓核细胞数量增加,维持ECM的稳态[24,31-32]。
3.2 抑制炎症反应 研究发现,炎性小体可通过增加IL-1β、肿瘤坏死因子-α(TNF-α)等炎性因子的表达来诱导MMP、解聚蛋白样金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTs)的产生而水解蛋白聚糖、Ⅱ型胶原等ECM成分,进而参与IDD的病理过程[33]。外泌体可明显抑制炎症反应及炎性小体的形成。Xia等[30]的研究发现,干细胞来源的外泌体与H2O2共处理组炎性因子环氧化酶-2(COX-2)、iNOS和炎性小体TXNIP-NLRP3的蛋白和mRNA表达水平高于空白对照组,低于H2O2单独处理组,提示干细胞来源的外泌体可通过抑制炎性小体的形成来发挥抗炎作用,从而下调ECM降解蛋白酶的表达,减缓ECM的分解代谢反应,维持ECM的稳态,延缓IDD的进程。
3.3 抑制细胞凋亡、促进细胞增殖 IDD主要是因细胞死亡导致髓核细胞数量减少及ECM降解,异常应力、炎症反应、内质网应激等不利因素刺激可引起细胞死亡,而凋亡是髓核细胞死亡的主要形式。因此,IDD的治疗应以抑制髓核细胞凋亡、促进细胞增殖为主。
错误折叠蛋白质的累积、Ca2+的消耗及氧化还原状态的改变可介导内质网过度应激反应,引起细胞凋亡。研究发现,在压力负荷或糖基化终末产物诱导的髓核细胞凋亡模型中加入干细胞来源的外泌体后,内质网应激相关蛋白(GRP78、GRP94)、激活作用转录因子(ATF6)、内质网应激的凋亡调节因子(CHOP)表达降低,未折叠蛋白反应(UPR)的分支蛋白激酶R样内质网激酶(PERK)、肌醇依赖性激酶1α(IRE1α)的磷酸化水平降低,而蛋白激酶B(AKT)和细胞信号调节激酶(ERK)的磷酸化水平升高,髓核细胞凋亡相关蛋白caspase-3、12的表达明显降低,提示干细胞来源的外泌体可通过激活AKT、ERK信号转导通路来抑制内质网应激诱导的细胞凋亡[25,34]。
3.4 通过miRNA调控椎间盘组织修复 miRNA是一类长度不超过20个碱基的非编码RNA,是调节基因表达的关键转录后抑制因子。miRNA主要是与靶基因mRNA的3'UTR通过碱基互补配对原则结合抑制转录后翻译来进行基因表观遗传学修饰,沉默靶基因的表达或调控多个疾病相关信号转导通路[35]。骨髓、胎盘来源的外泌体可改变椎间盘组织中多种miRNA的表达水平,尤其是一些调节细胞凋亡、炎症反应的关键miRNA分子,是外泌体应对组织损伤和修复的有效调节因子。多项研究发现,miRNA在延缓IDD的发生和发展中起着重要作用,miRNA的表达谱与髓核细胞的增殖、凋亡,炎症反应,以及ECM重塑等明显相关;但miRNA在椎间盘组织间隙容易被降解,而外泌体的递送可通过保护miRNA不被降解来改善miRNA的短期稳定性[36]。因此,不同细胞来源的外泌体包裹的miRNA可通过调节基因表达和细胞功能参与椎间盘的修复及重塑,是外泌体治疗IDD的潜在机制[37]。具体如表2所示。
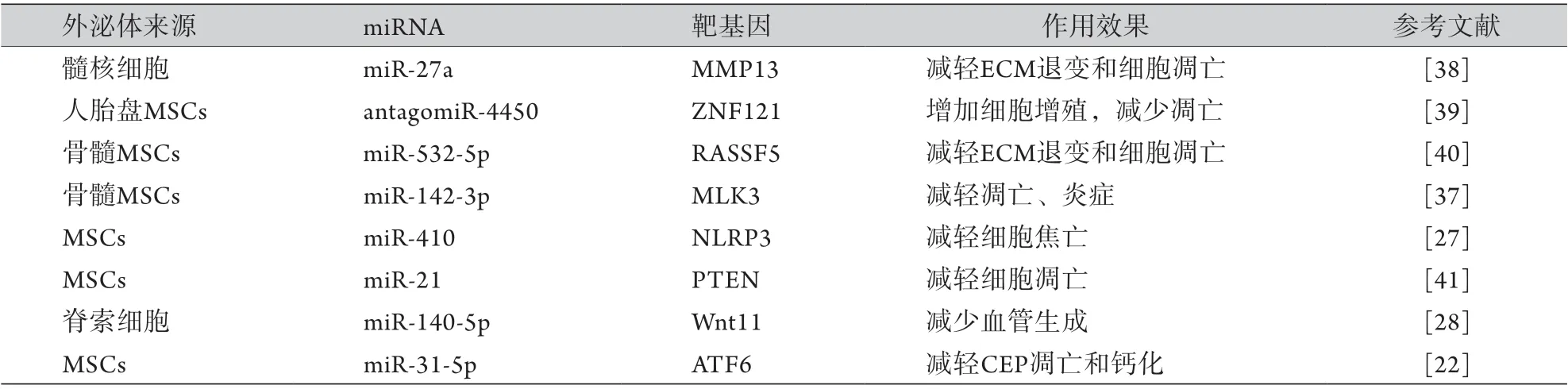
表2 外泌体中miRNA在IDD治疗中的研究Tab.2 Studies on miRNA in exosomes in the treatment of intervertebral disc degeneration
Zhang等[38]的研究发现,自噬激活髓核细胞来源外泌体包裹的miR-27a可与MMP13靶向结合而降低MMP1、3、9、13以及ADAMTs 4、5基因的表达,增加蛋白聚糖、Ⅱ型胶原蛋白的表达以维持ECM的稳态。Zhu等[40]发现,骨髓间充质干细胞来源的外泌体可显著减轻ECM降解及髓核细胞凋亡,且主要是外泌体中miR-532-5p通过下调RASSF5基因的表达来实现的;双重荧光素酶报告实验分析结果显示,miR-532-5p含有野生型RASSF5基因3'UTR的互补结合位点,表明野生型RASSF5是miR-532-5p的直接靶基因。Zhu等[37]研究发现,骨髓间充质干细胞来源外泌体中的miR-142-3p可通过下调混合谱系激酶3(MLK3)的表达来调控髓核细胞的凋亡和炎症反应,显著降低TNF-α、IL-6、IL-8、IL-12等炎性因子的表达及髓核细胞凋亡率;通过miRNA靶标分析工具(TargetScan)分析发现,miR-142-3p可与野生型MLK3的3'UTR互补结合;进一步研究发现,外泌体中的miR-142-3p可通过靶向结合MLK3而降低IL-1β诱导的p38、JNK、ERK的磷酸化水平,即外泌体中miR-142-3p通过靶向结合MLK3来抑制MAPK信号通路的激活,从而延缓IDD的发生与发展。
Cheng等[41]的研究发现,间充质干细胞来源外泌体中的miR-21可与PTEN靶向结合并下调其表达,从而抑制TNF-α诱导的髓核细胞凋亡,进一步研究发现,沉默PTEN基因后磷酸化的AKT表达增加,抗凋亡蛋白Bcl-2的表达上调,而凋亡相关蛋白Bax、cleaved caspase-3的表达明显下调,提示外泌体包裹miR-21可靶向抑制PTEN基因的表达,从而激活磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K-AKT)信号转导通路,进而抑制髓核细胞的凋亡。
此外,Xie等[22]使用H2O2诱导终板软骨细胞建立退变模型发现,与H2O2单独诱导组相比,使用间充质干细胞来源的外泌体与H2O2诱导的终板软骨细胞共处理,可明显下调终板软骨干细胞凋亡相关蛋白caspase-3、7、9及钙化相关蛋白Runx2和BMP-2的表达;生物信息学分析发现,外泌体中miR-31-5p水平明显升高,且可靶向结合并抑制ATF6基因的表达,提示外泌体中miR-31-5p通过下调ATF6的表达来减轻终板软骨细胞的凋亡和钙化。
综上,不同细胞来源的外泌体主要是通过其包裹的miRNA与相应的靶基因结合而抑制炎症、凋亡相关基因的表达,进而发挥延缓IDD的作用,提示外泌体中包裹的miRNA可能是其发挥保护作用的潜在机制。外泌体作为一种潜在的促进椎间盘修复的细胞外囊泡,其作用机制可能是包含的内容物通过调节靶基因及相关信号通路来发挥抗炎、抗凋亡、维持ECM稳态的作用,然而具体调节机制尤其是外泌体促进髓核细胞增殖的机制仍不明确,仍需进一步研究。
4 总结与展望
多项研究表明,外泌体参与并减轻了IDD的多种病理生理过程,但其延缓或治疗IDD的作用机制仍不明确。尽管外泌体可通过其内容物进行细胞间通讯和表观遗传修饰,调节髓核细胞的功能,从而恢复有活性的髓核细胞数量,维持ECM稳态,减轻炎症反应,但其应用于IDD的治疗仍存在诸多挑战。如外泌体提纯、靶向运输、给药剂量、给药方式,以及外泌体的细胞来源、生长状态和培养条件等均可影响外泌体的作用;椎间盘作为体内最大的无血管组织,承载着持续的压力负荷,椎间盘组织中高渗、低氧、低pH、低营养的微环境不利于髓核细胞的增殖和外泌体的稳定[42];一些外泌体可能通过其包裹的非编码RNA沉默髓核细胞中有利基因的表达而加速IDD的发生[43]。然而随着对椎间盘及外泌体研究的不断深入,外泌体在IDD治疗中的应用前景将更加广阔。
