应对ESKAPE病原菌医院感染的新兴抗菌策略研究进展
2021-09-24万美辰仇珺蒙萌马雨轩顾俊婷焦凯牛丽娜
万美辰,仇珺,蒙萌,马雨轩,顾俊婷,焦凯,牛丽娜*
1军事口腔医学国家重点实验室/口腔疾病国家临床医学研究中心/陕西省口腔医学重点实验室/空军军医大学口腔医院修复科,西安 710032;2军事口腔医学国家重点实验室/口腔疾病国家临床医学研究中心/陕西省口腔医学重点实验室/空军军医大学口腔医院牙体牙髓病科,西安 710032;3军事口腔医学国家重点实验室/口腔疾病国家临床医学研究中心/陕西省口腔疾病临床研究中心/空军军医大学口腔医院口腔黏膜科,西安 710032
ESKAPE病原菌即屎肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属(Enterococcus faecium,Staphylococcus aureus,Klebsiella pneumonia,Acinetobacter baumannii,Pseudomonas aeruginosa,Enterobacter species,缩写ESKAPE),是医院感染中最常见的条件致病菌。ESKAPE病原菌突变能力强,对目前临床使用的多种抗菌药物均能产生耐药性,增加了耐药菌感染的治疗难度,且使耐药菌感染治疗失败所致的病死率明显增高[1]。预计在2050年,全球范围内因耐药菌感染导致的死亡人数将会上升到百万级别[2]。本文综述了后抗生素时代ESKAPE病原菌产生的抗生素问题,以及这一系列问题带来的思考和警示,并详述了应对ESKAPE病原菌的新兴策略,包括抗毒力策略、抑制生物膜形成、抗菌肽(antimicrobial peptides,AMPs)、植物来源的抗菌制剂、纳米药物输送系统(nanoparticle drug delivery system,NDDS)、光动力抗菌疗法及噬菌体疗法等。
1 概 述
ESKAPE病原菌感染常导致较高的病死率,且其治疗费用高昂,往往带来较重的经济负担。据美国疾病控制与预防中心估测,在美国,每年由ESKAPE病原菌导致的感染超过200万人次,至少造成23 000人死亡[3]。同时,美国应对5种病原菌(金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌)的成本约为29亿美元/年[4]。对于一些中、低收入的发展中国家来说,形势则更加严峻。2000-2015年,全球抗生素消耗量增长了65%,主要是由中低收入国家推动的[5]。
掌握ESKAPE病原菌的某些遗传特性是解决这一系列问题的重要策略之一。为逃逸抗生素的作用,细菌可产生两种不同类型的耐药性:先天性耐药和获得性耐药。先天性耐药是指某些细菌天生对某些抗菌药物不敏感。其中,鲍曼不动杆菌能够产生碳青霉烯酶,这类酶可以水解碳青霉烯类抗生素的β-内酰胺酶[6];铜绿假单胞菌的耐药性则更为复杂,可能与酶的产生、膜通透性及靶位的改变、生物膜的合成及适应性耐药的产生等有关[7]。而肠杆菌科、多耐药铜绿假单胞菌、多耐药鲍曼不动杆菌可产生β-内酰胺酶,这种β-内酰胺酶能够破坏β-内酰胺类抗菌药物(如青霉素类、头孢菌素类)的β-内酰胺环,从而使该类药物失去抗菌性能。获得性耐药的破坏性则更强,它是指细菌借助于可移动元件(如接合性质粒、转座子、插入序列和整合子)获得耐药相关基因[8]。ESKAPE病原菌突变能力强,繁殖速度快,其产生的适应性基因突变可通过质粒迅速传播。其中,肺炎克雷伯菌临床分离株通常携带多样性的可接合性质粒,使耐药性可以通过接合作用在菌株间甚至不同菌种间传播[9]。
另外,一些客观原因也起着重要作用。其中,抗生素的不规范使用一直以来是全球范围内较为公认又难以解决的问题之一。抗生素种类选择不当、剂量不足,患者对抗菌治疗的依从性差等,均会增加抗生素的耐药性。其原因可能在于学界对于ESKAPE病原菌耐药性产生机制的理解尚不全面以及不平衡的经济因素制约了新药的研发进度。据统计,2007-2009年美国门诊共开具4000万例抗生素处方,其中2700万例(67.5%)被证明是不必要的[10]。我国的情况也不容乐观。据统计,世界上80%的β-内酰胺类抗生素及90%的氨基糖苷类抗生素均产自我国,且我国抗生素人均年消费量约为138 g[11]。世界卫生组织的调查显示,在我国门诊感冒患者中,抗生素使用率约为75%,住院患者抗生素使用率为80%,而对于外科手术患者来说,抗生素使用率高达95%,这些数据均高于国际水平[12]。
抗生素的研发投入成本高、周期长、失败率高、投资回报率低。据估计,在全球范围内,平均每种抗生素的研发时间长达11.8年,需耗资15亿美元[13]。这导致多数医药企业不愿研发抗生素类药物。泰地唑利作为一种可有效应对ESKAPE病原菌的 唑烷酮类抗生素,就因生产成本过高而限制了其推广。除产品开发的成本外,因生产抗生素而造成的环境污染也成为抗菌道路上的又一阻碍。制药废水中的大部分为抗生素生产废水,且此类废水中的重铬酸盐指数(CODcr,即采用重铬酸钾作为氧化剂测定出的化学耗氧量)高、生物毒性高、色度高、pH波动较大,治理难度大[14]。2014-2019年应对ESKAPE病原菌的抗菌药物发展迅速,已被批准的新药[15-23]见表1。但是,这些关于ESKAPE病原菌的相关报道目前主要集中在实验室研究或临床前研究阶段,仍需对此类药物的安全性及有效性进行进一步验证。
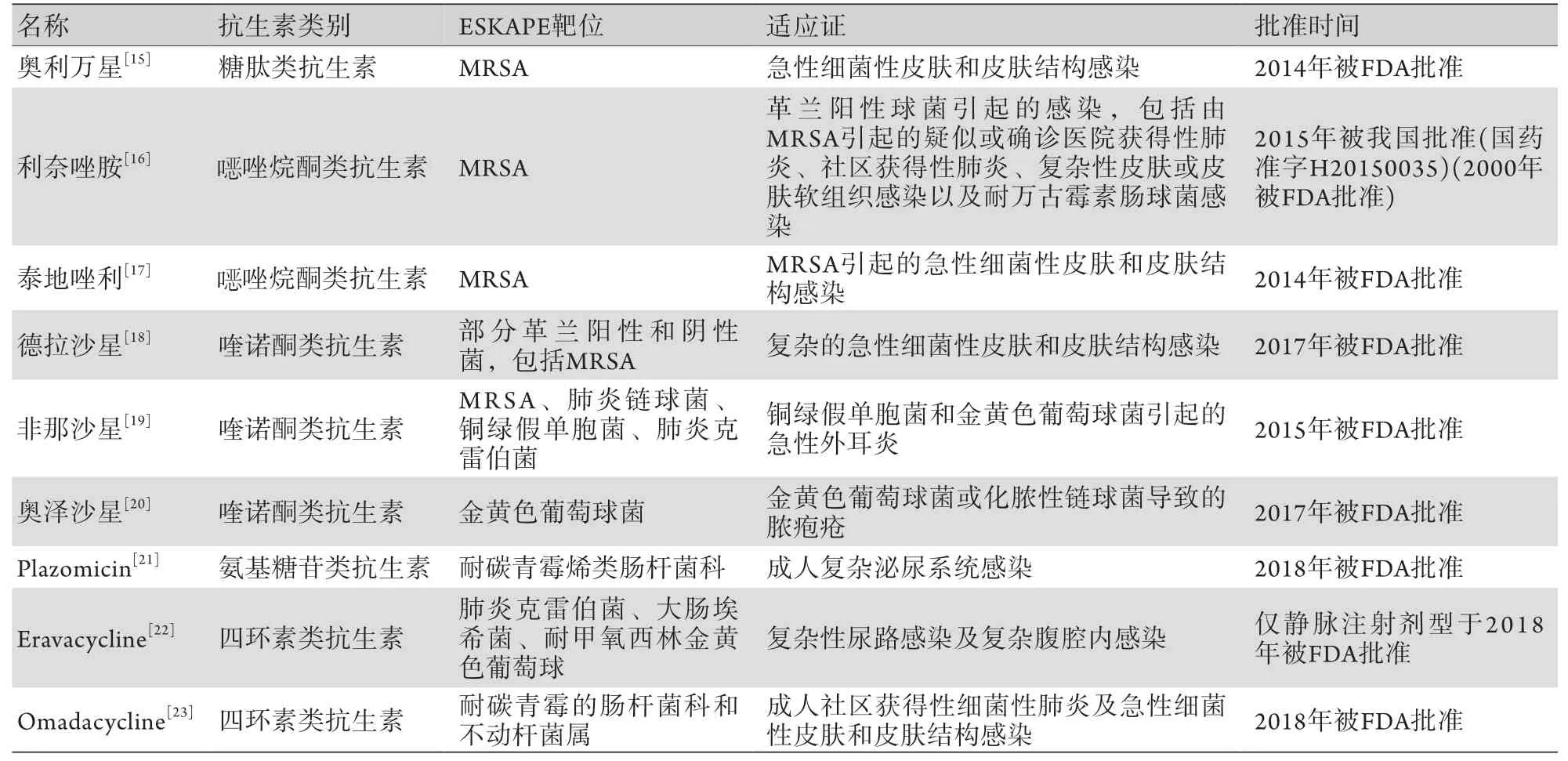
表1 2014-2019年批准的应对ESKAPE病原菌的新药Tab.1 New drugs approved from 2014 to 2019 for combating ESKAPE pathogens
传统方法应对耐药菌感染耗时、耗材,效率低。近年来,一些应对ESKAPE病原菌的新兴策略不断出现,逐渐成为临床试验及抗菌治疗领域的热点。学界正试图通过这些潜在新兴抗菌策略在一定程度上缓解耐药菌给医院感染带来的压力。
2 抗毒力策略
毒力是病原菌致病的主导因素,尤其是在慢性感染中发挥着重要作用。抗毒力策略能够靶向干扰细菌的重要毒力因子或抑制毒力相关性状的表达,且不会抑制其他益生菌的活性。抗毒力药物的使用有望减少广谱抗菌药物的用量,并降低耐药菌株出现的频率。
2.1 黏附、定植及侵袭抑制剂 细菌进入宿主后,必须传播到特定部位才能导致感染的发生。因此,掌握细菌黏附、定植的机制对于实现抗毒力策略至关重要。例如,菌毛是大肠埃希菌黏附在宿主特定位点的特殊结构,其多样性可能与致病过程中细菌的组织趋向性及物种特异性相关,这一靶点的发现为抗耐药菌感染的治疗提供了新思路。Dang等[24]发现,菌毛抑制剂(pilicides)可通过Chaperone-Usher途径抑制1型黏附性菌毛的装配,使菌毛无法在细菌表面表达,从而抑制细菌的黏附,为抑制大肠杆菌在宿主细胞上的附着提供了可能性。同时,研究表明,这些菌毛分子也是肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌抗感染治疗的目标靶点之一[25]。然而,菌毛容易发生基因突变,这将会给菌毛相关抗菌药物的研发带来一定挑战。
2.2 抑制毒力基因表达 铜绿假单胞菌能够活跃表达外毒素A(toxin exotoxin A,ETA)、T3SS等毒力因子。其中,T3SS在多种病原菌中均可稳定表达,因此T3SS抑制剂可能对多细菌感染的临床治疗有效。目前,已研发出抑制铜绿假单胞菌ETA的分子——1,8-萘二甲酰亚胺(1,8-naphthalimide,NAP)。体外实验结果表明,NAP是抑制铜绿假单胞菌ETA表达最有潜力的药物之一。然而,NAP较低的溶解度限制了其体内活性[26]。相关证据表明,铜绿假单胞菌毒力因子的表达与组氨酸激酶传感器组成的双组分系统(two-component systems,TCS)相关。在烧伤患者创面提取的铜绿假单胞菌分离物中加入TCS抑制剂PA14后,试验菌株的毒力显著下降[27]。细菌活性酶是另一种病原菌毒力相关因子。细菌活性酶抑制剂ClpP(caseinolytic mitochondrial matrix peptidase proteolytic subunit)是一种ATP依赖的蛋白水解酶,其诱导的蛋白水解可在不杀死病原菌的条件下使细菌失去毒力,有研究发现ClpP可有效作用于金黄色葡萄球菌,使其失去致病性[28]。
3 抑制生物膜形成
生物膜是被胞外大分子包裹的有组织的细菌群体。它作为细菌在宿主中生存和传播的重要机制,能够将菌体包裹在生物膜内,使其免于暴露在抗生素的作用下,从而增加耐药菌对传统抗菌药物的耐受能力。因此,能够合成生物膜的细菌造成的临床感染具有更加顽固的耐药性[29]。
生物膜的形成及扩散是一个受基因和环境高度调控的过程。其中,群体效应(quorum sensing,QS)系统作为主要调节因子,通过调控细胞密度依赖性基因的表达,抵抗环境中的不利因素,调控菌体的群体行为。铜绿假单胞菌拥有复杂的包含多个靶点的QS系统网络,精密调控着细菌毒力基因的表达。干扰铜绿假单胞菌的QS系统,不仅能够抑制铜绿假单胞菌毒力因子的生成,有助于机体通过自身免疫系统清除致病菌,同时也可抑制生物膜的形成,从而增强抗菌药物的作用效果,有望缓解铜绿假单胞菌耐药性的产生[30]。目前已发现了几种QS抑制剂,包括假单胞菌喹诺酮信号通路阻滞剂、丁子香酚、阿司匹林、布洛芬、ZnO纳米颗粒及吲哚美酰亚胺[30]等。同时,一些已用于临床的药物也具有潜在的QS抑制活性:部分大环内酯类抗生素(如阿奇霉素)可通过抑制铜绿假单胞菌QS活性而降低其毒力因子的表达;氨溴索可破坏铜绿假单胞菌生物被膜;抗寄生虫药物氯硝柳氨可明显抑制铜绿假单胞菌毒力因子的合成及生物被膜的形成[31]。一些体外实验数据表明,抗生物膜药物与抗生素联合使用可靶向作用于ESKAPE病原菌的生物膜,并增强抗生素的作用效能。其中,碳霉素能破坏鲍曼不动杆菌形成的生物膜,并可增强左氧氟沙星对生物膜内鲍曼不动杆菌的清除作用;阿奇霉素与亚胺培南联合使用可下调肺炎克雷伯菌luxS基因的表达,从而进一步抑制生物膜的活性[32]。
4 抗菌肽
AMPs是由机体特定基因编码并经诱导产生的多肽,普遍存在于动物、植物和微生物中,是自然界生物非常重要的免疫防御体系,可防御入侵的病原菌并增强免疫反应,故又称为宿主防御肽。AMPs具有广泛的抗菌特性,其药效动力学有别于传统抗生素,且其导致细菌产生耐药性的可能性较低。目前已有大量AMPs成为新型抗菌治疗策略或其补充治疗的潜在候选药物。
4.1 作用机制及耐药性 AMPs具有多重杀伤机制,其中最重要的一点在于其对细菌细胞膜的破坏。带正电荷的AMPs可通过静电吸附作用黏附至带负电荷的细菌胞膜脂质上,使细菌膜通透性改变、膜功能丧失并通过膜干扰杀死细菌[33]。一些非膜干扰型AMPs则以抑制DNA、RNA和蛋白质的合成,使关键酶失活及干扰细菌细胞膜及细胞壁合成的方式发挥抗菌作用[34-36]。AMPs因具有广泛的抗菌活性及抗炎作用,可有效应对严重皮肤屏障破坏导致的多耐药菌感染,促进伤口恢复,有助于长期慢性感染伤口的愈合[37-38]。因此,AMPs被认为是治疗皮肤及软组织感染的理想方案之一。
4.2 作为备选药物的AMPs 哺乳动物来源的AMPs一度成为新药研发的热点之一。防御素和LL-37是由哺乳动物中性粒细胞和上皮细胞表达的AMPs。其中,防御素由一个α螺旋结构域和双链反平行β折叠结构域组成,而LL-37是具有两亲性α螺旋结构的线性肽链,二者对ESKAPE病原菌均具有选择性和稳定性,现已投入工业生产。在耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)及铜绿假单胞菌所致的小鼠肺囊性纤维化模型中,恒河猴θ防御素-1气雾剂表现出明显的抗菌和免疫调节活性,相关临床试验正在进行中[39]。
细菌素是一种由细菌核糖体合成的AMPs,可靶向调控病原菌生物膜的形成及其群体效应。羊毛硫作为Ⅰ类细菌素,对多耐药革兰阳性菌尤其是MRSA、耐万古霉素中间金黄色葡萄球菌和耐万古霉素的粪肠球菌等均具有抗菌活性[40]。目前,已有3种羊毛硫抗生素NAI-107[41]、Mu114012[42]和NVB302[43]进入临床前研究,且发现它们与传统抗生素联合使用时抗菌效能更高。其中,NAI-107与多黏菌素联合应用治疗鲍曼不动杆菌、肺炎克雷伯菌及铜绿假单胞菌感染具有较好的效果[44]。
环状AMPs可以防止外源肽酶的水解作用。目前可用于临床的环状AMPs包括多黏菌素、短杆菌肽、酪氨酸、杆菌肽和达托霉素等。其中,多黏菌素包括多黏菌素B和黏菌素,二者均为小的脂肽分子,已成为多耐药铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌引起感染的最后防线[45]。此外,大环肽类药物可有效应对革兰阴性ESKAPE病原菌。G0775是一种大环脂肽类的衍生物,通过非典型细菌外膜渗透机制,在体内和体外实验中均对革兰阴性ESKAPE病原菌显示出一定活性[46]。
近年来,工业生产的AMPs成为新的研究热点。研究表明,带正电荷和疏水基团的AMPs类似物对ESKAPE病原菌的抗菌活性较为显著,其灵活的骨架也为关键基团的化学修饰和编辑提供了可能性。其中,胍基官能化聚碳酸酯是一种可生物降解的合成大分子,在小鼠感染模型中,其对多耐药鲍曼不动杆菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌和MRSA均具有较好的疗效,且毒性可忽略不计[47]。有两种具有两亲性结构的带正电荷的AMPs(WLBU2、WR12)对ESKAPE临床分离株具有显著抗菌活性。其中,WLBU2可抑制铜绿假单胞菌在气道上皮形成生物膜,且对气道上皮细胞无毒性[48]。结构纳米工程化抗菌肽聚合物(structurally nanoengineered antimicrobial peptide polymers,SNAPPs)是指由赖氨酸和缬氨酸残基组成的星形肽聚合物纳米颗粒,具有稳定的单体分子结构,可以长期维持有效浓度。目前已有一些SNAPPs在体外实验中显示出较高的治疗指数[49]。然而,在添加动物血清的培养基中进行体外实验时,观察到SNAPPs的抗菌活性有所降低。可见,研发出能够在生理条件下保持较高活性的抗菌肽尤为重要。
工业生产的单克隆抗体(monoclonal antibodys,mAbs)也是一类具有显著抗菌效能的AMPs。mAbs的作用具有特异性,发生交叉耐药的可能性较小,也不会损害体内的有益菌群。它能够靶向作用于细菌抗原表位(如金黄色葡萄球菌的514G3,铜绿假单胞菌的MEDI3902),通过增强抗体依赖性的细胞吞噬和(或)补体介导的杀菌活性、非免疫系统依赖性细菌杀灭机制,提高细菌清除率[50]。另外,一些mAbs对多种可溶性外毒素具有一定活性,可识别细菌细胞表面的靶点(如金黄色葡萄球菌的MEDI4893、ASN100、Salvecin),并与其产生的外毒素特异性结合,继而中和毒素,抑制其对宿主细胞的毒性。mAbs具有较长的半衰期,不仅可减少单位时间内的给药次数,又能以类似“疫苗”的作用预防耐药菌感染。但是,mAbs在体内的作用可受宿主免疫功能的影响,因此其在体内的药代动力学及药效学过程是复杂、非线性的。在过去的5年中,已开展过5项关于mAbs的Ⅰ/Ⅱ期临床试验,其中3种mAbs抗菌产品获得了FDA批准,但均不是针对ESKAPE病原菌的。值得欣慰的是,目前至少有9种与ESKAPE病原菌相关的mAbs正在开展临床试验,其中5种与金黄色葡萄球菌相关,3种与铜绿假单胞菌相关,1种与大肠埃希菌相关[51]。
AMPs作为一种新兴的抗菌策略,近年来的确展现出了一些令人欣喜的数据,但是,关于AMPs的大量研究仍停留在体外实验阶段,仅少数进入了临床试验阶段。由于体外环境无法反映先天性免疫的复杂性,因此AMPs在体内的抗菌活性仍需进一步研究。与此同时,相关实验数据证实细菌会通过膜修饰、外排泵的合成等方式对AMPs产生耐药性。由此可见,在将AMPs用于临床治疗之前,仍需进行更加深入的研究。
5 植物来源的抗菌制剂
一些植物来源的活性肽及其衍生物在结构和功能上与AMPs相似,对细菌群体效应及生物膜的形成均具有抑制作用。它们可与病原菌蛋白质结构域相结合,以影响其致病的关键步骤。以下介绍几种可作用于ESKAPE病原菌的植物来源的抗菌制剂。
精油是一种主要来源于植物叶子和花朵的提取物,可通过破坏细菌细胞膜的完整性而产生杀菌作用。体外实验证实,精油与AMPs联合使用可对金黄色葡萄球菌产生抗菌活性,但其作用原理及给药方式仍需进一步研究[52]。其中,来源于羊食阿魏(一种多年生草本植物)与紫果云杉的精油提取物对MRSA有一定抗菌活性[53];来源于非洲扁柏及寻常百里香的精油提取物对肠杆菌科细菌有一定抗菌活性,且可作为抗生素增效剂与常规抗生素联合使用[54];卡氏疟原虫EO精油与常规抗生素联合使用可应对多耐药鲍曼不动杆菌感染;从地中海植物中提取的许多精油在极低浓度下便可使铜绿假单胞菌的生物膜降解;来源于黄花草的纳米乳剂对产β-内酰胺酶的大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌及MRSA的杀菌活性均较强;茶树油可抑制细菌呼吸作用并破坏细菌膜的通透性,对MRSA、耐碳青霉烯的肺炎克雷伯菌、鲍曼不动杆菌和铜绿假单胞菌均具有一定的杀菌特性[55]。尽管植物来源的抗菌制剂在应对ESKAPE病原菌方面表现出优异的特性,但由于这些抗菌肽的分子结构较特殊,其大规模的工业合成仍较难实现。此外,精油稳定性欠佳,水溶性差,对环境因素极其敏感,这也在一定程度上限制了其应用。为应对这一问题,有学者提出可以使用纳米颗粒来封装薄荷、黄连及西番莲的精油,以提高其稳定性[56]。
天然黄酮类化合物也具有优异的抗菌活性。Farhadi等[57]发现,类黄酮可通过抑制脂肪酸合成酶复合物的活性而降低铜绿假单胞菌的毒力,且在低于最小抑菌浓度时即可抑制金黄色葡萄球菌生物膜的形成。类黄酮kβ-内酰胺类抗生素(如奥沙西林及头孢唑林)联合使用可对MRSA产生明显的抗菌作用[58]。但这一观点也备受争议:有学者发现,从肯尼亚的某些植物中分离出的类黄酮化合物是细菌外排泵的基质。因此,类黄酮与外排泵抑制剂的联合使用也是十分有必要的。
除此以外,还有多种植物可对ESKAPE病原菌产生良好的抗菌活性。半枝莲(Scutellaria barbata)在体内外实验中对多耐药鲍曼不动杆菌均表现出一定活性,与黏菌素联合使用时显示出比单用黏菌素更强的抗菌作用[59]。无水红褐色素的提取物含有大量的游离羟基,这种特殊结构使其对金黄色葡萄球菌及肺炎克雷伯菌的抗菌活性进一步增强[60]。从牛蒡中提取的绿原酸可通过抑制肺炎克雷伯菌生物膜及β-内酰胺酶的合成而有效应对顽固性肺炎克雷伯菌感染。厚叶多肉植物玉吊钟的提取物对鲍曼不动杆菌、铜绿假单胞菌及金黄色葡萄球菌的生长均有抑制作用。二氢白屈菜红碱和N-甲基卡丹汀是两种苯并菲啶生物碱,它们对MRSA均有一定的抗菌活性,可为新药的设计研发提供方向[61]。
6 纳米药物输送系统
NDDS在抗菌治疗领域中具有划时代的意义,它是一种新型给药系统,相较于传统的抗菌药物给药系统具有多重优势:可增加抗菌药物溶解度,增强抗菌药物稳定性,改善抗菌药物的生物利用度,延长抗生素半衰期以及减少药物不良反应。此外,一些NDDS还具有组织靶向性。绝大多数情况下,吞噬细胞能够识别并杀灭细菌,但仍有不少细菌可在吞噬细胞内生存,常规抗菌药物无法应对这类细菌,而纳米载体可将抗生素输送至被感染的吞噬细胞内,以应对吞噬细胞内的细菌。目前已有一些纳米制剂(如脂质体和聚合物纳米颗粒等)被用作给药载体,相关实验结果显示,NDDS可显著提高药物的治疗指数,降低药物的毒性。
6.1 脂质体NDDS 脂质体是一种球形的脂质囊泡,其大小从几纳米到几微米不等。正电荷脂质体可与带负电的生物膜表面相互作用,促进药物对生物膜的靶向作用。其中,油酸组成的脂质体对多耐药铜绿假单胞菌具有某些抗菌活性。采用油酸纳米脂质体输送法尼醇(一种抑制真菌群体效应的分子)及环丙沙星,可有效抑制多耐药铜绿假单胞菌生物膜的合成;采用聚乙二醇对这种油酸脂质体进行修饰可进一步提高其临床治疗效果[62]。此外,用壳聚糖修饰的脂质体输送盐酸万古霉素,不仅可显著提高脂质体的封装性能,还可增强其对MRSA感染的治疗效果,减少肾毒性等药物不良反应[63]。脱氧胆酸钠(具有较强渗透能力的胆汁盐)修饰脂质体可增强所载药物的生物利用度。目前,相关实验正在研究可变形脂质体输送非甾体类抗炎药吡罗昔康的临床作用,以期用于感染性皮肤病的局部治疗[64]。
6.2 聚合物纳米颗粒 聚合物纳米颗粒通常来源于聚乳酸-羟基乙酸共聚物(PLGA)或壳聚糖,以形成脂质-聚合物纳米颗粒混合物。它们与脂质体相似,均具有良好的生物相容性及可降解性,且其化学和物理性质也很稳定,可进一步提高纳米载体的稳定性及输送效率,目前已被FDA批准用于药物输送。用PLGA纳米颗粒输送阿米卡星可降低其药物毒性,且能够改善其对铜绿假单胞菌的抗菌及抗生物膜效率。此外,PLGA纳米颗粒可以透过铜绿假单胞菌产生的生物膜/黏液的致密网状结构,也可以进入病原菌所在的巨噬细胞,因此有望用于铜绿假单胞菌引起的肺部感染的临床治疗。壳聚糖是一种带正电荷、无毒的线性多糖聚合物,其纳米颗粒可穿过假单胞菌产生的黏液,协助抗菌药物发挥作用。有研究发现,壳聚糖已被用作一些多耐药革兰阳性菌抗菌药物的载体[65]。
6.3 其他纳米药物输送载体 纳米银颗粒(silver nanoparticles,AgNPs)的应用具有悠久的历史,其抗菌作用机制包括:(1)干预细菌细胞壁或细胞膜的合成;(2)干扰细菌能量代谢;(3)抑制细菌关键酶的活性;(4)抑制病原菌DNA的合成;(5)产生活性氧以影响生物膜的形成等。其中,羧甲基罗望子多糖封端的AgNP、壳聚糖封端的AgNP、阿拉伯胶封端的AgNP、聚乙烯吡咯烷酮封端的AgNP及二氧化钛封端的AgNP不仅对ESKAPE病原菌有一定的抑制活性,且可降低所输送药物的细胞毒性[66]。
此外,二维纳米抗菌剂与细胞膜间的作用机制也已引起学界的广泛关注。二硫化钼是由两个平行硫原子(S)层之间夹着单层的过渡金属原子(Mo)构成的。分子动力学实验显示,二硫化钼的氧化应激作用可导致细菌细胞膜快速去极化,并通过在细胞膜表面形成凹痕及对磷脂的萃取破坏细菌细胞膜的完整性[67]。
石墨烯和氧化石墨烯也是十分有前景的纳米抗菌制剂。氧化石墨烯边缘尖锐,能够产生活性氧,可破坏细菌细胞膜,这些独特的理化性质决定了其优异的抗菌活性。在体外实验中,氧化石墨烯表现出了对金黄色葡萄球菌和铜绿假单胞菌的抗菌及抗生物膜活性[68],而体内实验显示其可有效控制多耐药肺炎克雷伯菌的感染[69]。纳米二氧化硅也拥有优异的生物相容性和表面活性,对铜绿假单胞菌及MRSA临床分离株生物膜的形成具有显著活性[70]。
近年来NDDS发展迅速,但一些纳米抗菌颗粒也会引起安全隐患。纳米颗粒可穿过血脑屏障,从而引起心脏自主控制失调及DNA损伤。目前认为,纳米颗粒的一些理化性质,如降解性、表面性质、表面电荷、颗粒直径和形状等,可能与其细胞毒性相关[71]。因此,在投入临床使用之前,仍需对其生产控制、毒性测定及其代谢过程进行更加细致深入的研究。
7 光动力抗菌疗法
20世纪初,光动力抗菌化学疗法(photodynamic antimicrobial chemotherapy,PACT,也称光动力疗法,photodynamic therapy,PDT)逐渐成为一种新兴抗菌策略[72-73]。PDT技术有3个重要元素:氧气、光敏抗菌剂及光源。白光可使活化的光敏抗菌剂将氧气转化为单线态氧和羟基自由基等活性氧以杀死附近的病原菌。良好的光敏抗菌剂具有较高的水溶性、对病原菌的选择性及对人体细胞较低的毒性。其中,甲苯胺蓝、TiO2纳米颗粒及ZnO纳米颗粒等光敏剂对鲍曼不动杆菌的抗菌活性已被证实[74]。
多项临床试验证实,PDT可影响病原菌生物膜的形成[75]。由于革兰阴性细菌带负电荷,因此带正电的光敏抗菌剂对其更有效;同理,带负电的光敏抗菌剂通常仅对革兰阳性细菌有效。近5年关于PDT抗菌疗法的研究进展如下:含碘化物的富勒烯可用于治疗鲍曼不动杆菌感染[76];具有一个N+-甲基-吡咯烷鎓的富勒烯可用于治疗金黄色葡萄球菌感染[77];单壁碳纳米管-卟啉结合物介导的灭活作用对金黄色葡萄球菌具有显著抗菌活性[78]。在烧伤小鼠模型中,新型光敏抗菌剂Sinoporphyrin介导的PDT对多耐药金黄色葡萄球菌有明显的杀菌活性[79];在猪眼感染模型中,使用光敏抗菌剂卟啉二氢卟酚e6时也发现了类似的结果[80];在体外,带正电的卟啉及其衍生物已被用作光敏抗菌剂,以应对MRSA和铜绿假单胞菌感染[81]。在临床上将PDT与抗生素联合使用可提高金黄色葡萄球菌、大肠埃希菌、泛耐药鲍曼不动杆菌的清除率[82]。虽然PDT在理论上可很大程度满足临床需求,但目前这种抗菌策略对宿主细胞毒性的相关体内实验数据不足,仍需进一步研究。
8 噬菌体疗法
噬菌体可吸附在致病菌的表面受体上,抑制生物膜形成,导致其毒性减弱,甚至使病原菌几乎丧失致病能力。目前已有几项临床试验证实,一些噬菌体可用于应对铜绿假单胞菌、大肠埃希菌和金黄色葡萄球菌感染[83]。噬菌体鸡尾酒疗法是指对宿主使用多种治疗相关噬菌体的新兴抗菌策略。此疗法首先需要分离并鉴定出相关致病菌,然后依据不同的致病菌使用不同种类的噬菌体,同时还需考虑患者症状、给药途径和药物剂量。近年来,学界正密切关注着噬菌体疗法的疗效及安全性,相关临床试验和病例报告数量也在明显上升。本节将简述2014-2019年噬菌体疗法的研究成果。
天然噬菌体PP1131(包含12种应对铜绿假单胞菌的噬菌体混合物)可有效应对铜绿假单胞菌导致的实验性心内膜炎,其与环丙沙星的作用十分相似[84]。噬菌体OMKO1可用于治疗铜绿假单胞菌引起的主动脉瓣移植术后慢性感染,且未观察到复发感染[85]。此外,一些噬菌体对尿路感染患者尿液中分离出的大肠埃希菌和肺炎克雷伯菌菌株均有一定的溶解作用[86]。在一项随机双盲Ⅰ/Ⅱ期临床试验中,对铜绿假单胞菌感染的烧伤创面使用PP1131,结果显示,PP1131能够有效降低病原菌活力,但其作用往往慢于常规治疗。肌病毒科噬菌体家族成员(LysAm24、LysECD7及LysSi3)的内溶素能够杀灭铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌[87]。目前,鸡尾酒疗法已成功应用于合并多耐药鲍曼不动杆菌感染的弥散性结核患者中。有研究在1例急性肾损伤患者中发现,单体噬菌体也有一定的抗菌活性,可有效治疗铜绿假单胞菌所致的败血症,患者经治疗后血液细菌培养及C反应蛋白结果均转为阴性,发热症状也消退[88]。
噬菌体与抗生素联合使用可干扰细菌耐药性的进化,从而显著降低细菌致病性;且由于耐药机制间存在竞争关系,对噬菌体和抗生素同时产生耐药性的突变菌株极少见。其中,噬菌体KARL-1与传统抗生素(美洛培南、环丙沙星、黏菌素)联合使用可有效应对多耐药鲍曼不动杆菌[89]。然而,尽管许多体外实验结果均证实了噬菌体与抗生素联合使用的有效性,但也有研究提出了噬菌体治疗的风险,如一些噬菌体突变体的出现会影响此新型疗法的效果。因此,在二者联合使用时,噬菌体与抗生素类型的选择及比例的确定均须经过完善的科学研究和临床试验证实。
噬菌体疗法有一定研究潜力,但也面临很多挑战。首先,噬菌体鸡尾酒疗法需针对每位患者的不同情况量身定制,而泛泛的药品调控机制与个性化的噬菌体疗法常常难以统一。因此,越来越多的学者提倡立法者应完善针对特殊药品的法规。其次,噬菌体抗菌制剂的生产及监管系统尚未规范,且噬菌体疗法的相关研究和临床试验数据仍然较少,限制了其临床应用。第三,噬菌体的一些自身特性也限制了其抗菌效率。作为一种毒力因子,噬菌体可被宿主的先天性免疫和适应性免疫系统快速清除,因此,应合理优化噬菌体的输送过程。第四,一些鸡尾酒疗法涉及未知的噬菌体混合物,而此类混合物是否能够用于临床治疗仍有待商榷。在推进噬菌体临床应用的过程中,用药监测、药物剂量和个体化制剂的管控尤为重要。部分初期临床试验证实,噬菌体的体内运用暂未出现明显安全隐患,但仍有少数临床试验显示,噬菌体疗法的疗效具有不确定性[89-90]。因此,必须开展噬菌体疗法的Ⅲ期临床试验。同时,药物开发人员与监管机构应尽快建立监管框架,以便于进一步的测试和研究,以验证药物的安全性和有效性。
9 总结与展望
本文总结了应对ESKAPE病原菌的新兴策略(如AMPs、NDDS、PDT等),其中NDDS作为一种新兴的药物输送载体,可协助药物到达作用位点,从而减少药物用量,并显著提高抗菌药物的治疗指数。噬菌体与抗生素联合使用可干扰细菌耐药性的进化,从而使细菌的致病性明显降低。然而,噬菌体作为一种毒力因子,可被宿主的先天性免疫和适应性免疫系统快速清除。此外,PDT被认为是一种难以产生耐药性的疗法,可影响生物膜的形成。相关数据已证实,PDT与抗生素联合使用可提高金黄色葡萄球菌、大肠埃希菌、泛耐药鲍曼不动杆菌的清除率[43]。虽然此类新兴抗菌策略的研究数据大多尚停留在临床前阶段,但是这些阶段性研究成果提示新兴抗菌策略具有广阔的应用前景。相信随着未来临床试验的进一步开展,这些潜在的新兴抗菌策略有望成为传统抗菌疗法的补充和替代手段,在一定程度上缓解耐药菌给医院感染带来的压力。
