超声引导下经皮热消融治疗低风险甲状腺乳头状微小癌的安全性和有效性
2021-09-24朱玲玲戴慧勇张海鹰
朱玲玲,戴慧勇,张海鹰
解放军联勤保障部队第928医院超声科,海口 520000
甲状腺癌是最常见的内分泌恶性肿瘤,其中甲状腺乳头状癌是最常见的亚型[1],而直径≤10 mm的病变定义为甲状腺乳头状微小癌(papillary thyroid microcarcinoma,PTMC)[2]。PTMC临床进展缓慢,预后良好,病死率较低[3]。尽管大多数PTMC患者可通过手术进行有效治疗,但由于目前甲状腺癌存在过度治疗的情况,因此其治疗策略仍存在争议,尚未达成共识[4]。当前推荐的治疗方法为单纯观察及放射性碘消融的全甲状腺切除术。对于不愿意手术、手术风险高或拒绝观察的PTMC患者,建议采用微创局部治疗,可根除小的PTMC结节[5-6]。热消融主要包括射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)和激光消融(laser ablation,LA)。对于甲状腺良性结节,超声引导下热消融治疗安全有效[7-8]。目前评估热消融疗效的研究多是散发性和回顾性的[9],样本量较小。本研究旨在评价超声引导下经皮热消融治疗PTMC的临床安全性和有效性。
1 资料与方法
1.1 研究对象 本研究为前瞻性研究,研究中心为解放军联勤保障部队第928医院。纳入标准:(1)单个病灶直径<10 mm;(2)经超声引导下细针穿刺活检(FNAB)或细针活检证实PTMC;(3)无甲状腺包膜接触及破裂(距离≥2 mm);(4)超声及CT检查颈部未见转移性肿瘤,胸部X线片检查颈部以外未见转移性肿瘤;(5)超声提示合适的穿刺路线;(6)全身麻醉风险高不适合手术和(或)拒绝手术者;(7)因对疾病过度恐惧而拒绝临床观察,要求进行微创治疗者。排除标准:(1)超声及病理证实为多灶性;(2)病理诊断为其他类型的恶性肿瘤如甲状腺髓样癌等;(3)病灶内出现钙化结节;(4)有甲状腺癌家族史和(或)有放疗史和(或)其他高危因素者;(5)有对侧声带功能障碍者;(6)凝血功能障碍和严重心肺疾病者;(7)拒绝签署知情同意书。本研究通过解放军联勤保障部队第928医院医学伦理委员会审批(2020S377),所有患者对本研究内容知情并签署知情同意书。
1.2 样本量估算 以有效率为主要结局指标。根据既往研究,患者有效率为95.8%[10],以α=0.05、Ⅱ型错误概率β=0.1计算,根据公式n=[(uα+uβ)S/δ]2+1/2×uα2(n为样本量;u为检验统计量;S为总体标准差;α为假设检验第一类;β为等效标准;δ为容许的误差0.25S)预估样本量最少为96例,假定研究对象的失访率为20%,所需样本量至少120例,本研究共纳入214例。
1.3 消融仪器设备 RFA系统(Star RF ElectrodeFixed,STARmed Co.,Ltd.,South Korea)由射频(RF)发生器和匹配电极组成。蠕动泵以80 ml/min的速度通过电极的灌注口灌注冷冻水(15~20 ℃),以防止组织炭化并改善射频能量沉积的半径。微波消融仪器采用KY2000 MWA系统(中国南京康友医疗器械有限公司),由MWA发电机、柔性低损耗同轴电缆和专用甲状腺冷却轴天线组成。在热消融前后及随访期间进行常规超声和对比增强超声(CEUS)检查。本研究中超声设备主要为IU22(菲利普斯医疗系统,美国华盛顿州博塞尔)。
1.4 消融前评估 在RFA和MWA前,使用实时超声评估每个PTMC结节的3个正交直径(最大直径和2个垂直直径)、体积、位置、回声、内部结构、轮廓、形状(高度/宽度)、钙化情况和血管密集度,计算肿瘤体积(V)和体积缩小比(VRR)。V(cm3)=abcπ/6(a为最大直径,b和c为其他两个垂直直径);VRR=(初始体积-最终体积)/初始体积[11]。此外,对患者进行凝血及甲状腺功能[总三碘甲腺原氨酸(TT3)、总甲状腺素(TT4)、游离三碘甲腺原氨酸(FT3)、游离四碘甲状腺素(FT4)和甲状腺刺激激素(TSH)]检测。凝血功能正常的患者可以接受治疗,长期使用抗凝药的患者须在治疗前至少3 d停药。
1.5 观察指标 所有指标均采用盲法评估。主要观察指标:患者术后有效率。次要观察指标:术后并发症发生率。患者术前进行甲状腺超声和超声造影检查,测量消融肿瘤的直径和消融区域面积,明确术前肿瘤的体积、位置、回声、内部结构、轮廓、形状(高度/宽度)、钙化情况和血管密集度。此外,患者进行凝血及甲状腺功能(TT3、TT4、FT3、FT4和TSH)检测。
1.6 射频消融手术及术后评估和随访 根据PTMC结节的大小、位置、血流和内部成分确定最合适的穿刺路径和消融类型。消融后,患者在院观察1~2 h,并根据临床体征评估消融期间及消融后发生的任何并发症和症状。随访时进行超声、超声造影、甲状腺功能检测,消融术后1、3、6和12个月进行临床评估,满1年后每6个月进行1次评估。随访时采用常规超声和超声造影检查以评估消融区域的变化情况,同时测量消融区域(定义为无强化区)的直径,并检测可能复发和转移肿瘤的发展。随访期间,在超声引导下进行FNAB,以评估部分患者的消融区域和所有怀疑有转移的淋巴结。
1.7 统计学处理 使用SPSS 23.0软件(SPSS Inc.,Chicago,IL,USA)进行统计分析。计量资料以±s表示。随访期间每个连续间隔(即热消融后即刻及1、3、6、12、18个月)消融区域的VRR比较采用单次重复测量的方差分析,进一步两两比较采用配对t检验;热消融前与热消融后1个月甲状腺功能检查结果比较采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料 根据纳入排除标准,2017年6月-2019年6月解放军联勤保障部队第928医院招募256例PTMC患者接受热消融治疗,排除失访和不服从治疗计划的患者42例,最终纳入214例(连续随访不短于12个月)。其中男62例(29.0%),女152例(71.0%),年龄17~77(44.1±13.1)岁。左叶PTMC结节108个,右叶结节106个;等回声3个,低回声211个;肿瘤最大直径0.2~1.0(0.59±0.18) cm;囊实混合瘤25例(11.7%),实性瘤189例(88.3%);28例(13.1%)肿瘤边缘光滑、界限清楚,136例(63.6%)肿瘤边缘呈分叶状或不规则,50例(23.4%)肿瘤边缘模糊;56例(26.2%)有微钙化灶,158例(73.8%)无钙化灶;114例(53.3%)肿瘤无血管化,79例(36.9%)肿瘤仅见周围血管化,7例(3.3%)肿瘤血管化程度低,主要集中在肿瘤中心位置,有或完全没有血管,14例(6.5%)肿瘤血管化程度高(表1)。RFA最大输出功率为15~45(30.82±3.96) W,总传送时间为30~840(97.86±121.01) s。在热消融后1、3、6、12和18个月进行随访,随访时间12~18(15.14±3.01)个月。
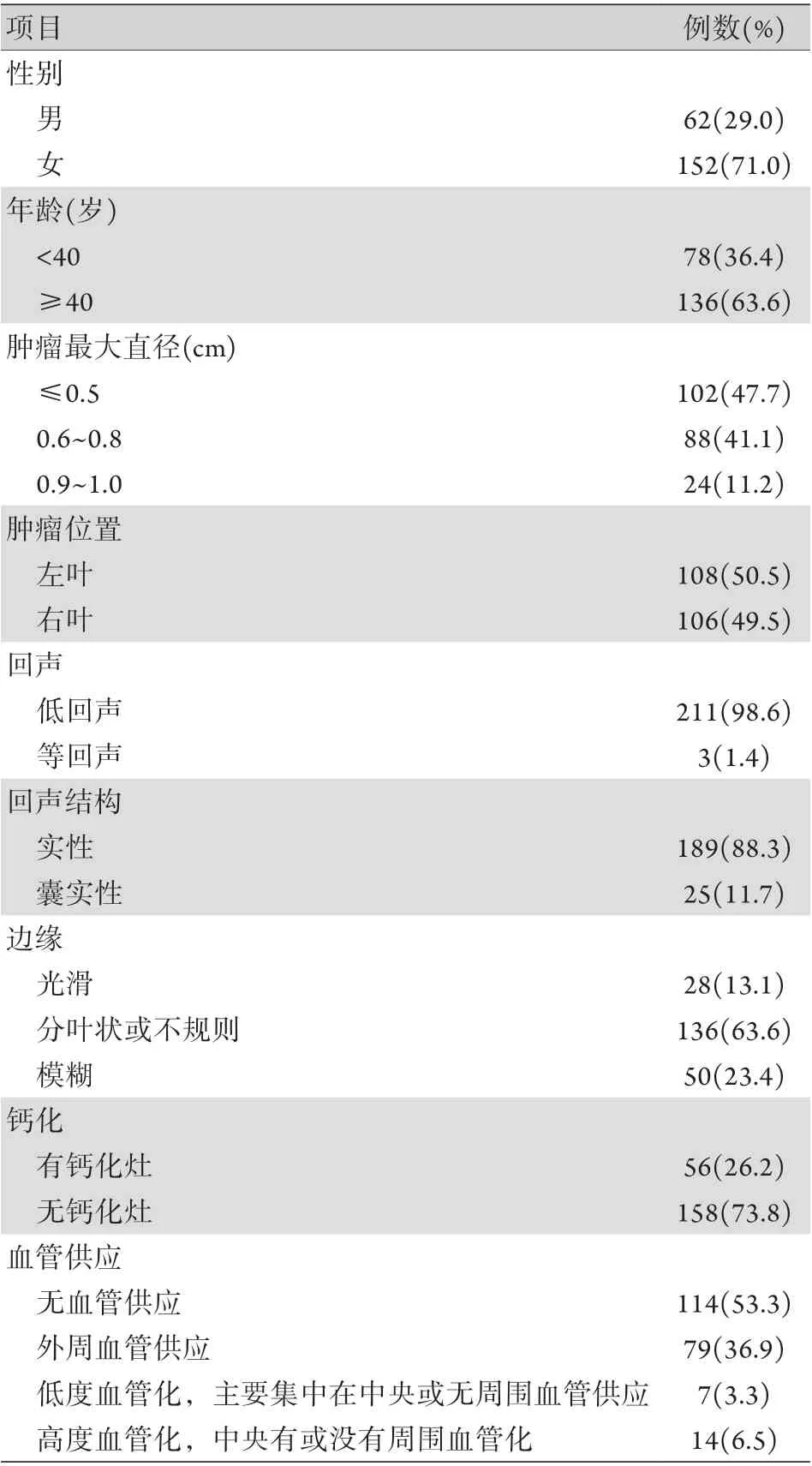
表1 214例甲状腺乳头状微小癌患者的临床特点Tab.1 Clinical characteristics of 214 patients with papillary thyroid carcinoma
2.2 热消融后和随访时消融区域的变化情况最初热消融后,消融区域的最大直径为0.7~3.0(1.372±0.440) cm,随访1、3、6、12和18个月逐渐减小至0.4~2.9(1.108±0.438) cm、0~2.5(0.753±0.440) cm、0~1.6(0.483±0.324) cm、0~0.8(0.162±0.205) cm、0~0.5(0.047±0.140) cm;最初热消融后,消融区域的体积为0.109~10.978(1.083±1.819) cm3,随访1、3、6、12和18个月逐渐减小至0.019~7.463(0.606±1.259) cm3、0~5.217(0.273±0.784) cm3、0~0.946(0.069±0.154) cm3、0~0.093(0.006±0.156) cm3、0~0.012(0.001±0.004) cm3。
2.3 热消融术后肿瘤组织VRR比较 热消融术后1、3、6、12和18个月VRR为0.040~0.979(0.457±0.218),0.259~1.000(0.837±0.150),0.491~1.000(0.943±0.090),0.938~1.000(0.994±0.012)和0.992~1.000(0.999±0.002)。每两次随访之间的VRR比较差异均有统计学意义(P<0.001,表2)。
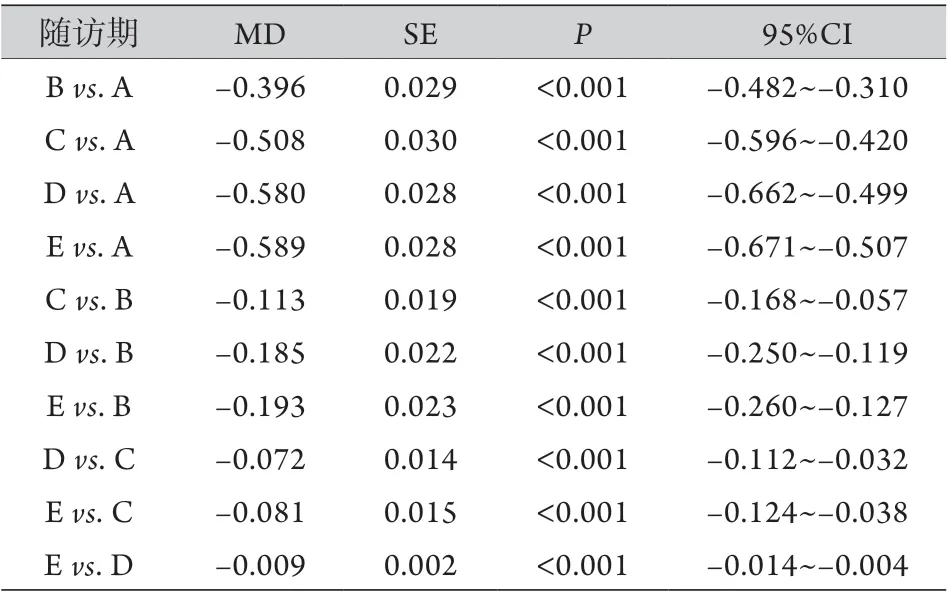
表2 甲状腺乳头状微小癌患者每个连续随访时间(热消融后即刻和1、3、6、12、18个月)的VRR比较Tab.2 Pairwise comparisons of volume reduction ratio among each consecutive followup time (immediately, at 1, 3, 6, 12, and 18 months after thermal ablation) of patients with papillary thyroid carcinoma
2.4 热消融前后甲状腺功能检查结果比较 热消融前及热消融后1个月,所有患者甲状腺功能检查结果均正常,差异无统计学意义(P>0.05,表3)。随访期间,超声未发现复发性甲状腺结节和颈部淋巴结转移,超声或CT未发现远处转移。在超声引导下,64例(29.9%)在消融区边缘和残留甲状腺组织周围区域进行了FNAB,以排除随访期间的复发,穿刺结果显示为坏死物质和炎性细胞,但没有存活的肿瘤细胞。
表3 甲状腺乳头状微小癌患者热消融前与热消融后1个月甲状腺功能检查结果比较(±s)Tab.3 Thyroid function examination results of patients with papillary thyroid carcinoma before 1 month and after thermal ablation (±s)
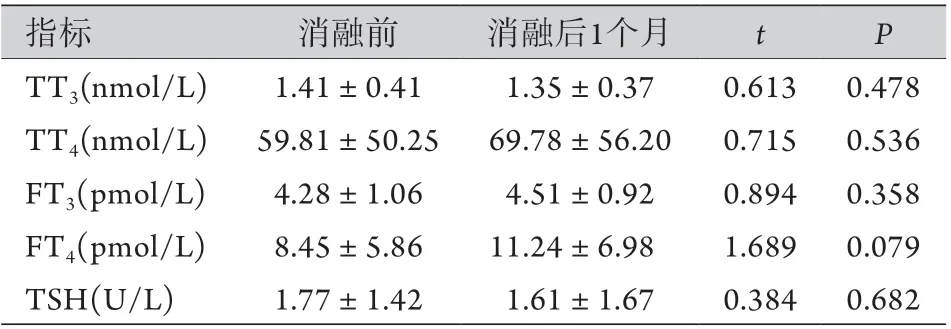
表3 甲状腺乳头状微小癌患者热消融前与热消融后1个月甲状腺功能检查结果比较(±s)Tab.3 Thyroid function examination results of patients with papillary thyroid carcinoma before 1 month and after thermal ablation (±s)
TSH. 促甲状腺激素;TT3. 总三碘甲腺原氨酸;TT4. 总甲状腺素;FT3. 游离三碘甲腺原氨酸;FT4. 游离四碘甲状腺素
指标 消融前 消融后1个月 t P TT3(nmol/L) 1.41±0.41 1.35±0.37 0.613 0.478 TT4(nmol/L) 59.81±50.25 69.78±56.20 0.715 0.536 FT3(pmol/L) 4.28±1.06 4.51±0.92 0.894 0.358 FT4(pmol/L) 8.45±5.86 11.24±6.98 1.689 0.079 TSH(U/L) 1.77±1.42 1.61±1.67 0.384 0.682
2.5 热消融术后并发症和不良反应发生情况本组患者对PTMC结节热消融的耐受性均良好。热消融术后最常见的并发症为轻微疼痛(31.8%,68/214)。部分患者在消融过程中出现牙痛、下颌下放射性疼痛和单侧头痛,停止消融术疼痛症状立即缓解。热消融术后24~48 h,所有局部疼痛症状均得到缓解,无需治疗。热消融后,无一例患者出现发热、皮肤烧伤、出血和水肿,12例(5.6%,12/214)主诉出现短暂的颈部肿胀,4例(1.9%,4/214)出现声音嘶哑,分析原因为直接热损伤引起神经损伤或结节周围水肿,从而引起神经压迫,给予甲钴胺素神经营养治疗后3个月痊愈。
3 讨 论
高频颈部超声和超声引导下FNAB的广泛应用使PTMC的检出率增高。PTMC进展缓慢,临床治疗目前仍存在争议。一般建议进行手术治疗,即同侧腺叶切除联合中央淋巴结清扫,部分患者术后行甲状腺激素抑制治疗并给予131I治疗。然而,部分患者由于年龄大、手术风险高、严重的合并症、担心术后瘢痕以及疼痛等原因,并不满足手术条件[12-13]。2015年美国甲状腺协会(ATA)指南指出,对于低风险的PTMC患者,观察随访是一种安全的选择,可以替代立即手术切除。然而,一小部分PTMC患者则表现为淋巴结局部或远处转移,选择观察随访可能会导致病情恶化。目前暂无可靠的临床特征可将少数进展期PTMC患者从大量阴性患者中区分出来[14]。
多数患者在被诊断为“癌症”携带者时通常非常焦虑甚至抑郁,拒绝进行临床观察,并要求尽早切除病变。笔者认为,一旦PTMC结节被热消融原位灭活,肿瘤进展或向外转移的风险可消除或显著降低。因此,热消融作为一种用于消除PTMC病变的微创介入治疗方式,可能是一种可选的治疗策略。Min等[15]和Bo等[16]的研究发现,热消融术治疗PTMC效果显著,术后创伤轻,可以显著改善患者的生活质量。最新研究表明,经皮热消融已成为有症状的甲状腺小结节患者的微创手术替代方案,特别是对于非手术候选者、手术高危个体或拒绝手术的患者效果更佳[17-18]。
近年来,超声引导的PTMC热消融治疗受到关注。与经皮乙醇注射相比,热消融可诱导甲状腺结节明确的坏死区域[19-20]。与外科手术相比,热消融手术更具成本效益,可快速进行,无需住院或治疗后监测等。Valcavi等[21]论证了首次治疗后LA应用于PTMC的临床可行性,表明完全消融(包括安全边际)可能导致完全的病理根除。最近有研究证实了热消融(如LA、MWA和RFA)治疗单个PTMC的可行性、有效性和安全性[22-23]。Zhou等[19]的回顾性研究中,30例单发PTMC患者接受LA作为主要治疗,手术耐受性较好,未发生严重并发症;其中29例在一次局部麻醉下成功治疗,仅1例经皮LA术后立即进行超声造影证实有不完全消融,因此进行了第二次消融。随访结果显示患者肿瘤未再生长、局部复发和远处转移。陈洁怡等[24]的研究发现,甲状腺良性结节患者在增强超声引导下行经皮微波消融术可有效降低并发症发生率,减轻炎症反应,促进恢复,该结果体现了热消融术的优势。
本研究采用RFA方式进行热消融,与激光烧蚀相比,RFA的烧蚀温度较低。此外,本研究采用了动弹射击技术,该技术可以控制包括肿瘤及周围软组织在内的消融区域。如果肿瘤与关键结构之间的距离非常小(<5 mm),则使用另一个针头(23号针头)注射生理盐水以形成至少1 cm的距离,从而防止热损伤。本研究发现,所有消融的PTMC结节在RFA治疗后体积均明显减小。与热消融后即刻的体积相比,消融后1、3、6、12和18个月消融区域的VRR分别为0.457±0.218、0.837±0.150、0.943±0.090、0.994±0.012和0.999±0.002,每两次随访之间的VRR差异明显(P<0.001)。虽然本组患者随访时间为12~18(15.14±3.01)个月,但所有患者在RFA术后3个月均接受了CNB,病理结果表明消融区域无残留肿瘤,甲状腺实质周围无复发肿瘤,证实PTMC病变已完全消除。
与良性甲状腺结节相比,本组患者热消融后VRR结果较好,可能是由于PTMC的消融面积明显小于既往文献报道的良性结节[25-26]。此外,Teng等[27]的研究发现,使用较低功率消融的PTMC患者的VRR结果可能更好,因为低功率消融可使肿瘤的凝血坏死过程更温和,消融区域的“过度燃烧”更少且辐射吸收更容易。
Baek等[28]报道,RFA的并发症发生率虽然较低,但可能会引起声音改变、结节破裂、甲状腺功能减退、臂丛神经损伤、血肿、呕吐、皮肤烧伤等各种并发症。本研究中,4例(1.9%)在热消融后立即主诉声音嘶哑,均在3个月内痊愈;68例(31.8%)治疗后出现短暂的局部不适和局部疼痛,治疗停止后即消失,未见其他严重并发症。热消融前与热消融后1个月患者甲状腺功能检查结果正常,并给予左旋甲状腺素以确保TSH水平维持在0.5~2.0 mU/L。本研究随访期间未发现残余肿瘤或转移。
本研究存在一定的局限性:(1)为单中心研究,样本量小;(2)随访期较短,长期结果仍不确定。PTMC及其复发性肿瘤临床病程缓慢,因此,治疗结果的长期随访非常必要;(3)超声引导下经皮热消融作为治疗PTMC的新策略,尚未制定标准功率、输出时间和热消融能量;(4)由于消融前FNAB很难确定细胞亚型,因此未进一步区分PTMC的不同细胞学亚型。
综上所述,本研究结果表明,超声引导下经皮热消融治疗低风险PTMC安全性高、创伤小、并发症少,且可保留甲状腺功能,是治疗低风险PTMC安全有效的替代策略,特别是对于不适合手术的患者。然而,超声引导下经皮热消融治疗的远期疗效和复发率仍需进一步观察和验证。
