草苁蓉多糖对人肝癌细胞侵袭迁移的影响及机制
2021-09-24华龙王晨宇姚坤厚李小全
华龙,王晨宇,姚坤厚,李小全
1河南大学淮河医院普通外科,河南开封 475000;2河南大学第一附属医院检验科,河南开封 475001
肝细胞癌(hepatocellular carcinoma,HCC)为临床常见的恶性肿瘤,发病率和死亡率均较高,严重影响人类的生命健康[1]。HCC起病隐匿,早期缺乏明显的临床表现,恶性程度较高,多数患者确诊时已为中晚期,肿瘤已发生远处转移和侵袭[2-3]。目前临床上主要通过手术并辅以放化疗等治疗HCC,但术后极易复发和转移[4],患者术后5年生存率较低,因此寻找新的药物抑制肝癌细胞的侵袭和转移对提高患者生存率具有重要意义。草苁蓉常用于抗衰老,具有补肾壮阳、润肠止血等功效,草苁蓉多糖(Boschniakia rossicapolysaccharides,BRPS)是其主要活性成分之一,具有调节免疫、抗癌、抗氧化等多种生理活性,且无毒副作用,应用前景广阔[5]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是细胞应对低氧环境的保护因子[6],可通过调节多种因子的表达而激活相关信号通路,参与上皮-间质转化(epithelial-mesenchymal transition,EMT),促使肿瘤细胞脱离原发病灶发生远处转移[7-8]。目前BRPS与肝癌相关的研究较少,其作用机制尚不明确。本研究旨在探讨BRPS对肝癌细胞侵袭迁移的影响并分析其可能机制,以期为临床应用BRPS治疗HCC提供依据。
1 材料与方法
1.1 主要试剂及仪器 BRPS(95%,陕西新天域生物科技有限公司);LV-HIF-1α和LV-HIF-1α-NC慢病毒及感染增强液ENi.s.(江苏吉凯生物技术有限公司);Hoechst33258试剂盒(上海碧云天生物技术有限公司);兔抗人HIF-1α单抗、E-钙黏蛋白单抗、波形蛋白单抗及山羊抗兔IgG-HRP(美国Abcam公司)。Transwell小室(美国Corning公司);DYCP-31DN电泳仪(北京六一生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 人肝癌HepG2细胞株购自美国ATCC公司,37 ℃水浴复苏后于含10%胎牛血清、100 U/ml青霉素及100 μg/ml链霉素的RPMI 1640培养基中,置于37 ℃、5% CO2培养箱中培养。待细胞贴壁80%左右,用胰酶消化传代,选取对数生长期细胞进行后续实验。
1.2.2 MTT法检测细胞活力 取对数生长期细胞,PBS清洗,0.25%胰蛋白酶消化,接种于96孔板中(1×105个/ml),分别加入含有不同浓度(12.5、25、50、100、200 μg/L)BRPS的培养基,每个浓度设置5个复孔,另设不加BRPS的空白对照组,培养24 h。每孔加入10 μl MTT溶液(5 mg/ml),继续孵育4 h;每孔加入150 μl二甲基亚砜,充分振荡10 min,使用酶标仪检测490 nm波长处的吸光度(A)值,计算细胞存活率。细胞存活率(%)=药物组A490/空白对照组A490×100%。选取细胞存活率接近50%的BRPS浓度进行后续实验。
1.2.3 细胞转染及分组 转染方法:转染前1 d,取对数生长期细胞接种于6孔板中,培养24 h,使用ENi.s.将聚凝胺稀释至5 μg/ml,并将LV-HIF-1α和LV-HIF-1α-NC慢病毒稀释至1×108TU/ml,每孔分别加入880 μl ENi.s.、100 μl聚凝胺和20 μl病毒液,继续培养12 h,观察细胞形态。更换新鲜培养基,72 h后荧光显微镜下观察荧光表达情况,使用嘌呤霉素筛选稳定株。取对数生长期细胞,随机分为对照组、HIF-1α-NC组、HIF-1α组、BRPS组与BRPS+HIF-1α组。对照组细胞常规培养;HIF-1α-NC组细胞转染LV-HIF-1α-NC后,筛选稳定株常规培养;HIF-1α组细胞转染LV-HIF-1α后,筛选稳定株常规培养;BRPS组细胞加入50 μg/L BRPS培养;BRPS+HIF-1α组细胞转染LV-HIF-1α筛选稳定株后,再加入50 μg/L BRPS培养。
1.2.4 Hoechst33258染色观察肝癌细胞凋亡情况
取各组肝癌细胞,PBS清洗,加入0.5 ml固定液作用10 min,弃去固定液,PBS清洗,加入0.5 ml Hoechst33258染色液,室温染色5 min,PBS清洗,滴加荧光淬灭封片液,荧光显微镜下观察细胞凋亡情况。
1.2.5 流式细胞术检测肝癌细胞凋亡率 取各组肝癌细胞,接种于6孔板中(1×106个/ml),常规培养48 h,胰酶消化,PBS清洗,2000 r/min离心5 min,弃上清,PBS清洗;用500 μl结合缓冲液重悬细胞,加入5 μl Annexin V-FITC避光孵育15 min,加入10 μl PI染色5 min,采用流式细胞仪检测细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.2.6 划痕实验检测肝癌细胞迁移能力 取对数生长期肝癌细胞,待细胞90%贴壁后,弃去培养基,用20 μl无菌枪头在孔板底部中央垂直划线,PBS冲洗脱落细胞,分别于0、24 h进行拍照,观察划痕愈合情况,计算划痕愈合率。划痕愈合率(%)=(0 h划痕距离-24 h划痕距离)/0h划痕距离×100%。
1.2.7 Transwell实验检测肝癌细胞侵袭能力 用无血清培养液按3:1比例稀释Matrigel胶,取50 μl稀释后的Matrigel胶加入Transwell小室上室,培养箱中孵育1 h。重悬细胞,调整密度为1×105个/ml,取200 μl细胞悬液加入上室,取600 μl含血清的培养液加入下室,继续培养24 h,PBS清洗,4%多聚甲醛溶液固定30 min,0.1%结晶紫染色5 min,随机选取5个视野,显微镜下计数穿膜细胞,取平均值。
1.2.8 Western blotting检测肝癌细胞中HIF-1α、E-钙黏蛋白、波形蛋白的表达水平 收集各组肝癌细胞,PBS清洗,加入RIPA裂解液裂解细胞,12 000 r/min离心20 min,取上清;采用BCA法进行蛋白定量,制胶、上样,行SDS-PAGE凝胶电泳,转至PVDF膜上,加入封闭液室温封闭2 h,加入HIF-1α(1:500)、E-钙黏蛋白(1:500)、波形蛋白(1:500)、β-actin(1:800)一抗,4 ℃孵育过夜,TBST洗膜3次,10 min/次;加入HRP标记的二抗(1:2000)室温孵育1 h,TBST洗膜3次,10 min/次;加入ECL发光液,显影、定影,使用ImageJ软件分析,以目的蛋白灰度值与内参灰度值的比值表示目的蛋白的相对表达水平。
1.3 统计学处理 采用SPSS 24.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度BRPS对肝癌细胞增殖的影响 MTT法检测结果显示,与空白对照组比较,不同浓度BRPS作用于肝癌细胞后,细胞存活率均降低,且呈浓度依赖性(P<0.05,图1)。选取肝癌细胞存活率接近50%的BRPS浓度(50 μg/L)进行后续实验。
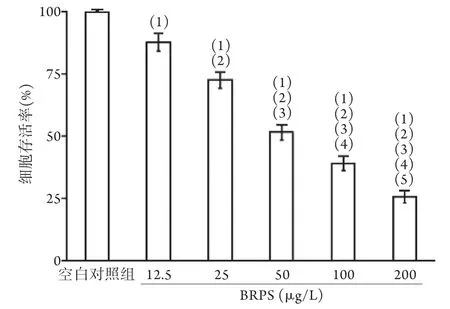
图1 不同浓度BRPS对肝癌细胞增殖的影响(n=5)Fig.1 Effect of different concentrations of BRPS on the proliferation of hepatocarcinoma cells (n=5)
2.2 慢病毒转染肝癌细胞的效果 荧光显微镜下观察显示,转染HIF-1α及HIF-1α-NC的肝癌细胞内均可见绿色荧光,转染效率均>85%,可用于后续实验(图2)。
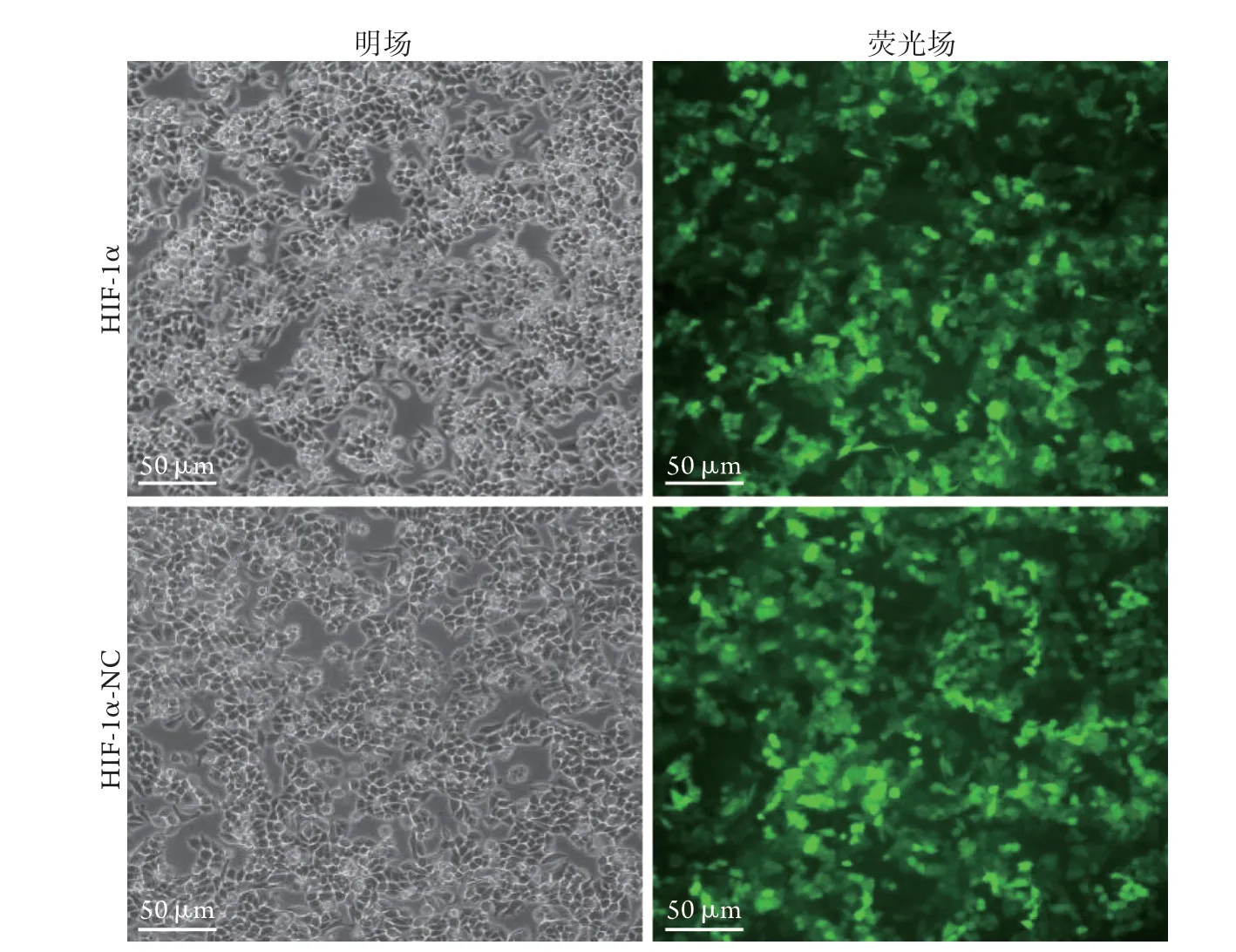
图2 慢病毒转染肝癌HepG2细胞的效果(×100)Fig.2 Transfection effect of hepatocarcinoma HepG2 cells with lentivirus (×100)
2.3 各组肝癌细胞凋亡情况 Hoechst33258染色结果显示,对照组和HIF-1α-NC组肝癌细胞发出微弱蓝色荧光,细胞核无明显形态学变化;HIF-1α组肝癌细胞蓝色荧光较弱,形态无明显变化;BRPS组发出较强蓝色荧光的细胞数量较多,细胞核碎裂呈致密浓染;BRPS+HIF-1α组致密浓染细胞较BRPS组减少(图3)。
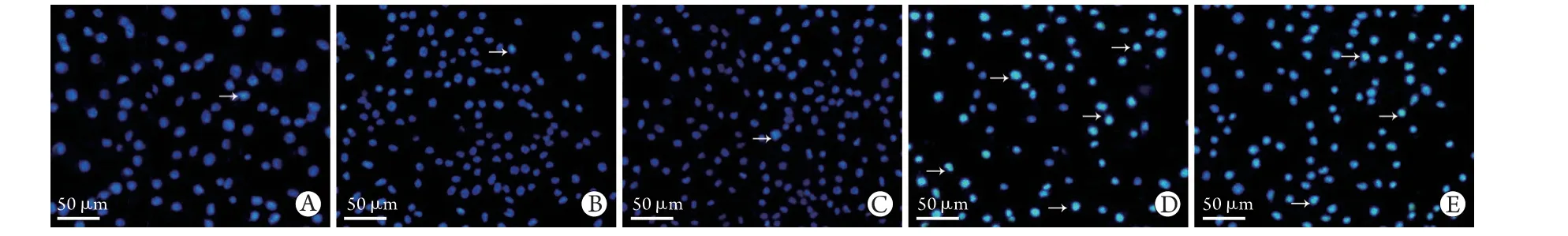
图3 各组肝癌细胞Hoechst33258染色结果(×100)Fig.3 Hoechst33258 staining results of hepatocarcinoma cells in each group (×100)
2.4 各组肝癌细胞凋亡率比较 流式细胞术检测结果显示,对照组、HIF-1α-NC组、HIF-1α组、BRPS组及BRPS+HIF-1α组细胞凋亡率依次为3.89%±1.25%、4.02%±1.18%、1.67%±0.86%、26.58%±1.63%、12.14%±1.05%。与对照组、HIF-1α-NC组比较,HIF-1α组细胞凋亡率降低,BRPS组细胞凋亡率升高,差异有统计学意义(P<0.05);BRPS+HIF-1α组细胞凋亡率高于HIF-1α组,低于BRPS组,差异有统计学意义(P<0.05,图4)。
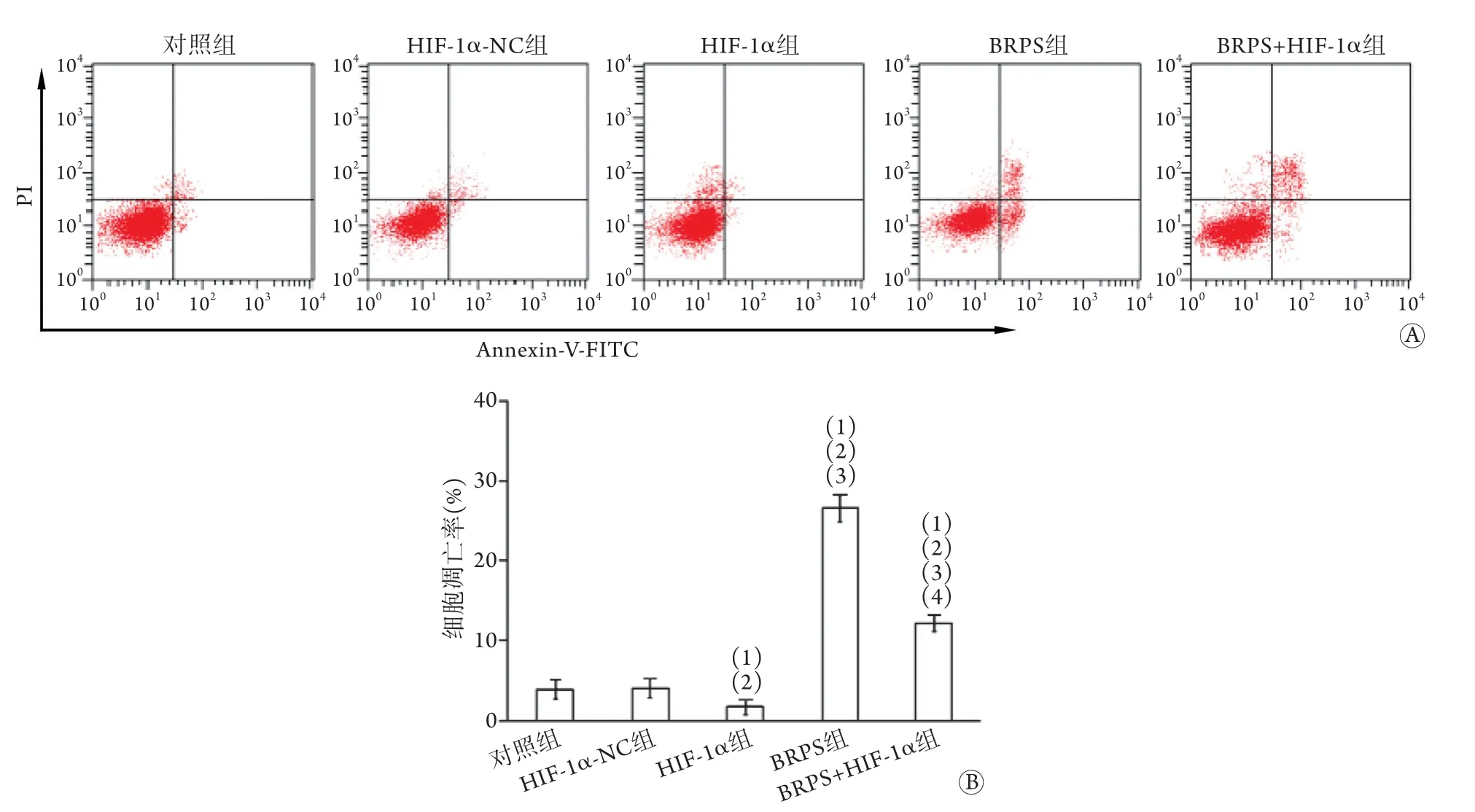
图4 各组肝癌细胞凋亡情况(n=5)Fig.4 Cell apoptosis in each group of hepatocarcinoma cells (n=5)
2.5 各组肝癌细胞划痕愈合率比较 划痕实验结果显示,对照组、HIF-1α-NC组、HIF-1α组、BRPS组及BRPS+HIF-1α组划痕愈合率依次为63.35%±3.35%、64.29%±3.57%、87.48%±3.92%、14.82%±3.81%、32.59%±3.76%。与对照组、HIF-1α-NC组比较,HIF-1α组划痕愈合率升高,BRPS组划痕愈合率降低,差异有统计学意义(P<0.05);BRPS+HIF-1α组划痕愈合率低于HIF-1α组,高于BRPS组,差异有统计学意义(P<0.05,图5)。
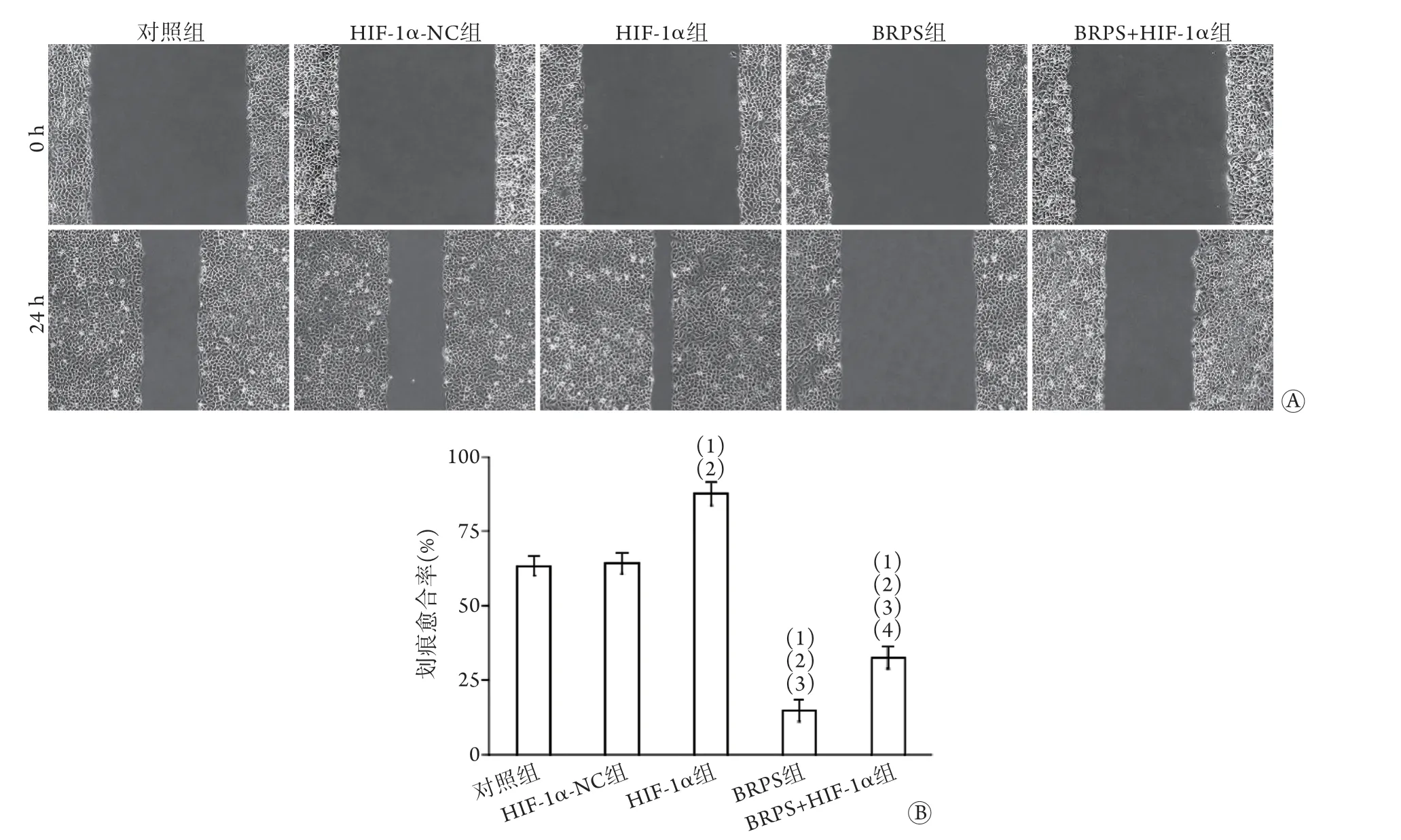
图5 各组肝癌细胞划痕愈合情况比较(n=5)Fig.5 Cell healing in each group of hepatocarcinoma cells (n=5)
2.6 各组穿膜细胞数比较 Transwell实验结果显示,对照组、HIF-1α-NC组、HIF-1α组、BRPS组及BRPS+HIF-1α组穿膜细胞数依次为(122.60±3.29)个、(125.20±3.63)个、(208.60±6.17)个、(68.80±4.25)个、(123.40±4.94)个。与对照组、HIF-1α-NC组比较,HIF-1α组穿膜细胞数增多,BRPS组穿膜细胞数减少,差异有统计学意义(P<0.05);BRPS+HIF-1α组穿膜细胞数少于HIF-1α组,多于BRPS组,差异有统计学意义(P<0.05,图6)。
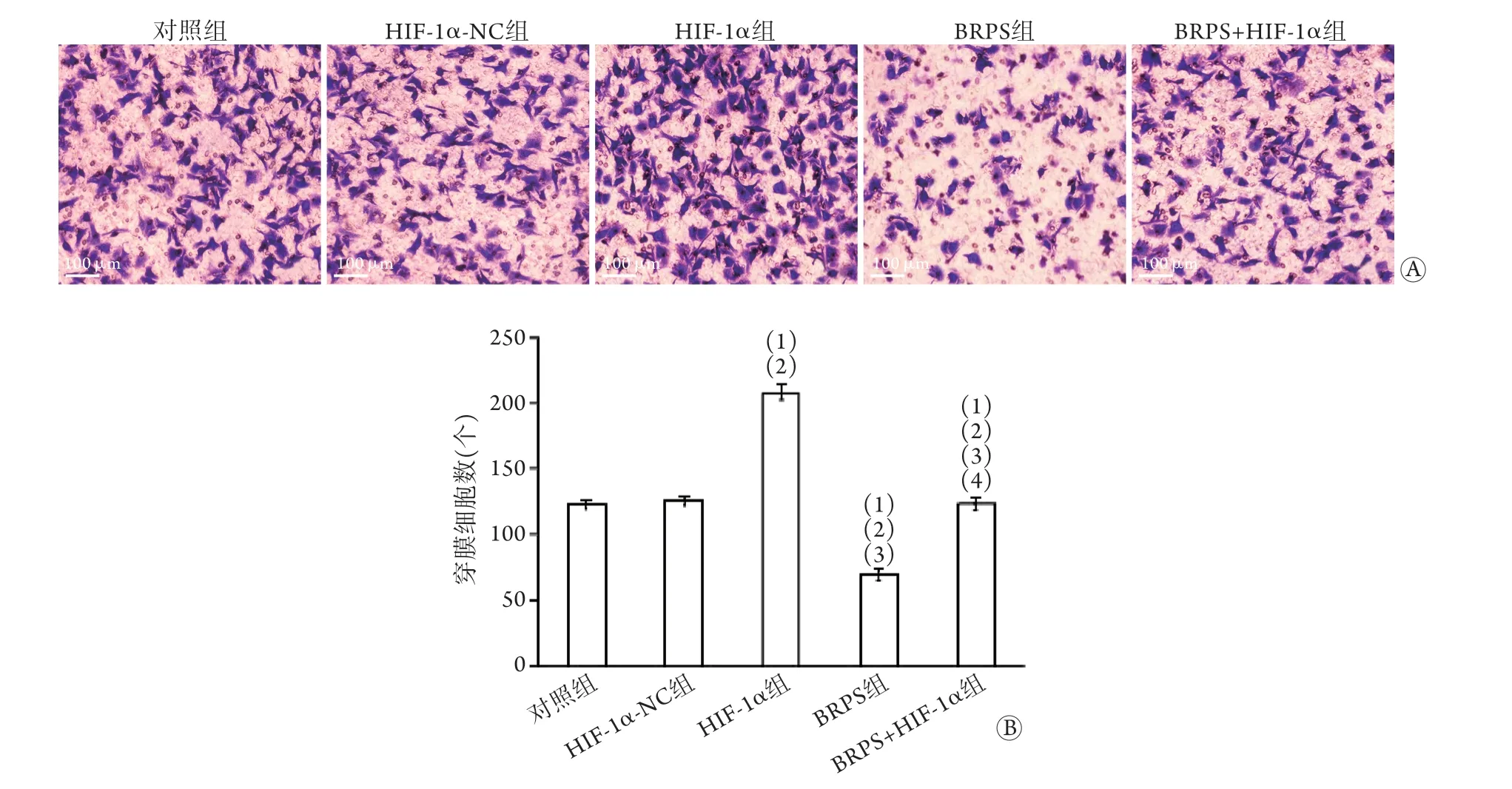
图6 各组肝癌细胞侵袭能力比较(n=5)Fig.6 Cell invasion in each group of hepatocarcinoma cells (n=5)
2.7 各组肝癌细胞中HIF-1α、E-钙黏蛋白、波形蛋白表达水平比较 Western blotting检测结果显示,与对照组、HIF-1α-NC组比较,HIF-1α组肝癌细胞中HIF-1α、波形蛋白表达水平升高,E-钙黏蛋白表达水平降低,BRPS组肝癌细胞中HIF-1α、波形蛋白表达水平降低,E-钙黏蛋白表达水平升高,差异有统计学意义(P<0.05);BRPS+HIF-1α组肝癌细胞中HIF-1α、波形蛋白表达水平低于HIF-1α组,高于BRPS组,E-钙黏蛋白表达水平高于HIF-1α组,低于BRPS组,差异有统计学意义(P<0.05,图7)。
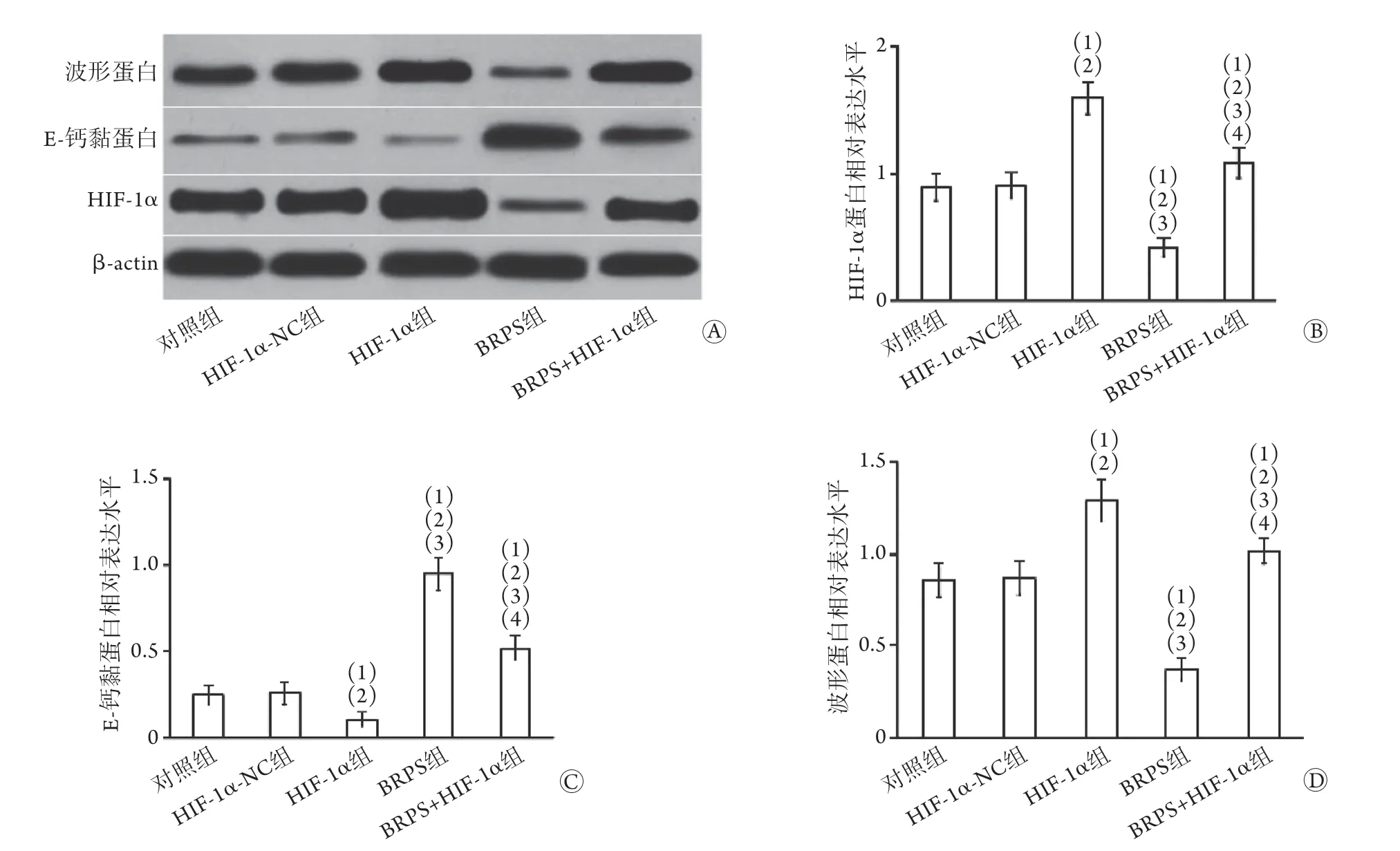
图7 各组肝癌细胞中HIF-1α、E-钙黏蛋白、波形蛋白表达水平比较(n=5)Fig.7 Comparison of the expression levels of HIF-1α, E-cadherin, and vimentin in each group of hepatocarcinoma cells (n=5)
3 讨 论
HCC的发生发展涉及多基因、多环节的共同参与,其中肿瘤微环境在该过程中发挥着重要作用。正常情况下,细胞与周围组织环境之间处于动态平衡状态,细胞发生恶变则打破了这种平衡,构建了新的营养代谢网络,产生了大量趋化因子及生长因子,构成缺氧、低pH值、间质高压的肿瘤微环境,有利于肿瘤细胞的增殖、黏附、侵袭等,这是肿瘤不断恶化并发生转移的重要原因[9-10]。缺氧是EMT的诱发因素之一,而EMT是肝癌细胞发生转移的起始过程,因此,阻断缺氧诱导的EMT成为治疗HCC的新靶点[11]。
BRPS具有多种生物活性,其保肝作用已被证实。尹学哲等[12]发现,BRPS可通过增强抗氧化能力而保护肝细胞免受氧化应激损伤。此外,BRPS还具有抗肿瘤作用。Yao等[13]发现,BRPS可通过调节凋亡相关蛋白的表达而诱导喉癌细胞发生凋亡。伍海鹰等[14]发现,BRPS可减轻脂质过氧化,对早中期肝癌荷瘤小鼠具有明显的抑瘤作用。本研究采用不同浓度的BRPS处理肝癌HepG2细胞,结果显示,不同浓度的BRPS均可抑制肝癌细胞的增殖,表明BRPS对肝癌细胞具有增殖抑制作用。为进一步评价BRPS对肝癌细胞凋亡、迁移和侵袭的影响,本研究采用Hoechst33258染色法、流式细胞术、划痕实验和Transwell实验进行验证,结果显示,与对照组比较,BRPS组肝癌细胞凋亡率明显增高,划痕愈合率降低,穿膜细胞数减少,提示BRPS可促进肝癌HepG2细胞凋亡,并降低其迁移和侵袭能力。
缺氧是多种实体瘤的常见情况,肿瘤细胞无限增殖形成瘤块,阻塞周围血管,导致中心瘤区供氧不足,从而促进肿瘤的侵袭和迁移[15]。HIF-1α是一种在缺氧条件下广泛表达的转录因子,在多种肿瘤中呈高表达,对肿瘤的生长、凋亡及转移产生重要影响[16-17]。本研究发现过表达HIF-1α后凋亡细胞较对照组明显减少,划痕愈合率升高,穿膜细胞数增多,提示过表达HIF-1α可促进肝癌细胞的迁移和侵袭。本研究在过表达HIF-1α后使用BRPS干预肝癌细胞,结果显示,细胞凋亡较BRPS组减少,划痕愈合率升高,穿膜细胞数增多,减弱了BRPS对肝癌细胞的抑制作用,提示BRPS抑制肝癌细胞转移、侵袭的能力可能与抑制HIF-1α表达有关。
EMT是上皮肿瘤细胞获得转移和侵袭能力的重要途径,上皮标志物E-钙黏蛋白表达下调或缺失、间质标志物波形蛋白表达上调是肿瘤细胞发生EMT的重要标志[18]。E-钙黏蛋白表达下调可导致肿瘤细胞黏附力下降,易于脱落,波形蛋白表达上调表明肿瘤细胞获得间质表型,运动及迁移能力增强,检测肿瘤细胞中E-钙黏蛋白和波形蛋白的表达,对于了解肿瘤细胞EMT的进展具有重要意义[19]。HIF-1α与EMT密切相关,参与调控相关基因的表达,可促进糖尿病肾小管上皮细胞发生EMT[20]。在前列腺癌细胞中过表达HIF-1α可上调波形蛋白的表达,下调E-钙黏蛋白的表达[21]。本研究Western blotting检测结果显示,HIF-1α组肝癌细胞中HIF-1α、波形蛋白的表达较对照组明显上调,E-钙黏蛋白表达明显下调,BRPS组上述指标呈现相反趋势,而BRPS+HIF-1α可逆转BRPS对EMT的抑制作用,证实了BRPS对HIF-1α的调控作用,提示BRPS可通过下调HIF-1α的表达,阻止EMT的发生,减弱肝癌细胞的迁移和侵袭能力。
综上所述,本研究结果表明,BRPS可降低肝癌HepG2细胞的迁移和侵袭能力,其机制可能与调控HIF-1α表达、阻止EMT发生有关。该结果为临床治疗HCC提供了理论依据。但本研究仍存在一定不足:首先,仅停留在体外细胞实验水平,仍需进一步动物体内实验加以验证;其次,仅从BRPS调控HIF-1α的角度证实了与EMT的关系,是否存在其他相关因子参与EMT过程,尚需更多有针对性的实验加以验证。
