基于有限元仿真的实验用铜电解槽结构改进策略分析
2021-09-24程海雨董恩吉崔家瑞
程海雨,王 超,董恩吉,崔家瑞,李 擎
(1.北京科技大学自动化学院,北京市海淀区学院路30号 100083;2.山东黄金矿业(鑫汇)有限公司,山东省青岛市平度市新河镇大庄子村522号 266715)
铜是一种单质色为紫红色的金属,密度为8.96g/cm3,熔点为1083.4℃,沸点为2325℃。在所有常用金属中,导电性和传热性仅次于银单质。铜在较为干燥的空气环境中不易氧化,但是在潮湿的环境中容易氧化产生碱式碳酸铜(铜绿),在氧化层内的金属铜不易被氧化,换而言之,铜绿对铜的实际使用有一定的抗腐蚀作用。铜单质因在金属活动性顺序表中排列于氢元素之后,属于化学反应中的惰性金属,不易溶解于化学实验中常见的盐酸和稀硫酸,但可溶于氧化作用更强的硝酸和含有其他氧化作用试剂的盐酸溶液中。铜也因其良好的延展性被制作为各种形状的实用材料,比如导线、建筑材料等。
铜单质与其他元素组成的合金广泛应用于日常生活、工程领域,如铜镍合金、铜锌合金、铜铝合金等[1]。在铜的矿质资源中,以黄铜矿、斑铜矿、孔雀石居多。黄铜矿、斑铜矿属于硫化铜矿产,孔雀石属于氧化铜矿产。
由于铜的良好导电性、传热性、延展性、耐腐蚀性等,在电力行业、机械制造业、微电子领域都有广泛用途,在国民生产生活中占据重要地位[1]。因此,从铜矿冶炼出铜单质便是关乎国民生产正常运行的重点研究领域。
在铜精矿中,除去冶炼最需要的铜元素外,还包含:金、银、镍、铅、硫等杂质。铜冶炼的重点就是将铜元素之外的杂质去除。
1 铜矿石冶炼方法
1.1 火法、湿法冶炼以及铜矿精炼
从铜矿石中精炼加工提取铜单质,一般是通过火法冶金、湿法炼铜的方式。两种方法的选择取决于矿石的主要成分、不同地质采集出的矿石中铜的含量、炼铜当地的各类条件(燃料价格、水价、电力资源丰富程度)。湿法炼铜的流程如图1所示。

图1 湿法炼铜流程Fig.1 Hydrometallurgy of copper process
湿法炼铜针对于氧化铜矿、铜矿山中纯度较低的矿石原料有良好的提取效果[2]。通过制备硫酸、氨水以及其他具有还原性的试剂将矿石中的铜元素提取到溶液中,并从溶液中将铜单质不断析出。
火法炼铜一般能析出99.0%~99.8%的铜材料,但对于一些铜含量要求更高的导电材料仍然不能满足需求。因此,火法炼铜中包含的杂质仍需要特殊处理去除,在此工业领域常采用电解精炼的方法。铜的电解精炼,将始极片(纯铜导片)作为阴极,带有杂质的粗制铜片作为阳极导片,插入硫酸铜与硫酸的混合溶液中,将直流电通向阳极阴极导片,构成电解精炼铜结构。在向电解槽通电后,电解液中的铜离子得电子形成铜单质[2]。在电解精炼过程中,铜电解阳极板是一种包含有多种合金的复合材料,阳极板中的各种金属元素在电解过程中会表现出不同的化学、物相变化,这些“杂质”对阳极钝化、电解液净化、阳极泥贵金属回收有一定的影响。
在未通电的电解液中,主要包含以下离子:
(1)
(2)
H2O=2H++O2-
(3)
通电之前,上述离子之间处于动态平衡阶段,将定额的直流电从电极通过溶液过程中时,各种离子在电流作用下做定向运动。阳极上一般发生如下反应:
(4)
(5)
(6)

表1 常见铜矿石的主要成分
水和硫酸根的标准电位代数值较大,没有通电情况下无法放出电子,同时,为了避免电压太大将水以及硫酸根电离,槽电压要有所限制。阴极理想反应如下所示:
Cu2++2e-=Cu
(7)
1.2 铜电解电流密度
电流密度在电解铜中作为一项重要的指标,用于指导实际生产。电流密度是指单位阴极铜板上通过的电流强度。在工业领域电流密度的单位一般为A/m2,目前多数工业电解槽的电流密度为220~270A/m2[3]。提高电流密度,能够有效地提高电解槽的出铜量,减少一线工人的劳动率;在提高电流密度的情况下,可以部分减少电解槽的数量,从而降低成本,提高利润率。与此同时,电流密度的提高仍然受着众多因素影响,比如粗制阳极板的铜含量、阳极板的尺寸、电解液的成分、电解温度等。在控制电流密度时应考虑以下几个因素:
(1)电能消耗与电流密度息息相关。电流密度的增加会使得两极之间电位差增大,随之带来的电解液压降、导体压降都会增加,因此导致的直流电耗会有显著变化。电流密度在这正常范围内时每增加一单位,就会导致槽电压增加1mV左右,进而影响电解平衡。
(2)电流密度对阳极板贵金属损失的关系以及对电解铜纯度的影响。电流密度的提高使得阴极板附近的浓度差逐步极化,为了减少极化现象的发生,需要加快电解液的循环速度,这就增加了阳极贵金属杂质的浑浊程度,从而使得产出的阴极铜片表面粗糙度增加,同时减少了贵金属的产出,电解成本急剧增加。
(3)电流密度对电流效率有较大影响。电流密度提升之后,如若添加剂配比不当。容易使得阴极铜片产生树状结晶、粒子等,这些异常结晶会使得阳极、阴极之间的短路现象显著提升,引起电流效率下降,浪费电能。反之,电流密度太小的时候,电解液中的铜离子无法得到足够的电子,阴极板上放电不完全,形成Cu+,Cu+在溶液中循环到阳极板上又可被氧化为Cu2+,造成电能的浪费,电流效率急剧下降。
综上所述,铜矿精炼时电流密度的大小、致密度一方面取决于电解槽的几何结构,另一方面受电解质成分、阳极阴极板材料影响。针对这一现象,为了获得均匀度更高的阴极铜层,本文通过有限元仿真的方式探究了电解槽结构的优化策略。
2 基于COMSOL的铜电解槽仿真
本仿真基于COMSOL Multiphysics 5.6平台,模型参考盐湖大学J.M.Werner教授于2018年提出的铜电解简化模型[4]。此模型基于盐湖大学实验用铜电解槽,材料属性按照实际电解槽所得,具体尺寸图2所示。
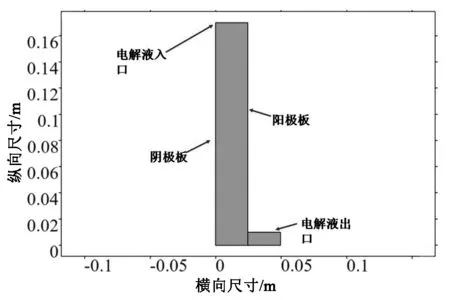
图2 实验用铜电解槽等效模型尺寸及组成Fig.2 The size and composition of the equivalent model of the copper electrolytic cell used in the experiment
在COMSOL软件中利用三次电流分布组件,打开能斯特-普朗克物理界面[5],输入公式,求解电解液中多种离子(铜、铜离子、氢、氢离子和硫酸根、硫酸氢根)对流、扩散和迁移的电子能量:
(8)
式中,εl为电解质体积分数,是由泡状流中求解的液相分数决定;ci为离子在电解质中的浓度,单位是mol/m3;t为时间,单位是s;为梯度算子,计算各个离子能量传递矢量的梯度;Ni为能量传递矢量,单位是mol/(m2·s);u是带电离子的速度矢量,单位是m/s。电解质中的每个离子能量由能斯特-普朗克方程解出[6]:
Ni=-Di,effci=ziui,effFciφl
(9)
式中,Di,eff为扩散系数,单位是m2/s;zi为不同离子在电解液中的能量系数;ui,eff为带电粒子的能量迁移率,单位是m2/(s·j·mol);F为法拉第常数,单位是C/mol;φl为电解液中的电势差,单位是V。扩散系数以及电中性条件如下所示:
(10)

(11)
仿真模型考虑了铜离子的还原、氧气析出两种主要反应。局部电流密度由粒子交换电流密度io,m、还原物(铜)种类CR,m、氧化物种类CO,m、阳极、阴极转移系数αa,m、αc,m,不同离子的超电势ηm计算得到:
(12)
4 仿真分析
通过设置初始沉淀时间为60s,不考虑气泡流对电流密度影响,按照实验用电解槽给出的初始参数设定阳极电流为5.14A,实验温度为313K,Cu2+浓度为700mol/m3。
经过仿真,首先得出在电解时间为60s时的瞬态电解质电位如图3(a)所示[7]。电解质电位差由阳极板到阴极板之间符合递减的趋势,说明电解质中的正电位离子的电子获得趋势是正确可靠的。电解质阴极板侧的电解质电位也保持在-0.32V左右,与Cu2+得电子的电位基本保持一致,可完成铜层的附着。
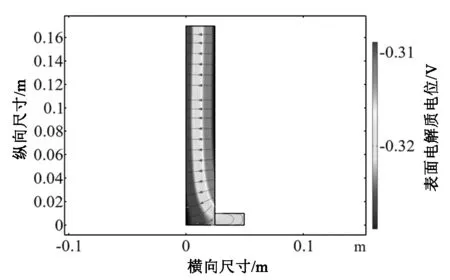
(a)电解质表面电流密度矢量图(a)A vector of current density on the electrolyte surface

(b)电解质电流密度矢量图(b)Electrolyte current density vector simulation diagram图3 原始电解槽瞬态电场示意图Fig.3 A diagram of the original electrolytic tank transient electric field
由图3(b)可以看出,电流密度矢量从阳极板流经电解质流向阴极板,从阳极上部的直线传递到阳极下部的曲线传递均符合实际电解过程中阳极板向阴极板流向的认知,证明仿真实验真实可靠。同时发现电流密度的大小由阳极板到阴极板递减,在不考虑氧气气泡对电流矢量方向的影响的情况下,符合实际电解过程。但可看出电流密度因电解槽下部结构设计的原因,呈弯曲状流向,与上部的电流密度的大小有4-5个单位的差距,有可改进的空间。
因初始电解质电位(2.42V)大于氧元素在电解质中的电化学位,氧元素失去电子生成氧气气泡,促进电解质的流动循环,在考虑电解产生的氧气气泡对电解质流速和浓度的影响后。设定电解时间为60s,待稳定后得到瞬态Cu2+的扩散通量如图4所示。

(a)瞬态电解质Cu2+浓度示意图(a)A diagram of the concentration of the transient electrolyte
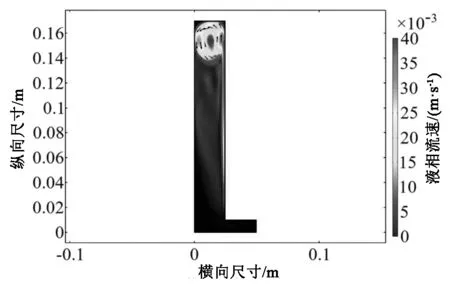
(b)瞬态电解槽液相流速示意图(b)A quick map of the phase flow of transient electrolytic tank fluid图4 原始电解槽浓度及液相示意图
从上图中观察发现,靠近阴极板下部因电解槽结构、氧气流动产生了一个Cu2+低浓度场,与电解槽上部的离子浓度差距为4-5个单位。
由图4(b)可发现氧气气泡流在电解槽顶部汇聚,形成气泡涡流,在涡流中心Cu2+浓度大于其他部分,电解质在阳极板内侧由下至上流动,阴极板侧由上至下流动,Cu2+在阴极板上失去电子形成Cu单质层。
经仿真可得阴极板的厚度变化如下图5所示。
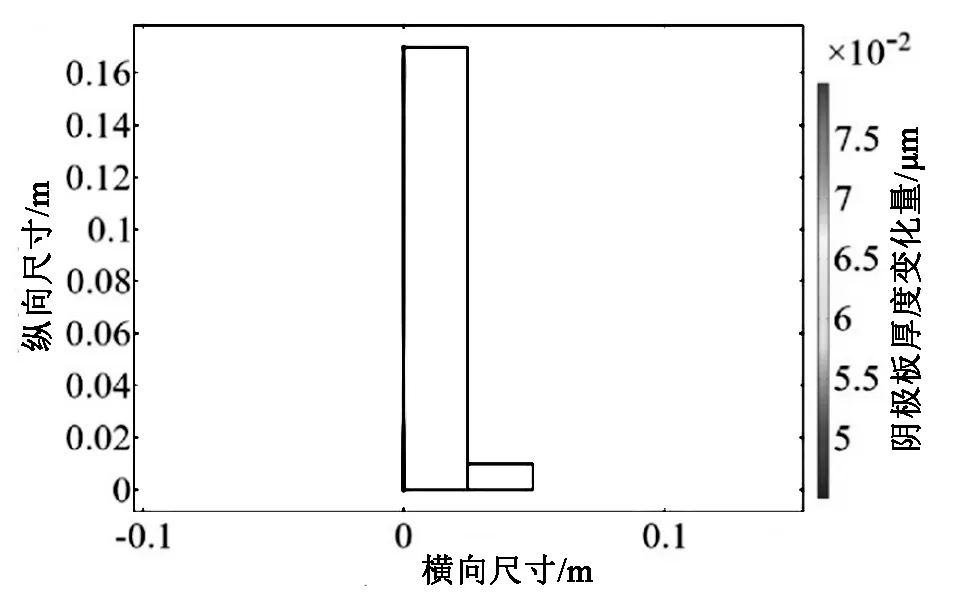
图5 阴极板厚度变化示意图Fig.5 Schematic diagram of the thickness of the cathode plate
再经过240s的仿真后,由图5可以看出,随着电解槽高度增加[8],Cu单质在阴极上的附着厚度也逐步增加,阴极板上部红色部分增长厚度为5×10-2μm,而阴极板下部蓝色部分增长厚度为5×10-2μm,两者差距较大。这样会导致出产的铜层分布不均匀,在电解时间较长时,会使得上层入口处的Cu层厚度不断增加产生“铜钉”以至于堵塞出气口。
为了解决铜层在阴极板铜层增加分布不均的问题,现观察到图3(b)中靠近阴极板下部的电解质电流密度不致密的现象,以及图4(a)中Cu2+浓度在电解槽靠阴极板下部较低的现象。针对以上情况可对电解槽模型结构进行改进。从仿真中观察到电流密度由电解槽上部至下部的递减性,为了保证电流能较为均匀地分布于电解质中,且考虑到让氧气气泡充分加速液相的流动,从流体力学角度出发[9],同时考虑到实际工业电解槽的角部弯曲程度,在仿真中将阴极下部和底部电解槽各缩短1cm,由直角形改为斜切形,如图6所示。
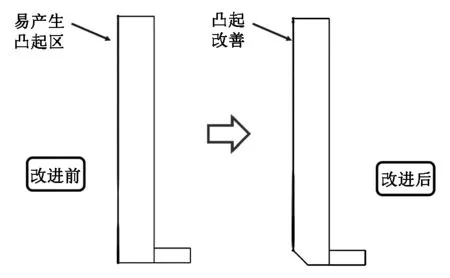
图6 改进电解槽阴极厚度变化示意图Fig.6 Schematic diagram of the thickness change of the cathode in the improved electrolytic cell
由图6可看出改进后阴极板的厚度增加较为均匀,均保持在6×10-2μm左右,但是在相同电解时间下,增加速度有所降低,是因为阴极板下部电解质的等效电阻有所增加,降低了电解速率[10]。
改进后电解槽的电解质流速图如图7所示。

(a)改进的电解槽瞬态液相流速图(a)Figure of improved electrolytic tank transient liquid phase flow
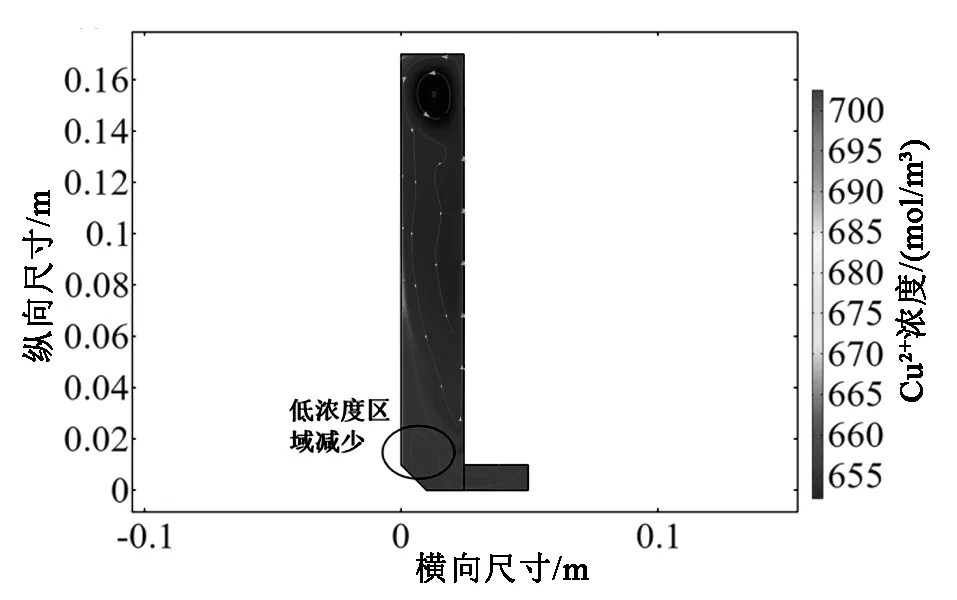
(b)改进的电解槽瞬态Cu2+ 浓度分布图(b)Improved transient Cu2+ concentration distribution in electrolytic cell

(c)改进后电解质电流密度示意图(c)Improved electrolyte current density diagram图7 改进后电解槽浓度、液相、电场示意图Fig.7 Diagram of cell concentration, liquid phase and electric field after improvement
由图7(a)可以看出,由于发生涡流的顶部结构具有相似的尺寸,因此电解槽几何形状的改变几乎不会影响单元顶部的涡流流速。图7(b)中可观察到改进后的阴极板下部的浓度场提高了2-3个单位。有所改善。图7(c)中的电解槽下部电流密度相较改进前致密度上升,弯曲部分明显减少。因此,改进后的电解槽可以很好的解决“铜钉”问题。
通过以上仿真可发现,改进后的电解槽结构在阳极板相同参数,面积大小不改变的基础上,为了消除电解质底部电流密度不致密的现象,缩减了一部分阴极板与底部的长度。经改进后,电解质电流密度致密性增加,阴极Cu层增加厚度较为均匀,减少了因局部厚度增加导致的“起钉”风险,对实际电解槽结构改善有指导作用。
5 总结
对实验用电解槽在其提供的实验环境参数下进行了模拟仿真,并提出了槽结构改进策略,避免了“铜钉”现象。但在仿真模型中只考虑到了单一层面(2D)气泡流对电解质的影响,有一定的局限性。下一步将开展3D模型研究,并与实际工业用铜电解槽对比,同时可加入重金属沉积物对电解质及电流密度的影响,提出更好的电解槽结构改进策略。
