37例复合型小细胞肺癌临床分析
2021-09-24许毅娇肖雄
许毅娇 肖雄
小细胞肺癌(small-celllung cancer, SCLC)是一种高度恶性神经内分泌肿瘤,其复发和转移率高,约占肺癌的15%~20%。[1]根据2004年世界卫生组织(WHO)对肺肿瘤的分类,SCLC可分为纯SCLC(pure small-cell lung carcinoma, P-SCLC)和复合型SCLC(combined small-cell lung carcinoma,C-SCLC)。[2]2015年WHO将C-SCLC定义为小细胞肺癌与其他成分相结合,该成分由任何组织学类型的非小细胞肺癌(non-small-cell lung cancer,NSCLC)组成,包括腺癌(adenocarcinoma,ADC),鳞状细胞癌(squamous cell carcinoma,SCC),大细胞癌(large-cell carcinoma,LCC),大细胞神经内分泌癌(large-cell neuroendocrine carcinoma, LCNEC),以及不常见的梭形细胞癌或巨细胞癌。[3]C-SCLC相对少见,仅占所有小细胞肺癌的1%~3%。[4]目前关于SCLC的研究非常丰富,但是只有少数研究集中在C-SCLC。本研究旨在回顾性分析C-SCLC的临床特征,探讨该疾病的治疗方法和生存分析。
资料与方法
一、一般资料
回顾性分析2016年2月至2018年12月在复旦大学附属中山医院呼吸科诊治的37例C-SCLC患者。所有患者均经组织学病理明确诊断。C-SCLC分期参考AJCC肺癌分期(第八版)[5]及美国退伍军人分期法(VALSG)。收集患者的病历,包括性别,年龄,基础体能状态评分,病理诊断,治疗方法和治疗后疗效。通过查阅住院或门诊复查病史资料、或电话通讯对所有患者进行随访。剔除资料不完整或未治疗患者。
按照实体瘤疗效评价标准 (RECIST)1.1[6]评估疾病进展(progressive disease,PD)。化疗患者无进展生存期 (progression-free survival,PFS)为首次化疗至PD或与肿瘤相关死亡。手术患者PFS定义为从手术到疾病复发或末次随访时间间隔。随访截至2019年4月30日。
二、统计学分析
计量资料为非正态分布采用中位数及四分位数间距描述,计数资料以例数及百分比描述,计数资料之间的比较采用卡方检验。利用单因素COX分析计算HR值及95%置信区间,采用COX多因素分析评估影响PFS的预后因素。Kaplan-Meier方法用于估计生存率。P<0.05有统计学意义。使用SPSS 26.0进行统计分析。
结 果
一、患者特征
共收集到37例复合型小细胞肺癌符合研究标准。C-SCLC患者中男性32例(86.5%),女性5例(13.5%)。中位年龄58(36~77)岁。所有患者体能状态评分PS均≥2分(见表1)。
二、诊断与治疗
获得的病理诊断标本类型中,仅有2例为手术后组织,其余均通过肺或转移灶穿刺活检获得。确诊时I~II 期患者3例(8.1%),均接受根治性肺叶切除,术后行2周期依托泊苷+铂类(EP/EC)辅助化疗。III期患者11例(29.7%),IV期患者23例(62.2%),4例III~IV期患者仅行2周期化疗,其余30例患者均接受至少4周期化疗。14例患者(37.8%)为局限期,23例(62.2%)为广泛期。SCLC合并鳞癌患者22例,1例予吉西他滨+铂类(GP)治疗,1例予伊立替康+铂类(IP)治疗,另20例接受EP/EC治疗。合并非鳞癌患者15例,其中合并腺癌(ADC)患者8例,1例予培美曲塞+铂类(AP)治疗,1例EGFR阳性患者,予EP+厄洛替尼治疗;合并大细胞癌(LCC)者7例,均接受EP/EC方案化疗(表1)。

表1 37例患者临床特征[n(%)]
三、生存分析
37例患者中,截止2019年4月,23例(62.7%)出现进展,7例(18.9%)病情稳定或维持缓解,7例患者失访。中位PFS为9(6.1~11.9)月。
SCLC/SCC和SCLC/non-SCC的中位PFS分别为8.5(95%CI:4.7~12.3)月和10(95%CI:5.3~14.7)月,比较SCLC/SCC和SCLC/non-SCC的PFS,2组间在PFS上的差异无统计学意义(P=0.695)。
单因素Cox分析显示,肿瘤VALSG分期、性别在PFS上的差异有统计学意义(P=0.048和P=0.038)。进一步行COX多因素生存分析显示,性别、C-SCLC病理类型是影响患者PFS的独立预后因素(P=0.021和P=0.037)。另外,确诊时肿瘤尚在局限期可能是其良好的独立预后因素(P=0.052)(见表2、3)
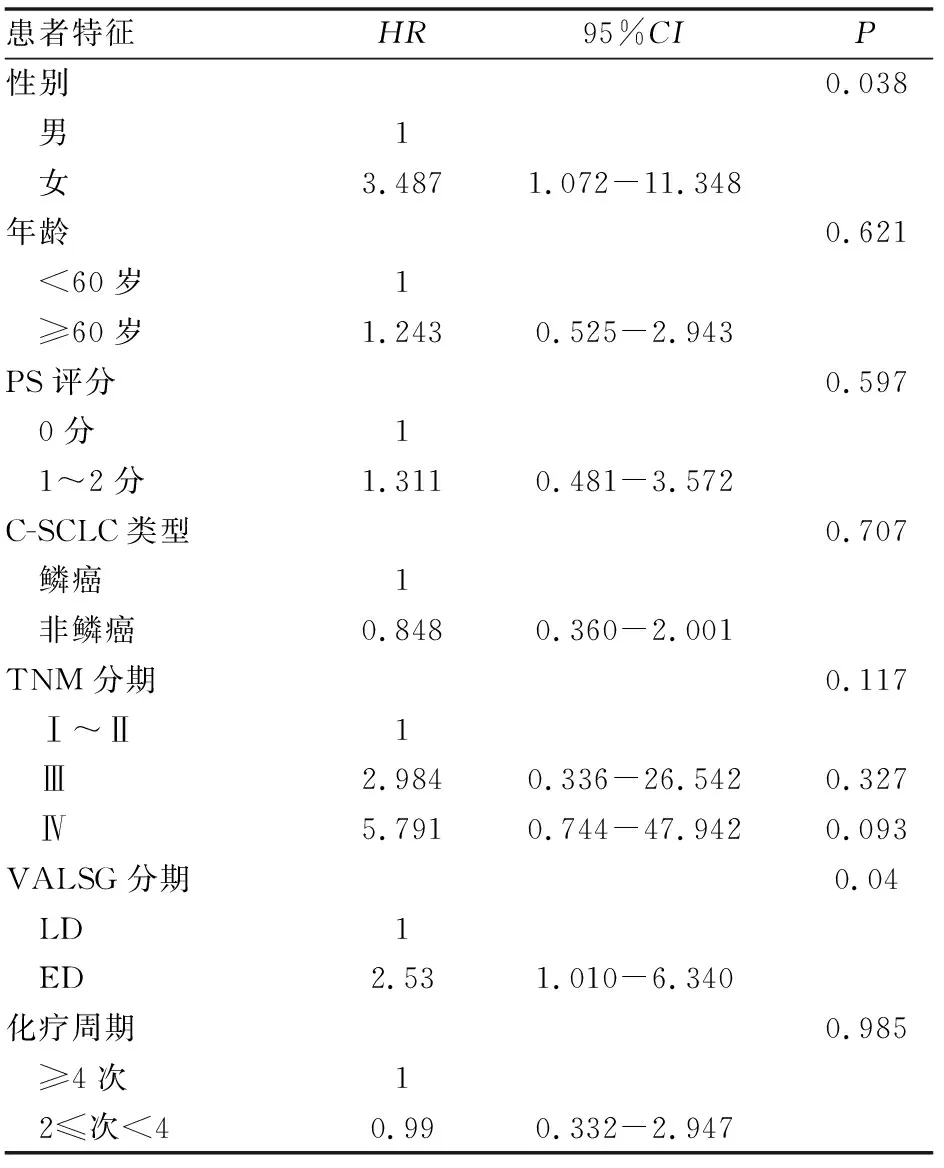
表2 患者PFS与临床特征关联性的单因素分析结果

表3 患者PFS与临床特征关联性的多因素分析结果
讨 论
由于C-SCLC的稀有性和诊断难度,我们对其了解不多。近年来对C-SCLC的研究一直在逐渐增加。目前获得用于诊断C-SCLC的病理样品的主要临床方法是肺或转移性病变活检和手术病理学。由于支气管镜和穿刺针采集的小样本的局限性以及该疾病的低发病率,很容易造成误诊。据报道,C-SCLC的术后病理诊断率为12%-28%,而在细胞学或组织活检标本中只有8.6%[7]。本研究中仅有2例为术后病理明确为C-SCLC,其余均通过肺或转移灶穿刺活检获得,实际在筛查C-SCLC时,可能SCLC人群中有部分因组织标本的局限性而未得到正确的认识。
Kong等[8]和李龙等[9]研究显示,C-SCLC的病理结果中,非小细胞肺癌的成分主要为鳞癌和腺癌。与本研究中的结果类似,为鳞癌、腺癌占较大比例。而韩轲等[10]及Lei等[11]研究则显示,SCLC+LCNEC所占比例更大。
C-SCLC尚无明确及统一的治疗方案,目前对于C-SCLC 的治疗主要是以基于SCLC治疗基础上的综合模式为主。对于T1-2N0的SCLC患者,肺叶切除加肺门和纵隔淋巴结的全身淋巴结清扫术是首选。术后必须使用依托泊苷+铂类(EP或EC)作为辅助化疗。对于局部晚期患者,基本治疗策略是化学疗法联合(顺序或同步)放疗。主要的化疗方案是EP或EC。对于晚期患者,主要治疗策略也可以是伊立替康联合顺铂/卡铂(IP/IC)化疗。然而,C-SCLC对化疗的有效率低于P-SCLC[11-12]。一些研究试图将标准EP方案与C-SCLC患者的其他NSCLC方案(NIP:长春瑞滨+异环磷酰胺+顺铂,TPE:紫杉醇+顺铂/卡铂+依托泊苷)进行比较,但在客观缓解率或疾病控制率上的差异无统计学意义。本研究中局部晚期或晚期患者至少行4周期EP或EC方案治疗。而3例I~II期患者行手术治疗,术后行至少2周期辅助化疗。C-SCLC的靶向治疗或免疫治疗尚未有明确的疗效或相关研究。
目前尚缺乏关于C-SCLC预后的大样本研究和多中心前瞻性队列研究。现有病例资料表明, NSCLC成分能在一定程度上影响C-SCLC患者预后[13]。一项回顾性研究分析了SCLC / LCNEC(N=17)和SCLC/non-LCNEC(N=8)中的OS,发现SCLC / LCNEC中的中位OS为73.6个月,SCLC / non~LCNEC中位OS为31.5个月,但该差异没有达到统计学显着性[1]。Lei等[11]的研究显示SCLC / LCNEC患者获得更长的PFS(44.1vs20.4月,HR=0.661,P=0.040)。在一项研究中显示58 例C-SCLC患者中,Ⅰ、Ⅱ、Ⅲ、Ⅳ期的5年OS 率分别为100.0%、61.4%、38.5%和12.5%,全组中位OS为22.7 个月,复合鳞癌患者预后相对较好,而大细胞成分混合C-SCLC患者预后最差[14]。在本研究中,SCLC/SCC患者的中位PFS为8.5个月,SCLC/non-SCC中的中位PFS为10个月,但两者在PFS上的差异无统计学意义。
一项回顾性研究显示[11]胸膜浸润,淋巴转移,辅助化疗周期是PFS或OS的预后因素。另外一项研究[15]多因素分析发现吸烟、较晚的TNM分期、手术切缘阳性和转移性淋巴结>4个,是预后不良因素,与P-SCLC相比预后明显不佳。在本研究中,多因素分析显示男性、复合类型为非鳞癌的C-SCLC患者可能获得更好的PFS。另外,确诊时肿瘤尚在局限期可能是其良好的独立预后因素(P=0.052)。TNM分期在本研究中未体现出明显差异,可能系由于I~II期样本量过少所致。
本研究有几个局限性。首先,这是一项回顾性分析和单中心分析,例数少,失访率高。其次,许多患者没有进行全面的基因检测,无法获得更多的驱动基因和突变信息。之后对于C-SCLC多中心研究或随着诊断手段的更新,C-SCLC的治疗及诊断难点可能会得到更好的解决。
结 论
本研究表明,SCLC / SCC是最常见的C-SCLC类型,并且这种类型的患者的PFS比其他组合短。目前一线EP/EC方案化疗或术后EP/EC辅助化疗仍是C-SCLC的主要治疗方法。性别、病理类型是C-SCLC的独立预后因素。
