miR-200通过靶向PD-L1抑制非小细胞肺癌A549细胞增殖、迁移和侵袭的研究
2021-09-24艾孜子阿不来提艾力江多力坤陈康
艾孜子·阿不来提 艾力江·多力坤 陈康
非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌的常见病理类型,多数患者发现时已经达晚期[1]。肿瘤细胞的迁移、侵袭在肿瘤的复发转移过程中发挥重要的作用。因此,寻找到抑制NSCLC迁移、侵袭的靶点对于提高患者的预后尤为重要。microRNAs(miRs)是长度22nt 的内源性非编码RNA,与靶基因相互作用后调控转录及转录后基因表达。有报道称,miR-200作为抑癌基因,可抑制多种恶性肿瘤细胞的增殖、侵袭,促进凋亡[2-4]。戚永超等研究发现[5],肺癌患者血清中miR-200水平低表达,与淋巴结转移有关。但miR-200与NSCLC细胞的恶性生物学行为的关系尚不清楚。程序性死亡受体配体-1(Programmed death-ligand 1,PD-L1)属于负性协同刺激分子,在免疫应答中起到负性调控作用[6]。研究发现,乳腺癌组织中肿瘤浸润淋巴细胞PD-L1高表达患者预后良好,复发率低[7]。PD-L1还可以协助肿瘤逃避监视,促进肿瘤细胞的增殖、侵袭、转移等[8]。张宇轩等研究发现,PD-L1下调后可促进非小细胞肺癌细胞的恶性生物学行为[9]。团队前期通过在线网站分析发现,miR-200与PD-L1存在一定的互补碱基对,但两者是否存在靶向关系尚不清楚。基于上述研究,本研究将miR-200 转染到NSCLC细胞A549,探讨miR-200对肿瘤细胞增殖、侵袭及迁移的影响及机制,以期为NSCLC的治疗提供靶点。
资料与方法
一、实验材料
肺癌细胞株A549,正常肺成纤维细胞HLF-1(上海生命科学研究所);杜氏改良伊格尔培养基( Dulbecco′smodified Eagle medium,DMEM)培养液、双抗、胰蛋白酶(Biosciences,美国);miR-NC、miR-200-mimic、si-NC、si-PD-L1、pEGFP、pEGFP-PD-L1、anti-miR-200、anti-miR-NC、MUT-PD-L1和 WT- PD-L1(上海生工生物有限公司);LipofectAMINE 2000脂质体转染试剂盒(BioVision公司,美国);兔抗人PD-L1、β-actin多克隆一抗、鼠抗兔单克隆二抗(Sigma公司,美国);Transwell小室(上海钰森生物有限公司);MTT检测试剂盒、RNA提取试剂盒(武汉博士德生物公司);PCR试剂盒(Sigma公司,美国);蛋白印记试剂盒(Kapa Biosystems,美国);酶标仪(上海仪电分析仪器有限公司);ABI 7900PCR扩增仪(上海仪电分析仪器有限公司)。
二、实验方法
1 细胞培养、转染及分组 用DMEM培养基培养A549,HLF-1细胞,培养基中加入含 10% FBS 和青、链霉素各 100U/L,培养条件:37 ℃,5% CO2,湿度饱和。定期更换培养基、传代。A549细胞转染:使用Lipofeetamine 2000试剂将miR-NC、miR-200-mimic、si-NC、si-PD-L1转染至细胞内,继续培养48h进行后续实验。为验证 miR-200通过下调PD-L1调控A549细胞的增殖、迁移和侵袭,将miR-200-mimic、pEGFP-PD-L1同时转入A549细胞,进而观察细胞生物学行为的改变。具体分组如下:NC组(未进行任何处理的A549细胞)、miR-NC组(转染miR-NC)、miR-200组(转染miR-200-mimic)、si-NC 组(转染si-NC)、si-PD-L1组(转染si-PD-L1)、miR-200+pEGFP组(转染miR-200-mimic+pEGFP)及miR-200+pEGFP-PD-L1组(转染miR-200-mimic+pEGFP-PD-L1)。
2 实时荧光定量PCR(Quantitative Real-time PCR)检测细胞miR-200、PD-L1 mRNA表达 使用Trizol试剂提取细胞总RNA,测定RNA浓度,将合格的总RNA转录成cDNA,然后进行PCR扩增。合成目标引物序列(北京华大基因公司)(见表1),配置反应体系:SYBR® Premix Ex TaqTM(2×)12.5μL+上下游引物10μM各1μL,加反应水至总体积为25μL。反应参数设置为92 ℃ 20 s、96 ℃ 2 s、85 ℃ 20 s、80 ℃ 6 s,共40个循环,75 ℃读取荧光,构建溶解曲线。2-ΔΔCt法计算目标引物mRNA的相对表达量。
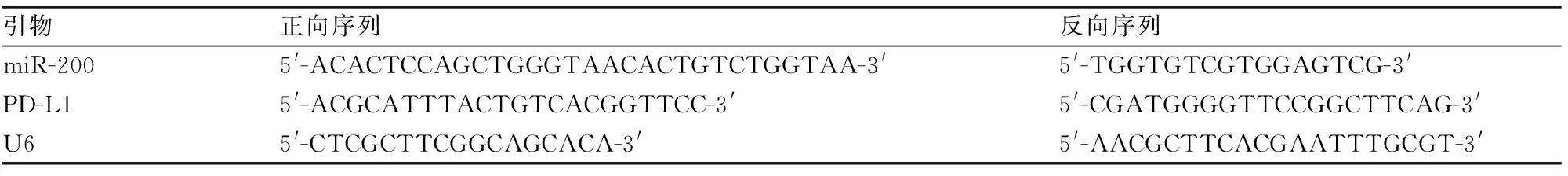
表1 目标引物序列和大小
3 荧光素酶实验验证miR-200与PD-L1的靶向关系 按照试剂盒步骤将PD-L1野生型或突变型的荧光素酶报告基因质粒载体与miR-NC、miR-200-mimic共同转入细胞,培养48 h后去除培养液。PBS洗涤3遍,加入细胞裂解液。4 ℃振荡10 min,40 ℃ 1 000 r/min离心3 min,取上清进行发光测定。
4 MTT法检测细胞增殖能力 分别消化、收集各组细胞,调整浓度为5×106/L的单细胞悬液,接种于96孔板中,每组设置5个复孔,置于培养箱中0, 48, 72及 96 h,终止前每孔加入20 mL MTT,继续培养4 h,上机前吸弃培养液,每孔加入150 mL DMSO,水平摇床摇动30min,在酶标仪(490 nm波长)上测量吸光度 OD值,并绘制细胞活力曲线。
5 Transwell小室实验,检测细胞迁移、侵袭能力 采用无Matrigel基质胶和有Matrigel基质胶的Transwell小室分别进行细胞迁移和侵袭实验。迁移实验:上室每孔加入200 μl无血清细胞悬浮液,密度为6×104个/孔,下室加入600 μl含20%血清培养液,培养48 h,4%多聚甲醛固定10 min,0.5 %结晶紫染色10 min。洗涤,光学显微镜下选取5个视野计算细胞数量。侵袭实验:使用4 ℃的无血清DMEM 1 ∶6稀释基质胶,每个transwell小室中加40 μL Matrigel基质胶,37 ℃放置30 min。取出小室吸取多余的液体,其余步骤同迁移实验。
6 Western blot法检测细胞PD-L1蛋白的表达 加2mL RIPA组织裂解液,匀浆,冰浴30 min,40 ℃ 500×g离心5 min,吸去上层液体,超声波破核,再次离心,取上层液体10 μl待测。配胶,上样,电泳,转膜,切膜,封闭液封闭1 h,逐次大鼠抗人PD-L1(1 ∶100)、β-actin单克隆抗体(1 ∶100)、辣根过氧化物酶标记的二抗(1 ∶100,武汉博士德生物有限公司)。Bio-Rad成像仪曝光成像,Image Lab Software测定光密度,结果以PD-L1与β-actin条带光密度值比值表示相对表达量。
三、统计分析
结 果
一、A549,HLF-1细胞miR-200、PD-L1的表达
与正常肺成纤维细胞HLF-1相比,人肺癌A549细胞miR-200表达水平降低,PD-L1基因、蛋白表达升高(P<0.05)(见图1)。

图1 细胞miR-200、PD-L1的表达水平与HLF-1比较,*P<0.05
二、A549细胞miR-200与PD-L1的靶向关系
通过生物学信息软件分析发现,miR-200与WT- 3′UTR-PD-L1存在一定数量的互补碱基对。荧光素酶实验表明,转染miR-200-mimic+WT-PD-L1的A549细胞荧光素酶活性低于转染miR-NC+WT-PD-L1组(P<0.05);与miR-NC+MUT-PD-L1组相比,转染miR-200-mimic+MUT-PD-L1的A549细胞荧光素酶活性下降不明显。miR-200组细胞PD-L1蛋白表达水平明显低于miR-NC组(P<0.05);anti-miR-200组细胞PD-L1蛋白的表达水平明显高于anti-miR-NC组(P<0.05)(见图2)。
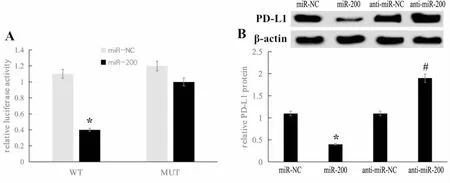
图2 miR-200与PD-L1的靶向关系与miR-NC组比较,*P<0.05; 与anti-miR-NC组,#P<0.05
三、过表达miR-200对A549细胞增殖、迁移和侵袭的影响
miR-200组细胞miR-200水平显著高于NC组、miR-NC组(P<0. 05)。48 和 72 h 时,miR-200组细胞活力明显低于NC组、miR-NC组(P<0. 05)。miR-200组细胞迁移和侵袭数量明显低于NC组、miR-NC组(P<0.05)(见图3、4)。

图3 过表达miR-200对细胞增殖的影响与miR-200组比较,*P<0.05

图4 过表达miR-200对细胞迁移和侵袭的影响(20×)与miR-200组比较,*P<0.05
四、抑制PD-L1表达对细胞增殖、迁移和侵袭的影响
si-PD-L1组细胞PD-L1 mRNA、蛋白水平显著低于NC组、si-NC 组(P<0.05)。48 和 72 h 时,si-PD-L1组细胞活力明显低于NC组、si-NC组(P<0.05)。si-PD-L1组细胞迁移和侵袭数量明显低于NC组、si-NC组(P<0.05)(见图5)。

图5 抑制PD-L1表达对细胞增殖、迁移和侵袭的影响A、B 各组PD-L1蛋白水平;C 增殖能力检测;D 迁移能力检测;E 侵袭能力检测; 与si-PD-L1组比较,*P<0.05
五、过表达PD-L1可逆转过表达miR-200对A549细胞增殖、迁移和侵袭的抑制作用
miR-200+ pcDNA-PD-L1组细胞PD-L1蛋白、mRNA均高于miR-200+pcDNA组、miR-200组(P<0.05)。miR-200+ pcDNA-PD-L1组细胞48、72 h时细胞活力、细胞迁移和侵袭数量高于miR-200+pcDNA组、miR-200组,差异具有统计学意义(P<0.05)(见图6)。
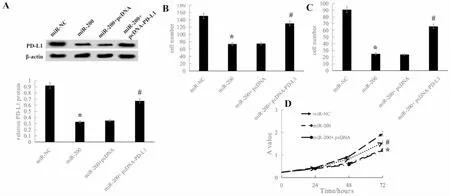
图6 过表达PD-L1可逆转过表达miR-200对A549细胞增殖、迁移和侵袭的抑制作用A:各组PD-L1蛋白水平;B:迁移能力检测;C:侵袭能力检测;D:增殖能力检测. 与miR-NC组比较,*P<0.05;与miR-200+pcDNA组比较,#P<0.05
讨 论
肺癌近年来发病率逐渐增加,且呈年轻化趋势。肿瘤细胞的侵袭、转移在肺癌预后不良及复发中发挥重要的作用。因此,如何抑制肿瘤细胞的侵袭、迁移及转移成为目前研究的热点。
miRNA属于高度保守的一种非编码RNA,正常状态下,miRNA的表达、降解过程遵循一定的规律,miRNA的异常表达可导致人类多种疾病的发生。miR-200作为最近发现的一种miRNA,广泛参与了多种肿瘤细胞的恶性生物学行为,如王培云等研究发现,miR-200b、miR-200c可靶向调节肝细胞生长因子(HGF)抑制结直肠癌细胞的增殖[10]。李娟等研究结果显示,miR-200b可上调调控PDCD4,从而抑制乳腺癌细胞的恶性生物学行为能力[11]。为明确 miR- 200对NSCLC细胞增殖、侵袭及迁移能力的影响,在本实验中,首先观察了肺癌细胞株及人胚肺成纤维细胞中miR-200表达情况,结果显示miR-200在肺癌细胞中低表达。随后将miR-200-mimic转染至A549细胞株,检测了细胞增殖、侵袭及迁移能力,结果显示,过表达miR-200细胞的增殖、侵袭及迁移能力明显减弱,提示miR-200具有抑制NSCLC细胞恶性生物学行为的功能,这与其他肿瘤的相关研究基本一致。肿瘤细胞的迁移、侵袭是肿瘤细胞远处转移的基础,肺癌作为一种恶性肿瘤,容易出现远处的转移,本次研究结果提示miR-200可能作为一种潜在的肺癌治疗靶点。
PD-L1可介导多种肿瘤微环境的免疫抑制作用,在多种恶性肿瘤中高表达,而人体正常细胞几乎不表达[12-13]。大量研究表明,PD-L1与前列腺癌、非小细胞肺癌、多发性骨髓瘤的预后、耐药、复发等有关[14-16]。PD-L1活性的失活是抑制肿瘤发生免疫逃避的重要途径。然而, miR-200和 PD-L1的靶向关系及其对肺癌细胞的增殖、迁移和侵袭的影响目前尚不清楚。因此本研究开展了以下实验探讨上述问题。本实验首先观察了不同细胞株PD-L1的表达情况,结果显示A549细胞PD-L1基因、蛋白表达明显升高。进一步研究发现,抑制PD-L1表达后细胞的增殖、迁移和侵袭能力减弱。PD-L1与其受体免疫细胞表面程序性细胞死亡受体-1(programmed cell death-1, PD-1)结合后可抑制细胞的免疫功能,“帮助”细胞逃脱免疫监视,促进肿瘤的恶性生物学行为。本次研究结果证实了上述理论的正确性,同时提示针对PD-L1的抑制剂有望成为肺癌治疗的靶向药物。随后,荧光素酶实验及PD-L1蛋白测定结果显示,miR-200与PD-L1存在负性靶向调控的关系。最后团队进行了功能回复实验,结果表明,过表达PD-L1可逆转miR-200对肿瘤细胞的增殖、迁移和侵袭的抑制功能,这更进一步证实miR-200可靶向调控PD-L1。但miR-200如何调控PD-L1的表达,具体通道尚需深入的探讨。
综上所述,过表达miR-200可抑制A549细胞增殖、迁移和侵袭能力,这一过程与负性靶向调控PD-L1有关。但本次研究存在一定的局限性,如未对相关的相关信号通路进行研究,这也是下一步研究的重点。
