JNK/MAPK通路在结核杆菌感染的巨噬细胞凋亡、自噬中的作用机制研究
2021-09-24孙万里郭玉琪王月李养军杨振华张卫东曹杨任云霞
孙万里 郭玉琪 王月 李养军 杨振华 张卫东 曹杨 任云霞
结核病(Tuberculosis,TB)是由致病菌结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染所引起的呼吸道系统慢性传染疾病,MTB是一种兼性细胞内寄生菌,机体感染MTB时,诱导巨噬细胞自噬与凋亡,自噬是巨噬细胞清除病原体的一种防御机制[1-3]。因此,深入研究BCG感染引起巨噬细胞凋亡、自噬的作用机制,有助于提高巨噬细胞对药物的敏感性,为结核病治疗靶标的研究提供依据。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一类由脯氨酸介导的丝氨酸/苏氨酸活性的蛋白激酶,是介导信号从细胞表面传递到细胞内的重要转导通路之一,在细胞增殖、分化、迁移、凋亡等生理过程中发挥作用,c-JunN 末端激酶(c-Jun N-terminal kinase,JNK)为MAPK通路蛋白之一,目前有多项研究表明 MAPK 信号家族在细胞或动物试验的自噬各阶段发挥重要作用[4-5]。郭伟伟等[6]构建新生大鼠缺血再灌注(I/R)模型,过表达miRNA-138后发现,p-p38/p38、p-c-jun/c-jun 及 p-JNK1/2/JNK1/2显著下调,表明miRNA-138可通过抑制JNK/p38 MAPK通路,抑制大鼠心肌细胞的凋亡,并减轻活性氧损伤,从而保护新生大鼠心肌细胞。赖华毅等[7]研究表明, 鼠伤寒沙门氏菌spvB基因对肠上皮细胞自噬的抑制作用,可能与其对细胞p38MAPK通路的负调控相关。但JNK/MAPK通路对结核杆菌感染的巨噬细胞凋亡、自噬的作用报道较少,因此,本研究通过构建卡介苗菌株(Bacillus calmette guerin,BCG) 感染的巨噬细胞模型,探索JNK/MAPK通路在BCG 感染的巨噬细胞中的作用机制,以期为临床结核病的防治提供理论依据。
资料与方法
一、实验材料
小鼠巨噬细胞 RAW264.7由中科院上海细胞库提供;BCG菌株由上海生物制品研究所提供;JNK抑制剂SP600125 购自Sigma公司;FBS胎牛血清、DMSO、青霉素、链霉素购自美国Invitrogen公司;0.25%EDTA胰酶、RPMI-1640培养液购自美国Gibco公司;Middlebrook 7H10培养基购自美国BD公司;噻唑蓝(MTT)试剂盒;BCA试剂盒、ECL试剂盒购自上海碧云天生物技术有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自北京Solarbio公司;兔抗鼠p38MAPK、JNK、ERK1/2、p-p38MAPK、p-JNK、p-ERK1/2、LC3、Beclin-1、P62单克隆抗体购自美国CST公司,β-actin、HRP 标记羊抗兔 IgG 抗体购自北京中杉金桥公司。
二、实验方法
1 细胞培养与建立细胞感染模型
BCG接种在Middlebrook 7H10固体培养基上培养,调整菌体浓度,RAW264.7细胞调整至相同密度,将对数生长期的细胞按4×106个/mL接种至六孔板中,待各组细胞贴壁且生长状态良好,按照细胞:BCG菌个数=1 ∶10的比例,将BCG加入各组细胞孔内,37℃、5%CO2细胞培养箱中培养。
2 细胞干预及分组
实验分为4组,即对照组、BCG组、对照+SP600125、BCG+SP600125,通路抑制剂SP600125组即RAW264.7细胞预先用含10 μmol/L SP600125的培养液预处理1 h后,再将BCG与RAW264.7细胞共培养12h,继续后续实验。
3 实时荧光定量(Real-time quantification PCR,RT-qPCR)实验检测Bax、Bcl-2、caspase-3 mRNA水平
采用实时荧光定量(Real-time quantification PCR,RT-qPCR)检测1.2.3各组细胞及HCV29细胞中Bax、Bcl-2、caspase-3 mRNA相对表达量。以β-actin为内参,反应体系为15μL,2×SYBR Mix 8μL,上下游引物各 0.5μL,cDNA模板2μL,去离子水4μL,反应条件:95℃,120s;95℃,30s;60℃,75s;95℃,15s共40个循环,采用2-ΔΔCt法分别计算Bax、Bcl-2、caspase-3 mRNA相对表达量。Bax、Bcl-2、caspase-3、β-actin引物序列(见表1)。

表1 Bax、Bcl-2、caspase-3和β-actin引物序列
4 吖啶橙/溴乙锭(AO/EB)染色观察自噬
吖啶橙/溴乙锭(AO/EB)染色检测各处理组细胞自噬率,将以上各组细胞吸去培养液,PBS洗涤2遍,加入2μL的AO/EB溶液,各含AO、EB的浓度分别为0.1mg/mL,室温避光孵育15min,加入500μL PBS洗涤2~3次,荧光显微镜观察细胞自噬。
5 噻唑蓝比色法(MTT)检测RAW264.7细胞存活率
将各组RAW264.7细胞,每孔加20 μL的MTT溶液,37℃孵育4 h,弃上清液,每孔加入150 μL的DMSO,全自动酶标仪490 nm处测定吸光度OD值,实验重复3次,细胞存活率(%)=(OD实验组/OD空白对照组)×100%。
6 流式细胞术检测细胞凋亡
各组细胞用0.25%EDTA的胰酶溶液消化细胞,PBS洗涤2~3次后将细胞制成细胞悬液,加入 5 μl Annexin V-FITC 混合均匀,在4℃条件下避光孵育 20 min,再加 5 μL PI 染液,孵育 5 min,流式细胞仪检测细胞凋亡。
7 免疫印迹法(Western blotting,WB)检测JNK、p38MAPK、ERK1/2、LC3、Beclin-1、P62自噬相关蛋白表达
收集各组细胞,冷PBS洗涤去除BCG,加入2 ml细胞裂解液使蛋白充分裂解,离心取上清蛋白,BCA试剂盒检测蛋白浓度,取50μg蛋白加入上样缓冲液沸水煮5min,经SDS-PAGE电泳、转膜后,加5%脱脂奶粉封闭2h,分别加入一抗p38MAPK、JNK、ERK1/2、p-p38MAPK、p-JNK、p-ERK1/2、LC3、Beclin-1、P62和β-actin(1 ∶1 000),4℃孵育过夜,室温平衡后,TBST溶液漂洗,再加入HRP标记二抗(1 ∶500),室温避光孵育2h,使用ECL化学发光液暗室曝光显影,凝胶成像系统拍照并对各条带进行灰度分析,分析条带实验结果。
三、统计学方法

结 果
一、 BCG诱导RAW264.7细胞中JNK、ERK1/2、p38MAPK蛋白表达水平
与对照组相比,BCG组RAW264.7细胞中ERK1/2、p38MAPK蛋白表达差异不明显(P>0.05),JNK蛋白及磷酸化表达水平显著升高(P<0.05);与BCG组相比,BCG+SP600125组ERK1/2、p38MAPK蛋白及磷酸化水平表达差异无统计学意义(P>0.05),JNK蛋白及磷酸化水平表达显著降低,差异有统计学意义(P<0.05)(见表2,图1)。

图1 各组细胞中JNK、ERK1/2、p38MAPK蛋白表达
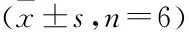
表2 BCG诱导RAW264.7细胞中JNK、p38MAPK蛋白表达水平
二、JNK/MAPK通路对BCG感染RAW264.7细胞自噬的影响
与对照组相比,BCG组RAW264.7细胞中橘、红色荧光增多,自噬水平增加,差异有统计学意义(P<0.05);与BCG组相比,BCG+SP600125组细胞中橘、红色荧光减少,自噬水平著降低,差异有统计学意义(P<0.05)(见图2)。

图2 各组RAW264.7细胞自噬(×400)
三、JNK/MAPK通路对BCG感染RAW264.7细胞存活率的影响
与对照组相比,BCG组RAW264.7细胞存活率显著降低,差异有统计学意义(P<0.05);与BCG组相比,BCG+SP600125组存活率著升高,差异有统计学意义(P<0.05)(见表3)。
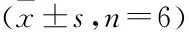
表3 NK/MAPK通路对BCG感染RAW264.7细胞存活率的影响
四、各组细胞Bax、Bcl-2、caspase-3表达水平情况
与对照组相比,BCG组RAW264.7细胞中Bax、caspase-3 mRNA表达水平显著升高,Bcl-2 mRNA水平降低,差异有统计学意义(P<0.05);与BCG组相比,BCG+SP600125组Bax、caspase-3 mRNA表达显著降低,Bcl-2 mRNA水平升高,差异有统计学意义(P<0.05)(见表4)。
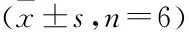
表4 各组细胞Bax、Bcl-2、caspase-3 mRNA表达水平情况
五、 JNK/MAPK通路对BCG感染RAW264.7细胞凋亡的影响
与对照组相比,BCG组RAW264.7细胞凋亡率显著升高,差异有统计学意义(P<0.05);与BCG组相比,BCG+SP600125组凋亡率著降低,差异有统计学意义(P<0.05)(见表5、图3)。

图3 各组RAW264.7细胞凋亡
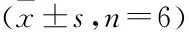
表5 JNK/MAPK通路对BCG感染RAW264.7细胞凋亡的影响
六、JNK/MAPK通路对BCG感染RAW264.7细胞LC3、Beclin-1、P62蛋白表达的影响
与对照组相比,BCG组LC3、Beclin-1蛋白表达显著升高,P62蛋白表达显著降低,差异有统计学意义(P<0.05);与BCG组相比,BCG+SP600125组LC3、Beclin-1蛋白表达显著降低,P62蛋白表达显著升高,差异有统计学意义(P<0.05)(见图4、表6)。
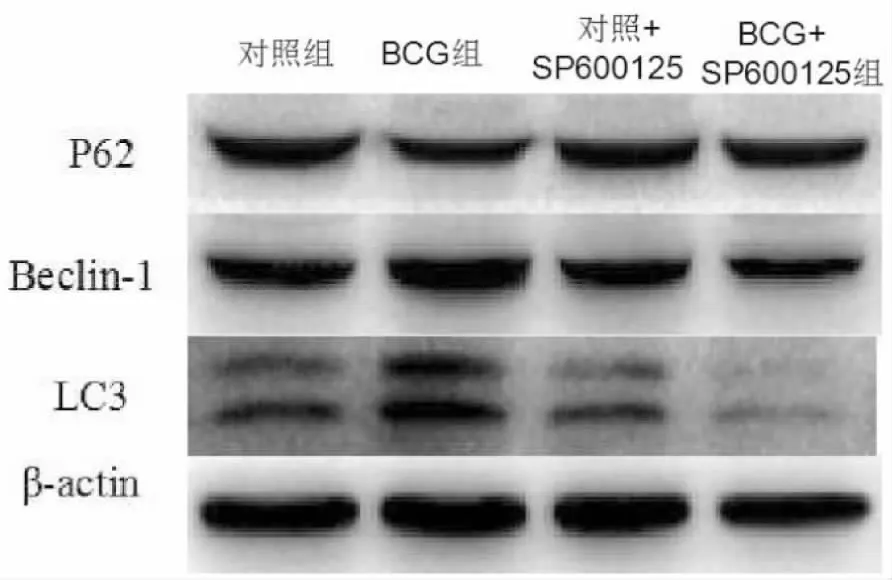
图4 各组细胞LC3、Beclin-1、P62蛋白表达电泳图
表6 各组细胞LC3、Beclin-1、P62蛋白表达情况
讨 论
MTB存在于被感染宿主巨噬细胞内,可通过多种机制对巨噬细胞的凋亡进行调控,巨噬细胞凋亡对于MTB的生存至关重要,影响MTB的发生、发展及预后[8]。自噬是细胞维持自身稳态的一种机制,在免疫反应中发挥重要作用,研究表明,细胞自噬具有清除MTB的作用,因此,研究巨噬细胞的凋亡、自噬,可以进一步明确MTB的致病机制,为MTB的治疗提供新的治疗方向[9-10]。
当机体感染MTB之后,巨噬细胞可以通过自身凋亡以杀死MTB,同时激活邻近未被感染的巨噬细胞,来增强机体对MTB的杀伤力。本研究结果显示,BCG感染巨噬细胞 RAW264.7后,细胞存活率降低,凋亡率升高,Bax、caspase-3表达水平增加,Bcl-2表达水平降低,表明BCG感染促进细胞凋亡,与姬文兰等[11]研究结果一致。自噬是巨噬细胞中固有免疫和适应性免疫的重要组成部分,有利于细胞清除感染的病原体来减轻自身损伤,自噬与凋亡作为程序性死亡的两种方式,二者既相互独立,又紧密相连。LC3是自噬小体标志蛋白,LC3的水平高低可以反映细胞发生自噬的水平, Beclin-1 是抑癌基因 BECN1 表达的自噬相关标志物,p62为自噬活化过程中的一个调节分子,其表达水平与与自噬程度呈负相关[12-13]。本研究结果显示,BCG感染巨噬细胞 RAW264.7后,细胞自噬水平升高,LC3、Beclin-1蛋白表达水平升高、P62蛋白表达水平降低,表明BCG感染增加巨噬细胞 RAW264.7发生自噬。然而BCG感染引起巨噬细胞凋亡与自噬的具体机制尚不清楚。
MAPK通路主要包括胞外信号调节蛋白激酶(Extracellular signal-regulated protein kinase,ERK),c-JunN 末端激酶(c-JunN -terminal kinase,JUK)及p38激酶(p38 kinase)[14],在生长因子、细胞因子等刺激下,MAPK可通过苏氨酸/酪氨酸双位点磷酸化激活多种转录因子,对细胞的生长、分化等多项生理过程进行调控,多项研究表明,MAPK信号通路参与了凋亡与自噬的发生[15-16]。尹昭懿等[17]研究表明,中药珍珠梅黄酮纳米粒上调MAPK通路相关分子JNK,下调ERK的活性,抑制人肝癌HepG2细胞增殖,诱导细胞凋亡及自噬。Kang等[18]研究表明,飞燕草素通过诱导自噬和激活JNK/MAPK途径而充当放射增敏剂,从而增强了非小细胞肺癌细胞的凋亡。本研究显示BCG感染的RAW264.7细胞中ERK1/2、p38MAPK蛋白表达差异不明显,JNK蛋白及磷酸化表达水平显著升高,说明BCG感染主要影响RAW264.7细胞中JNK通路,不影响ERK1/2、p38MAPK通路,表明JNK通路在巨噬细胞抗MTB感染中具有重要作用。万敏等[19]研究表明,在异丙肾上腺素诱导的心肌细胞中,盐酸羟考酮能抑制JNK/p38 MAPK信号通路,而促进心肌细胞增殖,减少细胞凋亡,表明抑制JNK/MAPK通路具有抗细胞凋亡的作用。本研究使用通路抑制剂SP600125处理BCG感染的 RAW264.7细胞后,细胞存活率及Bcl-2表达水平增加,Bax、caspase-3表达水平及凋亡率下降,表明抑制JNK通路可减少BCG感染的 RAW264.7细胞凋亡,与先前报道一致。另外,使用通路抑制剂SP600125处理BCG感染的 RAW264.7细胞,细胞自噬水平下降,LC3、Beclin-1蛋白表达水平降低、P62蛋白表达水平升高,表明MAPK家族中的JNK/通路与BCG感染的 RAW264.7细胞自噬有关。
综上,结核杆菌感染可抑制巨噬细胞增殖、诱导巨噬细胞凋亡与自噬,可能与激活JNK/MAPK通路有关。
