湖泊水体微生物四醚膜脂化合物研究进展*
2021-09-23李婧婧郑峰峰雷丽丹
李婧婧,杨 欢,郑峰峰,高 超,雷丽丹
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008) (2:中国地质大学(武汉)生物地质与环境地质国家重点实验室流域关键带演化湖北省重点实验室,武汉 430074) (3:南方科技大学海洋科学与工程系深圳古菌组学重点实验室,深圳 518055) (4:西南大学岩溶环境重庆市重点实验室,重庆 400715)
来源于微生物细胞膜脂的甘油二烷基甘油四醚(glycerol dialkyl glycerol tetraethers,GDGTs),是一类对环境参数响应敏感的化合物,特别是温度以及pH值,因此成为近年来古环境定量重建研究的热点之一[1]. 根据生物来源、碳链结构以及立体构型等差异,GDGTs主要分为两种类型,一类是来源于古菌的类异戊二烯GDGTs(isoprenoid GDGTs,简称isoGDGTs),其碳骨架以类异戊二烯(—C5H12)为单元,并携带不同个数的五元环和六元环,甘油构型为2,3-二-O-酰基-sn-甘油结构(图1);另一类则是由细菌合成的支链GDGTs(branched GDGTs,简称brGDGTs),碳骨架由携带不同个数甲基(—CH3)的C28烷基链组成,携带0 ~ 2个五元环,甘油构型为1,2-二-O-酰基-sn-甘油结构(图1)[2]. 近10年来,随着测试技术和分离手段的逐步优化,有别于传统结构的四醚类化合物也被陆续鉴定,包括碳链上携带不同个数羟基(—OH)以及五元环的羟基GDGTs(hydroxy GDGTs,简称OH-GDGTs)[3](图1)、两条碳链以一个共价键联接的甘油单烷基甘油四醚化合物(glycerol monoalkyl glycerol tetraethers,简称 GMGT,因结构形似H,也称H-GDGTs)[4-5]. 此外,isoGDGTs以及brGDGTs的异构体(isomers)也被有效分离[6-7],近年来对不同生境这些化合物的生物来源及其所蕴含环境信息的研究,已为古环境变迁以及定量重建研究提供了新基础与新方法[8-10].
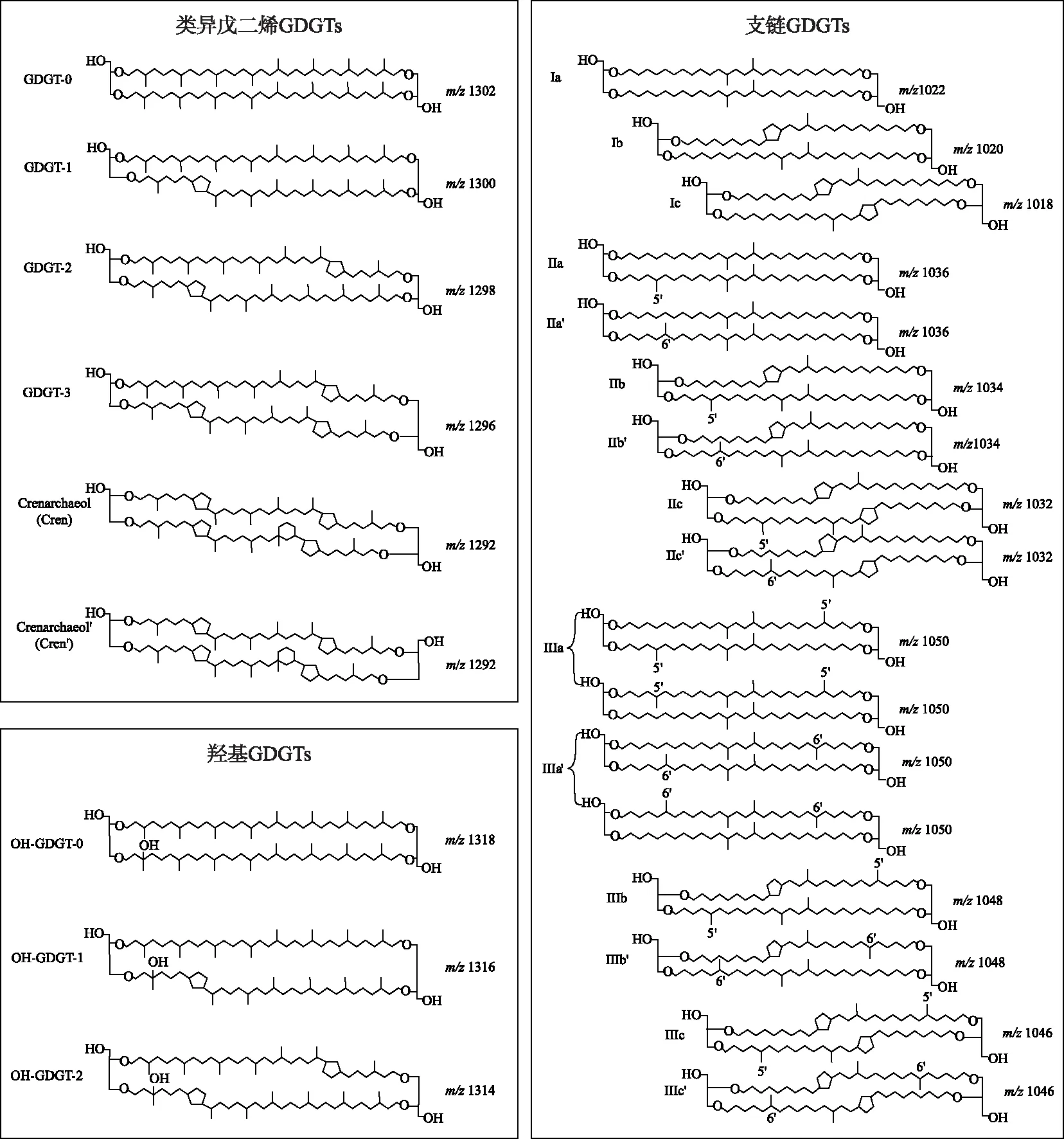
图1 文中涉及的类异戊二烯isoGDGTs、羟基OH-GDGTs与支链brGDGTs的化学结构 (其中isoGDGTs以及OH-GDGTs的阿拉伯数字指示五元环个数;brGDGTs的罗马数字指示甲基个数, 字母指示五元环个数,化合物携带“′”符号则指示6-甲基brGDGTs,即甲基位于碳链的α和/或ω-6位置)Fig.1 Chemical structure of isoprenoid GDGTs, hydroxy GDGTs and branched GDGTs discussed in this text (For isoGDGTs and OH-GDGTs, arabic numbers indicate the cyclopentane rings. For brGDGTs, roman numbers indicate tetra-(Ⅰ), penta-(Ⅱ), and hexamethylated (Ⅲ) brGDGTs, letters indicate the absence (a), presence of one (b), and two (c) cyclopentane rings, while the prime symbols indicate 6-methyl brGDGT isomers in which the additional methyl groups occur at the α and/or ω-6 position instead of α and/or ω-5 position of 5-methyl brGDGTs)
GDGTs与环境参数之间的定量关系也被逐步挖掘,其中被广泛用于古环境定量重建的GDGTs指标主要有两种,分别是TEX86与MBT/CBT指标[11]. TEX86(tetraether index of 86 carbon atoms)指标首先构建于海洋环境,研究显示海洋表层沉积物中isoGDGTs碳链上五元环的环化程度与海水表层温度(sea surface temperature,SST)之间存在显著正相关关系[12],其生理学基础是这些isoGDGTs来源于海洋奇古菌Thaumarchaeota 1.1a,可以通过改变自身环化程度以适应环境温度变化[13]. MBT/CBT指标(methylation index/cyclisation ratio of branched tetraethers)则是根据土壤细菌合成的brGDGTs,其甲基化和环化程度有效指示大气年均气温(annual mean air temperature,MAT)以及pH值的变化[14]. 与海洋和土壤相比,湖泊在物理(大小、深浅、流域形态)和化学(温度、盐度、pH值、氧浓度以及营养盐浓度)等特征上呈现多样性的特点,然而即使在极端湖泊,如高盐[15]、富/寡营养[16]湖泊等也能检测到GDGTs的分布,这为湖泊环境开展GDGTs研究提供了重要前提. 事实上,将上述基于海洋与土壤环境构建的TEX86、MBT/CBT指标应用到湖泊环境,在一定程度上也能定量重建湖泊温度和pH值的变化[17-19]. 然而随着研究工作的逐步推进,这些指标在湖泊环境的应用也面临着挑战和不确定性,因为湖泊沉积物合成有别于土壤的GDGTs[15, 20-21],因此将基于土壤环境建立的MBT/CBT指标生搬硬套于湖泊环境,必然会造成恢复的温度或者pH值与实测值之间的误差,故后续根据湖泊环境brGDGTs分布特征而建立MBT/CBT指标[22-23],以及选取湖泊brGDGTs中对环境响应最敏感的组分构建逐步回归方程[24-26],以此进一步优化GDGTs在湖泊古环境定量重建的准确性.
然而越来越多的研究显示,湖泊水体也会贡献GDGTs,并且由于不同湖泊物理、化学以及生物属性的差异,不同湖泊水体合成的GDGTs存在差异,以及在同一湖泊水体不同层位的GDGTs也存在差异性分布[27],表明水体中GDGTs分布的多样性,这是在以往研究中经常被忽略的部分. 例如水体中混入产甲烷古菌与甲烷氧化古菌的影响[28-29],则势必会贡献与对温度响应敏感的奇古菌Thaumarchaeota 1.1a类似的isoGDGTs分布模式[13],而这些不同来源的GDGTs对温度响应存在差异,因此如果在利用GDGTs进行古环境定量重建时,对这些不同古菌来源isoGDGTs进行无差别计算,不仅会引起重建温度的偏差,更是忽略湖泊水体中生物地球化学过程的研究. 因此即使利用上述基于湖泊沉积物构建的GDGTs相关指标来重建环境变迁信息时,也往往会带来误差. 事实上湖泊水体普遍合成GDGTs,这些化合物的生物来源以及对环境响应如何,是否有别于土壤或者湖泊沉积物中的GDGTs还需进一步挖掘,鉴于其普遍性以及对湖泊沉积物GDGTs的重要贡献,非常有必要开展湖泊水体GDGTs的现代过程研究.
与2000年就在全球范围开展的湖泊沉积物GDGTs调查工作相比[30],湖泊水体GDGTs的研究工作始于2009年[28],起步较晚且相对分散,涉及欧洲、非洲、北美以及中国等地区的湖泊(图2,3),主要通过获取水体悬浮颗粒物(suspended particulate matter,SPM)的方式来富集GDGTs[28],或者借助沉积物捕获器(sediment trap)手段来富集水体中的沉降颗粒(settling particles)以获取不同时间分辨率的GDGTs样品[27](表1). 借助这两种富集方式已在不同类型湖泊开展水体GDGTs研究,包括深/浅水湖泊、富营养/寡营养湖泊以及水深相对较浅的池塘(Pond)等. 就目前研究现状来看,湖泊水体GDGTs研究的关键问题包括以下几个方面:首先水体GDGTs分布特征如何,对于深水湖泊不同层位的水体,其GDGTs分布是否存在深度差异,如果存在,控制因子是什么;其次,湖泊水体GDGTs分布是否存在时间差异,其分布有无季节性效应. 基于以上问题,本文总结这10年来前人在湖泊水体GDGTs研究方向的进展,首先介绍水体GDGTs的分布模式及其来源,并进一步分析影响水体GDGTs分布的因素,为后续准确开展GDGTs古环境定量重建研究提供基础和佐证.

图2 全球已开展水体GDGTs研究的湖泊(参考文献详见表1) Fig.2 Distribution of GDGTs in global lake water column from previous literature, refer to Tab.1
图3 基于湖泊水体GDGTs发表的文章数量 (来源于 ISI Web of Science, 截止日期2020年8月2日)Fig.3 Number of publications on GDGTs in lake water column (from ISI Web of Science extracted on August 2nd, 2020)
1 湖泊水体GDGTs分布研究
作为一个相对独立的沉积载体,湖泊可以分布在每一个自然带,不同湖泊在地质、地貌、气候和水文等自然条件上的差异,导致湖泊水体在物理、化学以及生物属性上呈现多样性. 特别是在深水湖泊,湖泊水体因水深、温度以及溶解氧(DO)等参数的差异,会产生比较显著的分层现象,即水体不同层位的差别. 需要注意的是,虽然GDGTs在浅水湖泊也有分布,然而在水深相对较浅的湖泊,并不显著的水深差可能无法引起GDGTs的显著性差异分布. 为方便阐述总结这些湖泊水体GDGTs分布特征,本部分将从不同生物来源(古菌vs细菌)GDGTs浓度与各组分变化这两个方面,梳理近年来湖泊水体,特别是深水湖泊不同深度水体GDGTs研究进展.
1.1 湖泊水体GDGTs浓度随水深变化研究
不同类型湖泊的调查结果显示水体不同层位均可合成GDGTs,例如即使在非洲深水湖泊——Tanganyika湖水深1000 m处,也能检测出不同类型GDGTs化合物的分布[31]. 然而由于水体不同层位存在温度、含氧量、光照以及营养盐浓度等因素的差异[32-34],在某种程度上影响合成GDGTs微生物的生长或繁盛,从而导致GDGTs浓度在不同层位水体出现差异,并且不同湖泊水体中GDGTs浓度随水深变化的规律也不尽相同(表1),在某些湖泊呈现显著上升或降低的趋势,在某些湖泊则未呈现显著变化,抑或并非呈线性上升或者下降的模式. 此外,考虑到本文对湖泊水柱GDGTs浓度的对比研究大多在同一湖泊完成,因此并没有比对不同湖泊GDGTs浓度研究,故也未对不同研究中GDGTs浓度或者通量做统一数学换算分析.

表1 不同湖泊水体isoGDGTs与brGDGTs浓度随水深的变化
不同学者在非洲东部赤道附近的火成湖——Chala(也称Challa)湖开展了详尽的GDGTs研究,结果显示该湖泊水体中古菌isoGDGTs以及细菌brGDGTs的浓度均随水深呈增加趋势,并在氧跃层附近发生显著变化,相较之下,古菌isoGDGTs浓度的增幅要明显高于细菌brGDGTs[27]. 然而这些观测结果是基于GDGTs核心脂类(core lipid,CL)部分而言,即微生物死亡并降解之后,被保存下来的GDGTs部分[35],为开展对比研究,随后有学者分析该湖泊GDGTs完整极性(intact polar lipid,IPL)脂类部分的变化,即微生物活体还未降解,仍携带极性头基部分的GDGTs[36]. 对比结果显示,GDGT-0与其他isoGDGTs化合物呈现并不一致的变化,无论是IPL还是CL部分,GDGT-0在氧跃层附近均未发生变化,但在水体深部的厌氧层,浓度发生显著增加,特别是IPL GDGT-0的浓度呈数量级增加;然而除GDGT-0以外的其他isoGDGTs化合物则是在氧跃层附近就显著增加,但在深部厌氧层,这些isoGDGTs的浓度均有所降低,但仍高于水体上部含氧层位[36]. 随后在对Chala湖不同深度水体IPL brGDGTs以及CL brGDGTs浓度变化的研究中发现,虽然两者均呈现随水深增加的趋势,但后者的增幅要明显高于前者,因此在水体深部的厌氧层,用来指示IPL与CL相对比例的IPL%也由水体上层的35%降低至10%[37]. 最近有学者报道了Chala湖brGDGTs及其异构体在水体中的变化研究,发现几类浓度占优势的brGDGTs化合物,其浓度均随水深增加,在水体深部的厌氧层达到最高[38]. 综上对非洲Chala湖水体GDGTs浓度的研究可以发现,不同类型GDGTs化合物随水深变化的表现不尽相同,但大多随水深呈现增加的趋势.
除非洲Chala湖以外,在其他湖泊水体中也有类似规律,即isoGDGTs与brGDGTs的浓度均随水深增加,如瑞士深水湖泊Lucerne湖[39]以及北美深水湖泊Superior湖[40]. 当然并不是所有湖泊都能够同时满足这两类GDGTs浓度变化的研究,往往侧重某一类GDGTs化合物的分析. 例如在不同类型湖泊中也分别观测到isoGDGTs以及brGDGTs随水深增加的现象,前者包括东非断陷湖泊Malawi湖[45]以及中国东北地区火山湖[46]中的isoGDGTs,虽然Malawi湖的数据表明水体中isoGDGTs的浓度随水深增加到一定深度后又呈现下降趋势;后者则包括瑞士Lugano湖,研究显示水体中IPL brGDGTs以及CL brGDGTs浓度均随水深增加,其中IPL brGDGTs增幅更显著,IPL%也由表层水体的30%增至深部水体的70%[32]. 此外北美深水池塘(Basin池塘)[43],以及上述中国东北的火山湖[48],水体中brGDGTs的浓度也均随水深而呈现增加趋势,在水体深部呈现最大值. 需要注意的是,虽然这些湖泊水体中isoGDGTs或者brGDGTs的浓度往往呈现随水深增加的现象,但不都是简单的线性模式,在水体最深处这些化合物的浓度也并非达到峰值,在实际观测中,往往会发现GDGTs浓度在上升到临界值之后,会呈现下降的趋势.
然而随着研究范围的不断延伸和扩大,不同深度水体中GDGTs浓度随深度增加的现象并非普遍规律,在不少湖泊均出现下降的趋势,包括瑞士的富营养湖泊Lugano湖以及寡营养湖泊Brienz湖,这两个营养化程度差异显著的湖泊,无论是在春季还是秋季,水体中isoGDGTs和brGDGTs的浓度均随水深而降低[16]. 此外,在瑞士的浅水湖泊Rotsee湖[21],以及地中海附近的一个喀斯特湖也发现类似规律[49]. 当然,在实际研究过程中还会发现,不同深度水体isoGDGTs和brGDGTs随水深呈现不一致变化的现象,例如位于中国华南地区的玛珥湖——湖光岩,虽然湖泊最大水深只有20 m,但水体中brGDGTs的分布有着显著的“深度效应”,深层水体brGDGTs的浓度要高于浅层水体,然而isoGDGTs的分布则并未发现类似现象[34]. 同样在挪威的Indrepollen湖,水体中brGDGTs和isoGDGTs随水深变化的趋势也截然不同,随着水深的增加,isoGDGTs浓度呈现先增加后降低的趋势,而brGDGTs则在表层水体达到峰值,随后一直保持低浓度但在接近湖底位置又略有回升[33]. 然而在某些湖泊,水深对GDGTs浓度的影响似乎并不能简单描述为增加或减少,如北美浅水碟型池塘(Lower King池塘),可能是因为水体相对较浅,因此brGDGTs浓度变化较大,在观测期的绝大多数时间,底部水体brGDGTs的浓度均要高于表层水体,然而在观测期的某些时间段,表层水体brGDGTs浓度会高出底层水体十倍左右[41].
综上,在对不同地区、不同类型湖泊水体GDGTs浓度与水深关系的研究中不难发现,虽然大部分湖泊水体GDGTs的浓度随水深发生变化,呈现增加或者减少的趋势,并且不同来源GDGTs的变化模式还存在差异. 然而需要注意的是,在某些湖泊水体GDGTs浓度随水深的变化并不显著,如苏格兰Lomond湖以及山西吕梁山公海,这两个湖泊水体GDGTs浓度似乎并不受水深影响,与水深之间也不存在显著关系[42,47],因此仅仅考虑GDGTs浓度的变化可能还无法全面评估湖泊水体中GDGTs的变化,还需进一步分析水体GDGTs各组分的变化规律.
1.2 湖泊水体GDGTs分布特征研究
GDGTs组成的差异主要体现在不同类型GDGTs化合物的相对浓度以及相对浓度最高的化合物(最占优势组分)的变化上,此外GDGTs的相关指标如TEX86、MBT/CBT等的变化也在一定程度上反映水体GDGTs组分变化的信息,据此本部分将分别阐述isoGDGTs与brGDGTs组成在不同深度水体中的分布特征.
1.2.1 湖泊水体isoGDGTs分布特征研究 以开展GDGTs系统研究的Chala湖为例,陆续有研究报道isoGDGTs各化合物在不同层位水体的变化特征. 其中开展较早的研究工作仅关注CL isoGDGTs组分的变化,结果显示在氧浓度较高的上层水体,不携带任何环结构的GDGT-0与指示奇古菌的特征标志物——crenarchaeol,两者的相对浓度差别不大,但在氧跃层附近均发生显著增加,特别是在水体深部的缺氧层位,GDGT-0浓度增加明显,约高出上层含氧水体两个数量级,且远高于crenarchaeol,虽然后者的浓度随水深也呈上升趋势[27]. 这与后续分别探讨CL isoGDGTs以及 IPL isoGDGTs的研究结果一致,即表层水体中CL GDGT-0的浓度占优势,但在位于水体中部的氧跃层附近,CL crenarchaeol的浓度显著升高,成为该层位的主要组分,然而随着水深的继续增加,CL crenarchaeol逐渐降低,相反CL GDGT-0的浓度显著上升,从而成为Chala湖水体深部厌氧层的主要组分[36]. 值得注意的是,GDGT-0以及crenarchaeol作为Chala湖水体中浓度较高的组分,这两类化合物的IPL以及CL组分随水深变化并不一致[36]. 来自水体3个不同深度即氧跃层以上、氧跃层以及氧跃层以下的结果显示,IPL GDGT-0在上层含氧水体以及深部厌氧层位的相对浓度都很高,占明显优势,分别占到80%以及90%以上,然而CL GDGT-0的相对浓度仅在深部厌氧层位呈现高值,达到90%以上;相反crenarchaeol的IPL以及CL在深部厌氧层位的浓度都很低,但CL crenarchaeol在氧跃层附近浓度较高,远高于CL GDGT-0,相较之下在此深度,IPL crenarchaeol与CL crenarchaeol相对浓度很接近[36].
1.2.2 湖泊水体brGDGTs分布特征研究 同样是在非洲Chala湖开展的工作,研究初期的结果显示,不同层位水体brGDGTs均以相对高浓度的Ⅱ占主导,但Ⅲ的相对浓度则随水深而减少,而I随水深则未发生显著变化[27]. 最近有学者报道该湖泊不同深度水体brGDGTs及其异构体的分布情况(图4),与研究初期未有效分离brGDGTs的结果类似,Ⅱ仍然是水体中分布最多的化合物[38]. 但需要注意的是,新近被分离的5-甲基brGDGTs以及6-甲基brGDGTs异构体,这两类化合物的浓度在不同的水体分层时期会呈现差异性变化,例如在观测期的第1个水体分层时期(2013-2014年),5-甲基brGDGTs 系列化合物,Ⅰb、Ⅱb的浓度在水深35~60 m处占优势,而6-甲基brGDGTs系列化合物,Ⅱa′、Ⅲa′的浓度则在底部水体(60~80 m处)较高;而在第2个水体分层时期(2014-2015年),Ⅰb、Ⅱb的浓度较第1个水体分层时期显著减少,并且高浓度的Ⅱa′、Ⅲa′出现在水深25~35 m处,明显有别于第1个分层时期的水体底部[38].

图4 2013-2015年期间东非Chala湖不同深度水体brGDGTs的分布特征(根据文献[38]修改)Fig.4 Distribution pattern of brGDGTs in water column from Lake Chala, East Africa during the period of 2013 and 2015(modified from reference [38])
除Chala湖以外,对瑞士深水湖泊Lugano湖不同深度水体brGDGTs的研究结果也显示,不同类型brGDGTs化合物对水深变化响应各异. 例如,不携带五元环的Ⅲ系列化合物(Ⅲa、Ⅲa′以及Ⅲa″)的浓度在水深不同层位均最高,然而这3类化合物随水深呈现不同的变化趋势,其中Ⅲa随水深逐渐增加,在深部厌氧水体中达到最高;而Ⅲa′则呈现不一样的变化模式,在水体上层含氧层位浓度较低,随水深呈增加的趋势,并在水体氧化还原过渡带(redox transition zone,RTZ)上部达到最高值,但在RTZ位置,Ⅲa′浓度快速降低,随后低浓度的Ⅲa′随水深趋于稳定[32]. 值得注意的是,在该湖泊水体中还检测到新被鉴定的Ⅲa″化合物[50],虽然仅出现在水体深部的厌氧层位(> 90 m),但其浓度随水深逐渐增加,表明此类新型异构体主要来源于该层位厌氧细菌的贡献[32]. 此外在其他湖泊的研究结果表明,水体brGDGTs各组分随水深变化的情况不尽相同,某些brGDGTs化合物在水体不同层位的相对浓度较稳定,并不会因为水深差异而发生变化,例如北美Basin池塘中的Ⅰ系列化合物[43]以及中国东北火山湖的Ⅱa[48],但其他化合物如Ⅲ在这两个湖泊均呈现随水深增加的现象. 需要指出的是,正是由于不同类型brGDGTs化合物随水深的差异性变化,在一定程度上导致相关的指标如MBT、CBT等也随水深发生变化[33,43].
需要注意的是,水体GDGTs浓度与各组分的变化趋势并不一致,即水深可能会影响GDGTs浓度的变化,但这并不意味着GDGTs各组分也会发生变化. 例如,瑞士Lugano湖以及Brienz湖的对比研究发现,水体中isoGDGTs各组分随水深都呈现降低的趋势,但相对浓度的变化并不显著,均以高浓度的GDGT-0为主[16]. 类似结果也出现在瑞士的Rotsee湖,水体GDGTs浓度也呈现随水深降低的趋势,但isoGDGTs以及brGDGTs各组分的相对浓度随水深的变化均不显著,GDGT-0以及Ⅱa依然是该湖泊不同深度水体中的最优势组分[21]. 同样北美Superior湖也有类似结果,虽然在不同季节,水体isoGDGTs浓度均呈现随水深增加的趋势,但与Chala湖水体中变化显著的GDGT-0以及crenarchaeol[27,36]不同的是,这两类化合物浓度的变幅都非常接近,因此相对浓度并未发生改变,究其原因可能在于Superior湖水体中isoGDGTs来源单一,大多由奇古菌合成[40],而Chala湖水体深部的isoGDGTs可能有其他非奇古菌来源的贡献,因此会发生显著变化[27],可见isoGDGTs的生物来源影响着此类化合物在水体不同层位的分布. 此外,在瑞士Lucerne湖[39]以及东Tanganyika湖[31]也发现类似规律,即水体中GDGTs浓度均随水深而增加,但各组分之间的相对浓度变化并不显著,不同层位水体均以高浓度的crenarchaeol为主要组分. 另外在其他湖泊也发现水深对GDGTs浓度的改变要远多于GDGTs各化合物的组成,包括北美Lower King池塘[41]、中国华南湖光岩[34]、挪威Indrepollen湖[33]以及非洲的Malawi湖[45]等.
2 湖泊水体GDGTs生物来源分析
2.1 湖泊水体isoGDGTs生物来源分析
来源于古菌的isoGDGTs在湖泊水体中分布极广,几乎覆盖水体的所有层位[27,31],然而前人的研究已指出水体不同层位isoGDGTs的分布模式存在差异,除了水体不同层位环境参数差异这一外因以外,isoGDGTs不同的生物来源很有可能是造成这些差异的内因. 来自分子生物学的证据显示,与海洋环境类似,湖泊水体以及沉积物中也广泛分布着奇古菌Thaumarchaeota[51-53],因此在大多数湖泊,Thaumarchaeota是合成isoGDGTs的主要生物来源之一[54]. 瑞士Lucerne湖水体的SPM、沉积物捕获器以及表层沉积物中isoGDGTs的分布模式非常一致,表明这些化合物可能是同一生物来源,而高浓度的crenarchaeol则表明Thaumarchaeota是不同深度水体isoGDGTs的主要生物来源之一[39]. 借助克隆以及测序技术等分子生物学手段分析北美深水湖泊Superior湖水体中古菌组成,结果显示Thaumarchaeota是不同深度水体中古菌的主要组分,且在系统发生学上与由海洋环境分离的奇古菌Nitrosopumilusmaritimus非常接近[55],在此分子生物学结果的基础上,结合水体中高浓度的GDGT-0与crenarchaeol类似的分布特征,作者推测Superior湖不同深度水体isoGDGTs主要来源于Thaumarchaeota的贡献[40]. 然而需要注意的是,Superior湖水体16S rRNA的结果显示广古菌Euryarchaeota仅分布在深部水体,在沉积物—水界面处的比例可达15%,表明该湖泊不同深度水体的古菌分布存在显著差异[55].
此外,湖泊环境广泛分布的产甲烷古菌Methanogens也是isoGDGTs的主要生物来源之一[56],除GDGT-0以外,产甲烷古菌也合成其他类型的isoGDGTs化合物,包括GDGT-1、GDGT-2以及GDGT-3(图1)等[57]. 前人的研究显示产甲烷古菌在不同类型湖泊沉积物贡献不同比例的isoGDGTs[15,58],除产甲烷古菌合成的其他生物标志物如古菌醇(archaeol)及其碳同位素组成以外,产甲烷古菌功能基因mcrA的检出,也为产甲烷古菌在湖泊环境的分布提供分子生物学的证据[59]. 和湖泊沉积物一样,湖泊水体也分布着产甲烷古菌,特别是在厌氧水体,产甲烷古菌成为GDGT-0的主要生物来源[28,34]. 基于此,有学者提出GDGT-0/crenarchaeol指标以评估产甲烷古菌的贡献程度,该指标的生物学基础是产甲烷古菌合成GDGT-0而无法合成crenarchaeol,而奇古菌则可以同时合成这两类化合物,并指出当该指标大于2时,即代表较多的产甲烷古菌贡献[28],随后该指标被广泛用于衡量湖泊环境产甲烷古菌贡献的多寡[60-61].
来源于东非Chala湖的研究结果也显示不同深度水体isoGDGTs以及古菌群落组成均存在差异. 在对水体isoGDGTs各组分变化的研究中发现,Chala湖水体上层含氧层crenarchaeol与GDGT-0浓度相差不大,但随着水深增加,深部厌氧层GDGT-0的浓度呈数量级上升,导致crenarchaeol的占比明显下降[27]. Chala湖水体分子生物学证据显示水体含氧层的古菌主要是由Thaumarchaeota I.1a以及I.1b占主导,这也是该层位GDGT-0以及crenarchaeol的主要生物来源,而至于水体深部厌氧层位出现高浓度的GDGT-0,作者推测可能来源于其他古菌的贡献,包括奇古菌Thaumarchaeota I.2和泉古菌marine benthic group C(MBG-C),以及隶属于广古菌的嗜盐古菌Halobacteriales等[27]. 随后对该湖泊不同深度水体中指示奇古菌的amoA功能基因分析发现,amoA浓度在水体上部含氧层与下部厌氧层差异显著,在含氧层中高浓度的amoA指示该层位的古菌类型主要是奇古菌Thaumarchaeota I.1a以及I.1b,而深部水体厌氧层位不可培养奇古菌Thaumarchaeota I.2型以及miscellaneous crenarchaeotic group(MCG)则是该层位高浓度GDGT-0的生物来源[36]. 通过上述对不同湖泊水体中isoGDGTs生物来源的研究不难发现,合成isoGDGTs的生物来源具有多样性的特点,此外还需注意的是,即使在同一湖泊,水体不同层位也会分布不同类型的古菌,从而导致不同深度水体中isoGDGTs浓度以及各组分的变化.
2.2 湖泊水体brGDGTs生物来源分析
与isoGDGTs不同,brGDGTs具体生物来源至今还尚未确定,虽然在研究初期发现泥炭厌氧层位brGDGTs浓度更高,从而推测合成brGDGTs的细菌为厌氧类型[2,62]. 后续对比瑞典Saxnäs Mosse泥炭剖面的16S rRNA以及brGDGTs的分布发现,酸杆菌Acidobacteria是细菌类群的主要组分,结合该泥炭剖面brGDGTs的浓度也较isoGDGTs占优势,推测Acidobacteria很有可能是该泥炭高浓度brGDGTs的主要来源[63]. 随后通过分析上覆不同植被类型土壤brGDGTs裂解产物的单体碳同位素组成,揭示合成brGDGTs细菌的碳利用途径,即这些细菌的营养类型为异养或者兼性异养[64]. 基于此,有学者通过提取酸杆菌Acidobacteria几个亚门菌株膜脂的化学组分,发现与brGDGTs的化学构型非常类似,因此酸杆菌Acidobacteria被推测是brGDGTs最有可能的潜在生物来源之一[65-66]. 而酸杆菌确实在某些土壤和泥炭环境中占据细菌群落的主导[63,67],这与上述推测也吻合,相较之下湖泊环境酸杆菌的报道并不常见[68-69],目前聚焦湖泊水体brGDGTs生物来源的研究还非常有限.
最近对瑞士Lugano湖的报道指出,水体中Ⅲa可以跨越氧化还原过渡带分布,并随水深呈增加的趋势,表明在该湖泊中合成Ⅲa的细菌可能是厌氧、需氧亦或是兼性厌氧类型,而其异构体Ⅲa″仅出现在水深超过90 m的地方,因此被认为是由生活在水体深部的厌氧细菌合成[32]. 此外,该湖泊水体的分子生物学结果显示,不同深度水体中Acidobacteria的分布特征与brGDGTs主要类型一致,且在水体不同层位的变化趋势也与brGDGTs的变化类似,表明在Lugano湖酸杆菌是brGDGTs的潜在生物来源之一[32]. 然而值得注意的是,brGDGTs裂解产物烷烃的单体碳同位素结果则表明,合成brGDGTs的细菌也有可能参与水体中的甲烷氧化作用,表明该湖泊水体中不同类型brGDGTs的生物来源存在差异,具有多样性[32]. 来自Chala湖水体16S rRNA的最新研究表明,水体中某些brGDGTs化合物的浓度(Ⅰb、Ⅱb)与酸杆菌亚门SD21基因拷贝数的相关性非常有限[38],可见在Chala湖水体中,酸杆菌并非brGDGTs的主要生物来源,然而在Lugano湖水体中高浓度的Ⅱa、Ⅲa与酸杆菌亚门SD21的浓度呈显著相关[32].
3 影响湖泊水体GDGTs分布的因素
3.1 季节性因素
3.1.1 湖泊水体GDGTs季节性变化研究 湖泊水体GDGTs分布的季节性差异在不同类型湖泊均有报道. 在对北美Lower King池塘两年多的观测发现,水体SPM中brGDGTs的浓度以及沉积物捕获器中brGDGTs的通量均有着明显的季节性变化规律,其中在春季和秋季湖水混匀时期,brGDGTs通量最高,约高出低通量时期两个数量级,作者推测出现此现象的原因与此时增加的颗粒沉降有关,但需要注意的是,brGDGTs各组分的相对浓度并没有呈现显著的年内或者年际差异[41]. 位于地中海附近利比里亚的一个寡营养喀斯特湖泊同时开展水体SPM以及沉积物捕获器对比研究显示,该湖泊水体isoGDGTs浓度以及通量的高值出现在水体分层的4—9月期间,有别于上述Lower King池塘的结果,作者推测该时段高浓度的isoGDGTs可能与以藻类为食的浮游生物繁盛有关[49]. 上述这两个湖泊水体GDGTs分布的季节性差异,除了和合成这些化合物的生物来源差异有关,水体的季节性变化所引起的温度、光照以及营养条件的改变也是影响湖泊水体GDGTs分布变化的主要原因. 此外还有学者对比分析中国中部东湖水体isoGDGTs以及brGDGTs的IPL以及CL部分的研究,调查结果显示不同类型GDGTs的IPL、CL 部分均表现出明显的季节性变化,从而引起相关指标如IPL isoGDGTs%以及IPL brGDGTs%的显著变化,但考虑到研究对象为城市浅水型湖泊,相对深水湖泊更易受环境因素季节性变化的影响[44].
3.1.2 湖泊水体不同层位GDGTs季节性变化研究 与浅水湖泊相比,深水湖泊更能展示不同深度水体GDGTs的季节性变化特征. 例如瑞士深水湖泊Lucerne湖,其表层水体isoGDGTs浓度的高值出现在冬季与来年春季之间,并在湖水混匀的1月份达到最高值,而深部水体isoGDGTs的高值则在夏末和秋季[39]. Lucerne湖水体isoGDGTs的季节性分布变化影响着相关GDGTs指标的变化,例如TEX86指标在表层水体最高,高于其他层位,其最高值通常出现在夏末至秋季,而深部水体TEX86指标的最高值则出现在3月份[39],表明不同深度水体GDGTs浓度以及相关指标都发生季节性变化. 同样在北美Lower King池塘的研究结果也显示,不同深度水体brGDGTs的季节性变化规律并不一致,首先不同水深brGDGTs浓度的季节性变化存在差异,表层水体brGDGTs浓度在春季和夏初之间最高,而该时段底层水体中brGDGTs浓度略高于表层,但在夏末至来年春季湖水混匀的时候,底层水体brGDGTs的浓度则远高于表层,但在有冰雪覆盖的冬季,表层水体brGDGTs浓度则高于底层水体[41]. 此外还需要注意的是,水体表层和底层brGDGTs各组分的相对比例也存在季节性差异,但不携带五元环的Ⅰa、Ⅱa以及Ⅲa系列化合物在水体中的浓度依然占据优势[41]. 然而北美Superior湖连续3年的监测结果显示,位于不同水深的两个沉积物捕获器,在观测期内其isoGDGTs与brGDGTs的通量与沉积通量(mass flux)之间均显示非常一致的季节性变化特征,在冬季和夏季均呈现显著的上升趋势[40],但通量峰值出现的时间并不完全一致,存在一定的时间滞后效应,并且在不同季节这种滞后时间显现出差异. 此外与上述Lucerne湖水体中TEX86指标季节性变化不同的是,Superior湖不同水深沉积物捕获器的TEX86指标在不同季节均未发生显著变化[40]. 苏格兰Lomond湖不同盆地水体GDGTs也呈现不一致的季节变化特征,研究显示南部盆地水体中brGDGTs在不同季节差别不大,但在湖泊的北部盆地,水体IPL brGDGTs与CL brGDGTs的浓度均在3月份出现高值,且不同季节crenarchaeol浓度的高值出现在水体的不同层位[42],研究还显示该湖泊不同水深沉积物捕获器中IPL GDGTs也呈现不同的季节变化规律,表层水体GDGTs通量的季节性变化规律要远远显著于底层[42]. 湖光岩的报道显示,不同水深沉积物捕获器中brGDGTs通量几乎都在冬季达到最高,但不同水深brGDGTs通量的季节性变化并不完全一致,底部水体的brGDGTs通量最高,同样SPM中brGDGTs的分布也有着类似的季节性变化规律,虽然不同层位brGDGTs的浓度差异并不显著,但表层水体中brGDGTs高值出现在冬季,而底部水体的brGDGTs高值则出现在夏季的6月份,可见水体不同层位brGDGTs的季节性变化存在着显著差异[34]. 来自北美Basin池塘水体不同深度的brGDGTs通量也显示在夏季呈现较低值,但随后在秋季出现水体分层时,水体不同层位的brGDGTs通量均呈现明显上升的趋势,并且水深越深,通量增加越显著,据此作者认为湖泊沉积物brGDGTs记录的温度信号实际上是响应的季节信号,即秋季温度而非年均温[43].
然而并非所有湖泊水体中的GDGTs分布均受季节的影响,又或者在不同季节所呈现的差异并不显著. 例如瑞士两个水体营养化程度差异很大的湖泊,水体GDGTs的浓度以及各组分的比例在春季和秋季的差别并不显著,但是水体表层GDGTs的浓度在不同季节还是呈现出差异,在春季GDGTs浓度要高于秋季[16]. 此外中国山西公海水体中brGDGTs的浓度在不同月份也未发生显著变化[47].
3.2 温度因素
在湖泊环境,水深与温度、DO浓度以及pH值之间往往存在一定的耦合关系,因此无法独立评估某一环境因素对水体GDGTs分布的影响,而且从严格意义上来讲,目前还没有直接证据显示温度影响湖泊水体GDGTs的分布,但众多研究结果均表明水体GDGTs敏感响应温度的变化,首先体现在基于GDGTs的分布或相关指标所恢复的温度往往与实测温度接近.
3.2.1 湖泊水体isoGDGTs响应温度变化研究 位于东非Chala湖氧跃层之上的沉积物捕获器中基于TEX86恢复的温度与湖水实测温度一致,因此推测水体中的isoGDGTs可能反映水体上部的温度,但是却无法有效记录湖水温度的季节性变化信号[27]. 而两个营养化程度差异显著的瑞士湖泊研究结果均表明,SPM的TEX86指标所恢复的温度与湖水表层温度接近,但相较之下,表层水体TEX86指标所恢复的温度低于表层水体的原位实测温度,而水体底部TEX86所恢复的温度则要高于水体的原位实测温度,据此作者推测可能是由于不同深度水体GDGTs的生物来源差异造成的,并且位于不同层位水体isoGDGTs生长的时间也不尽相同,因此可能代表着不同时间尺度的温度信号[16]. 但北美Superior湖的研究结果则表明,SPM的TEX86指标在水体出现分层以及混匀时期均能有效反映水体温度变化,但基于TEX86所恢复的温度变幅很小,因此即使在夏季湖水出现分层时期,也没有出现较高的恢复温度,可能与Chala湖水体isoGDGTs表现一致[27],无法有效记载水温的季节性变化信号[40]. 相较之下,Superior湖沉积物捕获器中的TEX86指标则不如SPM中的TEX86能有效响应温度的变化,即使在冬季其沉积通量处于最高值的时候,TEX86指标也无法有效捕获水体温度,但值得注意的是,沉积物捕获器TEX86指标所恢复的温度与同一地点表层沉积物的TEX86指标所恢复的温度一致,均接近水体40 m水深处的温度[40]. 来自苏格兰Lomond湖的结果则显示,位于水深30~60 m处的SPM,其TEX86指标恢复的温度与实测水温之间非常接近[42]. 综上,这些湖泊水体SPM中isoGDGTs的分布敏感响应温度的变化,特别是基于isoGDGTs的TEX86指标所恢复的温度有效指示实测温度.
然而不容忽视的是,奇古菌Thaumarchaeota的生态学特征可能在一定程度上影响TEX86指标所恢复温度的准确性. 例如瑞士深水湖泊Lucerne湖的研究结果显示,虽然浅层水体的TEX86指标呈现明显的季节性变化特征,但却无法有效反映湖水表层温度的变化,相反位于热跃层以下Thaumarchaeota生长较多的深部水体,TEX86所恢复的温度与实测温度接近[39]. 这与Chala湖结果一致,水体TEX86所重建的温度不是指示水体表层的温度,而是反映奇古菌Thaumarchaeota繁盛时期氧跃层的温度[36]. 此外在非洲Malawi湖中发现,水体TEX86所恢复的温度,在表层水体要低于原位实测温度,但在次表层水体则要高于原位实测温度,作者认为造成该现象的原因是生活在不同层位水体的古菌类群及其生态型差异[45]. 虽然目前还没有湖泊方面的研究工作来佐证,但海洋环境方面的证据显示TEX86恢复的温度究竟高于还是低于实测温度,主要取决于水体中占主导奇古菌Thaumarchaeota的生态型,因为氨氧化速率与TEX86之间呈现负相关,浅水层位的奇古菌大多生长在高浓度的铵条件下,所恢复的温度偏低;而深水层位的奇古菌则大多适应低浓度的铵,所恢复的温度偏暖[70-72]. 因此Malawi湖相对较深水体TEX86所恢复的温度较实测值偏高,可能是由于生活在深水层位的奇古菌群落影响isoGDGTs的分布[45]. 此外,在评估水体isoGDGTs响应温度的过程中还需要考虑其他古菌的影响,例如东非深水湖泊坦噶尼喀湖的结果显示,水体TEX86并不能有效指示水体原位实测温度的信息,TEX86值仅在表层水体与实测温度接近,在水体次表层所恢复的温度则要明显高于水体的原位实测温度,据此作者推测可能是与水体isoGDGTs有其他非奇古菌来源的贡献有关[31].
3.2.2 湖泊水体brGDGTs响应温度变化研究 北美Lower King池塘SPM的结果显示, brGDGTs分布不仅有效记录水温的变化,还可以指示温度的季节性变化规律,然而沉积物捕获器中的brGDGTs却无法有效捕捉温度变化的信号,表明水体中的brGDGTs可能无法沉降或保存到沉积物中[41]. 不过在湖水分层时期,沉积物捕获器中的brGDGTs可以反映底层水体的温度,虽然所恢复的温度与实测水温之间并非完全一致,但实测水温与几类brGDGTs化合物之间均存在较好的相关性[41]. 东非Chala湖水体brGDGTs的指标,包括MBT以及DC(degree of cyclization,去对数化的环化指标)能有效指示水温信息,这些指标均与水温之间存在显著的正相关关系,并且在剔除水深较深的样品之后,与水温的相关性得以提高,表明该湖泊水体中合成brGDGTs的细菌可以根据温度来调整自身细胞膜脂组成[37]. 然而需要注意的是,基于brGDGTs恢复的温度与实测气温以及水温之间均存在一定的滞后性,其中滞后于气温约5~6个月,水温则是3个月,这可能是由于湖泊水体brGDGTs与在温度重建时所利用的湖泊沉积物brGDGTs,两者对温度有着不同的响应有关,因为后者的来源要较前者复杂,除湖泊水体自生brGDGTs以外,湖泊周边土壤以及沉积物自身等也会贡献brGDGTs[37],此外这种重建温度与实测温度之间的滞后效应在Lower King池塘中也有报道[41].
另外,研究显示温度也会影响水体brGDGTs新分离的各类异构体的分布. 对中国华北地区公海水体的研究发现,SPM的MBT′5ME和MBT′6ME指标在9月份均随水深呈现降低的趋势,这与实测水体温度的变化模式一致,然而这两个指标在1月份并没有发生变化,也与1月份相对稳定的水温变化模式一致,据此认为该湖泊水体中基于SPM的brGDGTs及其异构体的分布模式有效反映水温的变化[47]. 然而需要注意的是,虽然这两个指标可以有效指示水温的变化,但所恢复的不同月份温差明显低于实测值[47],类似现象在其他湖泊也有发生,例如北美Lower King池塘,基于表层水体SPM恢复的季节性温差为5.4°C,而实际温差则可达到28.3℃[41];华南地区湖光岩基于brGDGTs计算出的季节温差为8℃,而实际季节温差可达16℃[34].
3.3 水深和水体DO浓度因素
研究显示除温度以外,水体DO的浓度也会影响湖泊不同深度水体GDGTs的分布. 例如东非Chala湖水体深部厌氧层位isoGDGTs的浓度要高出上层水体两个数量级,并且不同层位古菌群落组成也存在差异[27],此外水体自生的brGDGTs大多生活在水深35~43 m处、氧浓度较低(O2<2 mg/L)的深部水体,表明在该湖泊水体中合成brGDGTs的细菌偏好低氧浓度的环境[37]. 同样在挪威Indrepollen湖水体中也发现类似规律,isoGDGTs的总浓度随着DO的减少而增加,并在氧跃层底部达到最高值,两者之间呈现非常显著的负相关,结果还显示DO浓度而非温度是影响该湖泊水体TEX86的首要因素[33]. 类似结果也出现在地中海附近的寡营养湖泊,对比结果显示水体上层SPM和沉积物捕获器的TEX86均表现出显著的季节性特征,所恢复的温度与表层水温吻合[49],相较之下位于湖泊深部的缺氧层,TEX86与水体DO浓度之间也存在着明显的负相关,导致湖泊表层沉积物的TEX86信号受水体DO浓度的影响,因此在缺氧环境使用TEX86指标恢复温度时可能会产生误差[49]. 值得注意的是,几株海洋奇古菌Thaumarchaeota的模拟结果可以为上述现象提供生物学基础,研究显示氧气浓度影响奇古菌膜脂中的isoGDGTs组分,特别是当氧气浓度受限时,GDGT-2和GDGT-3浓度增加,而GDGT-1的浓度减少,从而影响TEX86值,导致其所恢复温度的变化[70],因此在利用TEX86指标恢复温度时需考虑DO浓度的影响.
3.4 其他因素
除温度、DO浓度等因素以外,其他因素包括湖水pH值、富营养化程度、降水等也会影响水体中GDGTs的分布. 例如Chala湖,虽然基于brGDGTs的DC以及CBT指标与温度之间的相关性依然最显著,但pH与MBT之间也呈现较高的相关性[37]. 但在该湖泊开展的最新研究显示,不同深度水体brGDGTs与温度、pH以及DO浓度之间的关系并不显著,但却有效响应水体分层以及深部水体的混合,表明在Chala湖,温度可能并不是影响水体中brGDGTs分布的首要因子,水体分层混合效应等所引起的细菌群落变化也会影响水体brGDGTs的分布[38]. 值得注意的是,降水也在一定程度上影响东湖水体中GDGTs的分布,特别是brGDGTs的Ⅰ/Ⅱ比值可以有效指示降水量,较高的Ⅰ/Ⅱ比值意味着湖泊周边土壤中以Ⅰ为主的brGDGTs被冲刷至湖泊,从而覆盖以Ⅱ为主的湖泊沉积物,至于降水对湖泊水体GDGTs分布有如此直接的影响,可能与该湖泊水深较浅,更易受外界水源输入的影响有关[44]. 此外,水深以及富营养化等因素也在一定程度上影响着水体GDGTs的分布,如中国东部火山湖泊不同深度水体中,水深与Ⅲa、Ia之间分别存在着明显的正、负相关的关系,brGDGTs组分的变化可以反映湖泊水体中氧化还原条件的变化,指示水体中DO浓度特征[48],而水体的富营养化以及氧化还原分层等作用在一定程度上推动合成brGDGTs细菌的生长和繁盛等[32].
4 结论
本文主要聚焦微生物膜脂来源的四醚类化合物在湖泊水体中的分布研究,分别介绍来源于古菌的isoGDGTs以及细菌的brGDGTs在湖泊不同深度水体中的分布特征,包括浓度以及各组分相对浓度随水深的变化情况研究,此外还归纳总结湖泊水体中不同类型GDGTs的生物来源问题分析,以及影响湖泊水体GDGTs分布的主要因素等. 虽然相较于在全球尺度上广泛开展的湖泊沉积物研究,湖泊水体GDGTs的研究工作起步尚晚,但前人这10年来对湖泊水体GDGTs的研究表明,GDGTs几乎分布在湖泊水体的所有层位,水深影响水体GDGTs浓度以及各组分的变化,并且不同类型湖泊GDGTs随水深变化的规律并不一致,在大多数湖泊会呈现显著增加或者减少的变化,而在某些湖泊则并没有发生明显的变化,这可能与不同湖泊水体中GDGTs的生物来源以及环境条件(温度、含氧量、营养程度等)的差异有关. 关于水体isoGDGTs的生物来源问题,除了水体中广泛分布的奇古菌Thaumarchaeota、产甲烷古菌Methanogens以外,其他类型的泉古菌如MBG-C和MCG、以及广古菌等也能合成isoGDGTs. 而水体中brGDGTs的生物来源,可能与土壤以及泥炭中的研究结果类似,即大多来源于酸杆菌Acidobacteria的贡献,然而在某些湖泊,水体中酸杆菌Acidobacteria的丰度与brGDGTs浓度之间的关系并不显著,因此酸杆菌可能并不是此类湖泊水体brGDGTs的主要生物来源.
当然,湖泊水体GDGTs研究中也存在着其他亟需解决的问题,例如利用水体GDGTs分布定量重建温度时往往出现滞后的现象,即基于SPM或者沉积物捕获器中GDGTs的分布所恢复的温度,虽然与实测温度吻合,但往往与实测温度之间出现时间上的错位,究竟这种滞后效应是否具有普遍性,以及不同湖泊的滞后时间是否一致,并且如何量化等问题. 此外湖泊水体GDGTs具体生物来源问题,以及不同生物来源GDGTs对温度或者其他环境因素响应问题,还有湖泊周边土壤GDGTs对水体GDGTs贡献率以及湖泊水体GDGTs对湖泊沉积物的贡献率问题等,均需要进一步研究.
致谢:感谢中国科学院地球环境研究所姚远博士在论文撰写过程中提供的帮助.
