淹水条件下鄱阳湖3种湿地植物腐烂分解及其对水质的影响*
2021-09-23马廷婷熊丽黎张大文李宽意胡忠军吴召仕
马廷婷,熊丽黎,张大文,李宽意,胡忠军,吴召仕
(1:上海海洋大学水产科学国家级实验教学示范中心,上海 201306) (2:上海海洋大学上海水产养殖工程技术研究中心,上海 201306) (3:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008) (4:江西省水资源监测中心,南昌 330009) (5:鄱阳湖水文生态监测研究重点实验室,南昌 330009) (6:江西省农业科学院农产品质量安全与标准研究所,南昌 330009)
湿地植物作为湿地生态系统的主要初级生产者,维持着整个生态系统的结构和功能. 在生长发育过程中,湿地植物吸收和富集水体中氮、磷等营养元素,改善水质,调节营养物质平衡,在湿地生态系统中发挥着不可忽视的重要作用[1-2]. 然而,植物经历萌发-生长-衰亡的周期,湿地植物衰亡凋落后腐烂分解,向水环境释放氮、磷等营养物质[3],造成水体的污染. 目前,关于通江湖泊洲滩湿地植被的研究主要集中于群落结构、分布格局及对水位的响应等[4-7],部分研究者开始关注淹水对洲滩湿地的分解过程及其对水环境的影响[2,8].
因此,本研究依据鄱阳湖特殊的水文变化,选取典型洲滩湿地植物灰化薹草(Carexcinerascens)、蒌蒿(Artemisiaselengensis)和虉草(Phalarisarundinacea)为研究对象. 实验前,基于野外调查,确定淹水前植物的实际生物量. 根据自然淹水状态和实验装置确定添加植物的生物量,调节实验水体的营养盐,使其与鄱阳湖水体保持一致. 最后,在中国科学院鄱阳湖湖泊湿地观测研究站湿地附近水域采集与实验装置等体积的浮游植物并加入实验装置中,实验期间固定时间搅拌水体. 本文探究湿地植物茎、叶腐烂分解对水环境及浮游植物生长的影响,以期完善鄱阳湖水质安全预警,并为未来水文形势改变情景下的生态风险评估提供科学依据.
1 材料与方法
1.1 研究区概况
鄱阳湖(28°22′~29°45′N,115°47′~116°45′E)位于长江中游,江西省北部,属于典型的亚热带季风气候. 受鄱阳湖水文节律季节性变化的影响,鄱阳湖湿地表现出典型的水陆相交错变化,丰水期,湿地处于淹水状态,随着水位的降低,处于不同高程的洲滩湿地相继出露,湿地植物开始发育,呈现出河、湖、滩交错的湿地景观格局[8]. 整个洲滩地势较为平缓,分布的主要植物有灰化薹草、蒌蒿、虉草、芦苇(Phragmitesaustralis)和南荻(Triarrhenalutarioriparia)等[2]. 本实验采用室外模拟分解培养法进行,在江西省九江市星子县中国科学院鄱阳湖湖泊湿地观测研究站实验平台完成.
1.2 实验设计
本实验于2019年6月28日-9月5日进行,共持续69 d. 在中国科学院鄱阳湖湖泊湿地观测研究站附近洲滩采集植物的茎和叶,带回实验室. 植物样品先用自来水将表面冲洗干净,再用纯净水冲洗,晾干水分,置于60℃烘箱烘干至恒重(测量3次重量变化小于0.001 g),剪成1 cm长的小段装入分解袋. 根据该洲滩实际淹水状况和实验装置等估算实验添加的植物生物量(每个实验桶内添加490 g湿地植物的茎、叶,400 g装入1个大分解袋(孔径为0.15 mm,规格为20 cm×30 cm);90 g均匀分装在18个小分解袋(孔径为0.15 mm,规格为8 cm×10 cm),即每个小分解袋装5 g确定茎叶比例、混合均匀的植物).
利用112 μm孔径(13#)和64 μm孔径(25#)的浮游生物网分别过滤中国科学院鄱阳湖湖泊湿地观测研究站附近水域水体120 L,将浮游植物装入50 mL小白瓶,重复12次,并统一浮游植物体积. 选用160 L聚乙烯塑料桶作为实验装置,每个桶内加入120 L自来水,调节水体的初始营养盐浓度(TN平均浓度为1.5 mg/L,TP平均浓度为0.05 mg/L,氮源为KNO3,磷源为KH2PO3),保证各个实验组初始水环境保持一致. 将12瓶浮游植物样混合,等体积加入各个实验桶中. 实验共设4个处理,分别为空白组、加灰化薹草组、加蒌蒿组、加虉草组,每个处理3组重复,共计12个处理.
实验期间在每次采样后补充蒸馏水以保证水位恒定. 水体中叶绿素a(Chl.a)浓度能反映浮游植物生物量高低[17],Lamon等[18]对佛罗里达地区165个湖泊的数据进行分析表明,浮游植物生物量与Chl.a浓度之间存在密切关系. 由于易测性等,众多学者以Chl.a浓度开展浮游植物的相关研究. 因此,本研究中采用Chl.a浓度表征浮游植物的生物量.
1.3 水质指标测定
实验期间,水化指标如温度(WT)、pH、溶解氧(DO)、浊度(Tur)每3天测1次,水体TN、总磷(TP)、总溶解氮(TDN)、总溶解磷(TDP)、NH3-N、高锰酸盐指数(CODMn)、Chl.a浓度前1个月每3天测1次,后期每6天测1次. 植物分解袋每6天采集1次.
采样前将桶内水体混匀,用柱状有机玻璃管(直径为10 cm,高度100 cm)采集混合水样,用500 mL经酸浸泡处理的塑料瓶储存水样,带回实验室进行分析. WT、pH、DO浓度使用多参数水质监测仪YSI现场测定. 每次采样时间为18:00-19:00. Tur用1900C型便携式浊度计测定. 参照《水和废水监测分析方法》[19]测定水样的TN、TP、TDN、TDP、NH3-N、CODMn浓度. 用热乙醇法测定Chl.a浓度.
1.4 数据计算与分析
采用Excel 2010、SPSS 19.0软件对数据进行统计分析,用广义线性混合模型的统计方法分析不同处理组整个实验周期的水环境变化. 用Origin 2018软件进行图形绘制.
2 结果与分析
2.1 植物组织分解速率
3种湿地植物的分解过程相似,有明显的阶段性,均呈前期快速分解,后期缓慢分解的趋势(图1). 蒌蒿在第6天分解率为33.61%,第18天分解率达49.97%,第66天分解率达57.82%;灰化薹草和虉草在前6天内快速分解,分解率分别为21.34%和20.22%,第66天分解率分别为32.17%和30.30%. 蒌蒿的分解率显著大于灰化薹草和虉草(P<0.05).
2.2 水质变化
2.2.1 水体WT、pH、Tur的时间变化 本研究中,空白组与实验组WT变化趋势一致(图2A). 植物分解过程中,各实验组水体pH变化相似,均呈先降低后升高再逐渐稳定的趋势. 实验结束后各实验组的pH保持在7.8~9.6之间,表明系统进入相对稳定状态. 灰化薹草组水体pH在第3天降至最低(6.77),第21天上升至最大(9.76). 在第6天蒌蒿组和虉草组水体pH降至最低(分别为5.05和5.27),蒌蒿组在实验结束时达到最大(8.17),虉草组在第33天时上升至最大(9.62)(图2B),蒌蒿组pH显著低于灰化薹草组与虉草组(表1).
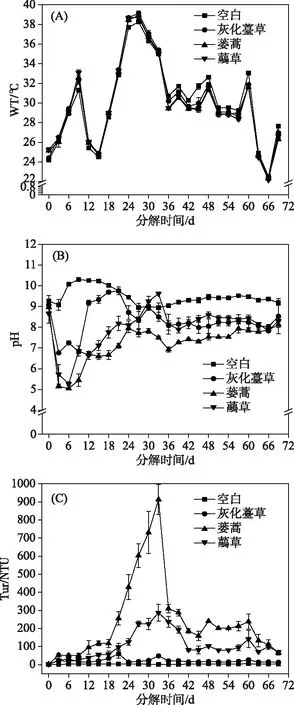
图2 3种湿地植物腐烂分解过程中 水体WT、pH和Tur的时间变化Fig.2 Temporal variation of water temperature, pH and turbidity in water during decomposition of three plants decay
各实验组水体Tur变化均呈先升高后降低再逐渐稳定的趋势. 灰化薹草组水体Tur在植物分解第21天达到最大(60.30 NTU),蒌蒿组和虉草组均在分解第33天达到最大,分别为913和287 NTU(图2C),显著高于空白组(P<0.05)(表1).
2.2.2 水体营养盐和CODMn的时间变化 灰化薹草、蒌蒿和虉草腐烂分解释放大量的营养盐,水体中TN、TP、TDP、CODMn浓度的动态变化均呈先升高后跳跃式降低最后趋于稳定的状态,TDN、NH3-N浓度整体呈先升高后降低,再升高再降低最后趋于稳定的变化. 不同植物实验组间营养盐浓度变化差异显著(表1).
TN方面,灰化薹草组在第21天浓度达到最大(10.16 mg/L),蒌蒿组和虉草组均在第36天达到最大(分别为56.81和26.52 mg/L)(图3A). 各实验组水体TP浓度在第3天迅速升高,在第36天后逐渐下降. 灰化薹草组在第3天达到最大(2.03 mg/L),蒌蒿组和虉草组浓度分别在第30和27天达到最大(分别为11.54和3.67 mg/L)(图3B). 灰化薹草组水体TDN浓度在第27天达到最大(4.40 mg/L),蒌蒿组和虉草组最大浓度分别出现在第36和27天(分别为15.72和5.90 mg/L)(图3C). TDP方面,灰化薹草组和虉草组均在第3天浓度达到最大(分别0.98和2.94 mg/L),蒌蒿组在第9天达到最大(8.30 mg/L)(图3D). 灰化薹草组水体的NH3-N浓度在腐烂分解第27天达到最大(1.82 mg/L). 蒌蒿组水体NH3-N浓度在腐烂分解第9天达到第1个峰值,随后开始下降,在第36天达到第2个峰值(浓度为23.77 mg/L),虉草组在第12天达到最大(3.49 mg/L)(图3E). 灰化薹草组和蒌蒿组CODMn浓度均在第30天达到最大(分别为98.80和285.77 mg/L),虉草组则在第36天达到最大(142.13 mg/L)(图3F). 腐烂分解过程中,蒌蒿组TN、TP、TDN、TDP、NH3-N和CODMn平均浓度最高,虉草组和灰化薹草组次之,空白组最低.
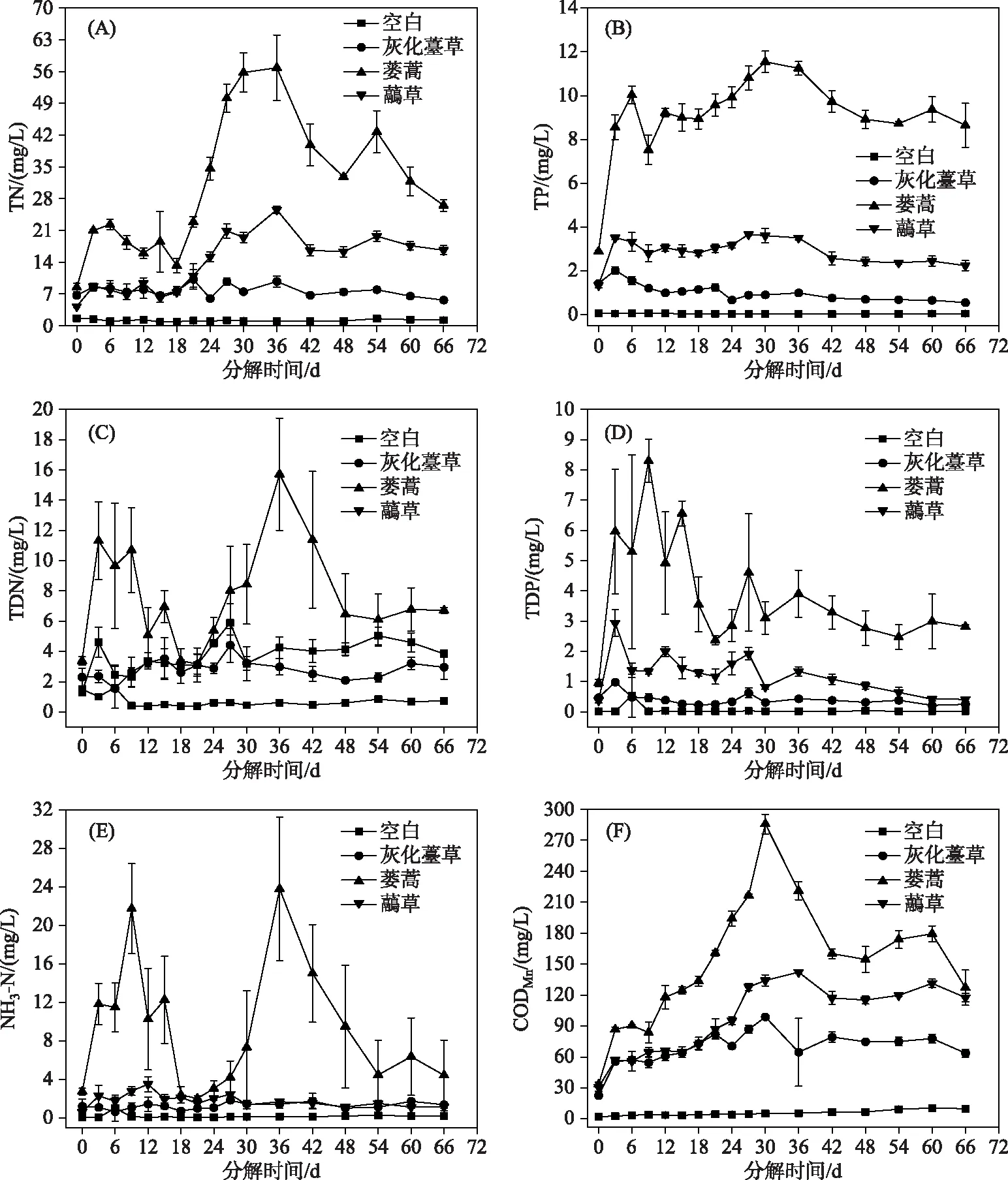
图3 3种湿地植物腐烂分解过程中水体TN、TP、TDN、TDP、NH3-N和CODMn浓度的时间变化Fig.3 Temporal variation of TN, TP, TDN, TDP, NH3-N and CODMn concentrations in water during decomposition of three plants decay
2.2.3 Chl.a浓度的时间变化 灰化薹草组Chl.a浓度呈前期上升、后期逐渐稳定的趋势,第18天出现第1个峰值(287.21 μg/L),第60天出现第2个峰值(292.62 μg/L). 蒌蒿组Chl.a浓度整体呈逐渐上升的趋势,第60天达到最大(2146.19 μg/L). 与灰化薹草组相似,虉草组Chl.a浓度前期上升,后期逐渐稳定,第30天达到最大(829.62 μg/L)(图4). 各实验组间Chl.a浓度存在显著差异,加草组显著高于空白组(P<0.05)(表1).
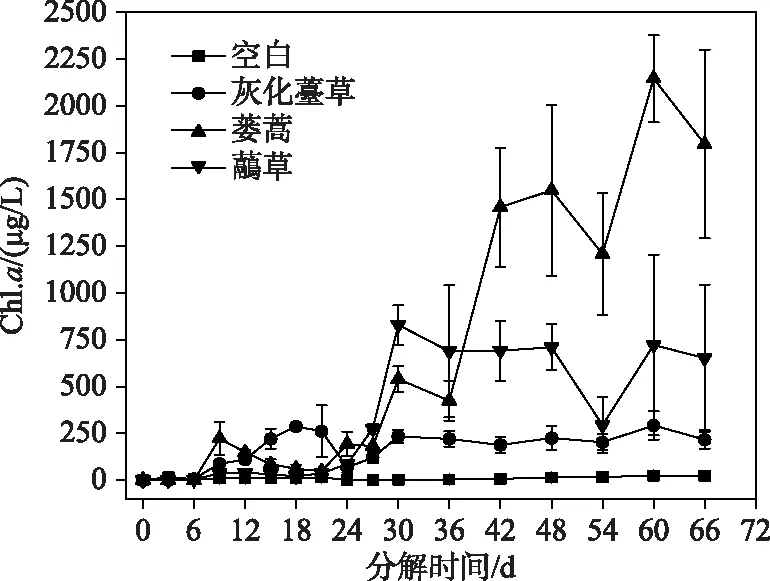
图4 3种湿地植物腐烂分解过程中 Chl.a浓度的时间变化Fig.4 Temporal variation of Chl.a concentration during decomposition of three plants decay
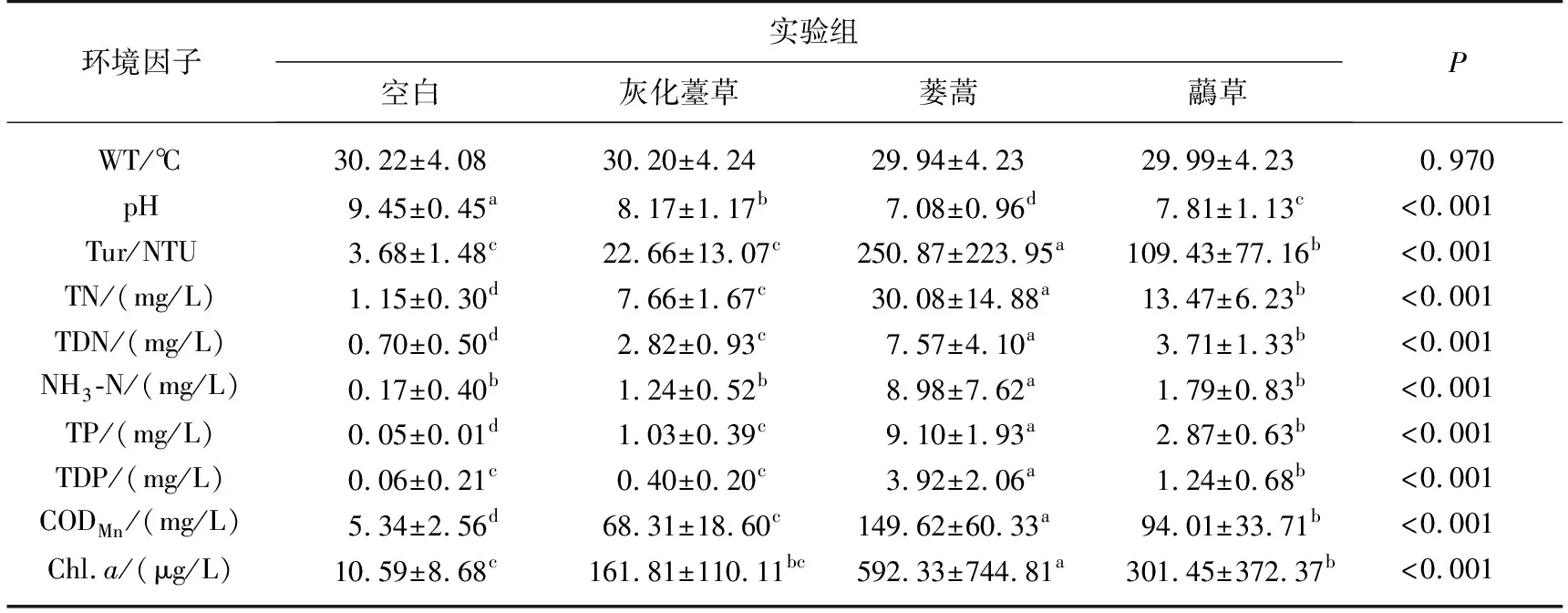
表1 3个试验组与对照组的水环境变化(平均值±标准偏差)*
3 讨论
3.1 植物组织分解速率差异性
植物腐烂分解是一个复杂的生物、物理和化学过程,受多种因素(包括植物自身组成、环境因素和生物因素)综合影响. 湿地植物腐烂分解包括植物组织的水解、矿质成分和可溶性有机物的溶解、各类有机成分的酶解(植物细胞内的酶),以及生物降解、微小颗粒的逸散等[20-21].
本研究通过室外模拟实验发现,3种湿地植物质量在短时间内迅速衰减,之后逐步趋于稳定,说明其分解过程与多数湿地植物一致,均呈前期快速分解、后期缓慢分解两个阶段. 植物残体中营养元素氮(N)、磷(P)、钙(Ca)、镁(Mg)、钾(K)、钠(Na)、硫(S)等的含量以及物质元素之间的计量关系(C∶N、C∶P、木质素∶N、N∶P等)决定着植物残体的可分解性,能够显著影响植物残体的分解特征. N、P含量很高且C∶N、C∶P和N∶P值较低的植物残体,通常具有比较高的分解速率,难分解物质与植物残体的分解速率呈显著的负相关关系,对湿地植物残体的分解具有明显的调控和指示作用,如,木质素∶N比值常常被用作评价植物可分解性和预测分解速率. 与其他
相关研究相比,水环境温度较高时促使植物的分解速率加快,如在探究灰化薹草和虉草腐烂过程中高敏敏等[10]发现,植物在最初30天中分解较快,本研究仅在实验开始第6天分解速率达到较大值. 研究表明,温度的升高会促进真菌活动并提高分解速率[22]. 蒌蒿在实验开始18天内快速分解,灰化薹草和虉草在实验开始6天内快速分解. 高敏敏等[10]研究灰化薹草和虉草活体和自然枯落物(风干处理)的分解差异发现,灰化薹草和虉草活体和自然枯落物在腐烂分解第30天时分解率最大,且活体植物和自然枯落物腐烂分解率变化规律一致,均为腐烂分解前期较快,后期缓慢. 同时,张广帅等[8]在探究鄱阳湖碟形湖泊植物分解规律中发现,灰化薹草(烘干处理)在前30天分解最快,分解变化规律与高敏敏等[10]的研究结果一致,均为前期较快,后期缓慢. 由于烘干植物会改变角质层,植物受微生物的影响更大,增加可溶性化合物的流失[2],从而加快植物的分解. 因此,与其他相关研究相比,本研究中植物腐烂分解速率在前期较快,但整体分解规律与其他保持一致. 这种较快的前期分解主要和前期水溶性物质及易分解的碳水化合物的快速降解有关[10]. 同时有研究表明,植物体内碳氮磷含量、木质素含量和纤维素含量以及相互之间的比值会影响植物的腐烂分解速率[3]. 植物组织初始有机氮浓度和无机盐类含量较高时,分解速率较快[23-24]. 此外,水体中大量的有机物为微生物提供了丰富碳源,微生物的种类和生物量增加,加速了植物腐烂分解[11]. 随着不断的分解,植物所释放的营养物质有限,微生物种类和生物量发生了变化[25],且植物残体中难分解物质和难溶占比增加,植物分解由快变慢[26]. 此外,有研究表明,在植物分解后期,木质素含量对于植物分解速率影响较大[25,27-28],因此木质素等难分解物质不断积累,植物分解受到抑制,导致植物分解速率减慢[28-29]. 研究表明,难分解物质(木质素等)与植物残体的分解速率呈显著的负相关[30]. 3种植物的分解速率具有差异,可能是由于植物种类、耐水淹能力以及植物体内物质形态及含量不同,决定了分解微生物的喜好程度,造成植物腐烂分解的差异[31]. 同时植物分解速率与植物本身有关,如蒌蒿,与灰化薹草相比,其体内通气组织发达,有大量扩裂性通气组织和髓腔,有助于植物在低氧和缺氧环境下对氧气的存储以及运输,因此在相同条件下蒌蒿分解较快,造成了三者之间分解的差异[32-34].
3.2 水环境因子的变化
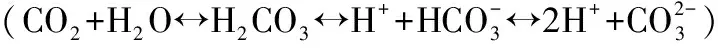
3.2.2 植物腐烂分解对水体营养盐和CODMn浓度的影响 本实验中,水体营养盐和CODMn浓度变化均呈先升高后跳跃式降低最后趋于稳定的状态. 唐金艳等[38]在芦苇、荇菜(Nymphoidespeltatum)和狐尾藻(Myriophyllumverticillatum)等6种水生植物腐烂分解对水质影响的研究中也得出了一致的结论. 植物分解过程中,蒌蒿向水体释放的营养盐和CODMn均显著高于灰化薹草和虉草,可能是由植物自身基质引起的营养盐释放量不同[2,11]. 在分解前期,植物体内可溶性物质中的元素大量流失,氮、磷元素在植物腐烂分解前期损失较大,植物组织中可溶性蛋白质快速损失导致N大量释放[11,39]. 分解后期N含量降低,植物残体及大颗粒有机物的沉降及微生物的硝化和反硝化作用使水体N生成N2、N2O等气体逸出. 湿地植物的腐烂分解会影响磷的生物循环、滞留和释放,使得水体中磷浓度升高. 实验前期,植物腐烂分解释放颗粒磷及有机磷,如以磷酸根离子或化合物的形态存在,引起水体磷浓度升高. 同时植物体可溶性有机物的溶解损失、易分解有机物的分解及颗粒性难分解有机物的散失过程也会影响水体磷浓度[10]. 此外微生物新陈代谢产生的酸与水体中铁、铝、钙、镁等离子结合,使难溶性无机磷被溶解. 后期水体磷浓度降低,可能是由于部分磷元素向底部残体迁移. 此外,微生物能将分解的部分有机磷转化为自身所需要的营养物质,也降低了水体磷浓度. 在高磷营养环境中,部分浮游植物可以大量吸收水体中的磷,以聚磷酸盐的形式储存在体内,以便在低磷浓度时期生长[40-41],造成水体磷浓度下降.
3.2.3 植物腐烂分解对水体Chl.a浓度的影响 浮游植物的生长受到生物因素(如浮游动物和鱼类摄食)和非生物因素(如营养盐、水温、光照等)的综合影响. 本研究采用室外模拟实验,明确了植物腐烂分解对浮游植物生物量的影响及种间差异,各实验组间Chl.a浓度均存在显著差异.
光照和营养盐作为浮游植物生长的基础,其变化能直接影响浮游植物生长[42]. 光为浮游植物进行光合作用提供能量,与热带湖泊相比而言,温带湖泊中光对浮游植物的影响尤其重要,甚至超过了营养盐的作用. 在浑浊的水体中,悬浮物质影响光在水下的传递,从而改变了光谱组成[13]. 营养盐浓度过高会抑制浮游植物的生长[43],当营养盐输入降低时,浮游植物的优势种、生物量会出现一定的响应[44-45]. 植物腐烂分解过程中不仅会释放大量的营养盐,还会产生具有吸光性的溶解性有机物(氨基酸、腐殖酸、脂肪族及芳香烃类物质等),降低水下光照条件,间接影响浮游植物光合作用效率[46-47]. 研究表明,在贫营养但富含有色物质的湖泊中,限制浮游植物初级生产量的因素为光照而非营养盐[48]. 同时,光照和营养盐的交互作用能显著影响浮游植物生物量[49-51]. 本研究中,灰化薹草组和虉草组的Chl.a浓度均呈前期上下波动、中期上升并达到较高水平、后期逐渐稳定的变化趋势. 前期浮游植物变化较小,主要是由于植物腐烂分解导致水体浊度逐渐增大,抑制了浮游植物的生长. 中期浊度和营养盐浓度达到最大后开始下降,此时浮游植物开始大幅度生长. 后期Chl.a浓度逐渐稳定,研究发现化感物质会抑制某些浮游植物的生长[52-53]. 蒌蒿组Chl.a浓度整体呈跳跃式上升的变化,前期变化趋势与其他两组相似,浮游植物生长主要受水体浊度的影响. 中后期水体浊度下降,浮游植物大幅度生长. 实验后期不同实验组Chl.a浓度变化出现差异可能是由植物的物种差异引起的. 综上,不同湿地植物分解造成水体环境因子和浮游植物生长差异较大,后续将深入研究浮游植物群落结构的变化特征,进一步探究浮游植物在植物腐烂过程中的响应.
4 结论
1)鄱阳湖典型湿地植物灰化薹草、蒌蒿和虉草在水淹胁迫下的分解均具有明显的阶段性,在实验前期分解较快,后期分解缓慢. 蒌蒿分解率最大,虉草次之,灰化薹草最小,同时高温环境下加剧植物的分解.
2)腐烂分解过程中,水体理化因子基本均发生了显著变化,如水体pH呈先降低后升高的趋势,且空白组pH显著高于其他实验组. 浊度、营养盐浓度和CODMn浓度均呈先升高后降低并逐渐稳定的变化趋势,蒌蒿腐烂分解对水体pH、浊度、营养盐浓度和CODMn浓度影响最大.
3)灰化薹草组和虉草组Chl.a浓度变化均呈前期波浪式上升、后期逐渐稳定的变化趋势;蒌蒿组Chl.a浓度整体呈逐渐上升的趋势. 水体浊度和营养盐浓度是影响浮游植物生长的主要因素.
本研究是在160 L聚乙烯塑料桶中开展的,虽然在实验过程中模拟自然环境进行了人力搅拌,但是水位及水流变化远不及鄱阳湖自然水体. 同时由于无脊椎动物啃食等压力作用,湿地植物分解速度更快. 此外,本研究中未考虑底泥,与鄱阳湖相比,水-植物-底泥三者进行营养元素的转移、转化过程较少. 因此,进一步实施原位的模拟实验才能更加真实地研究自然分解过程及浮游植物的响应.
