CRISPR-Cas9介导靶向突变拟南芥ERF1-1基因
2021-09-23朱成新王玉婷莫蓓莘
熊 伟,朱成新,王玉婷,郑 媛,刘 琳,莫蓓莘
1) 深圳大学生命与海洋科学学院,广东省植物表观遗传学重点实验室,广东深圳 518071;2)深圳大学龙华生物产业创新研究院,广东深圳 518110;3)深圳大学物理与光电工程学院,光电子器件与系统教育部/广东省重点实验室,广东深圳 518060
当核糖体在信使核糖核酸(messenger ribonucleic acid, mRNA)链上延伸遇到终止密码子(UAA、 UAG或UGA)时,蛋白质翻译过程会在此终止,终止密码子的识别反应需要两类释放因子(release factor, RF)参与:在原核生物中,特异性释放因子为RF1和RF2,非特异性释放因子为RF3;在真核生物中,特异性释放因子RF为真核生物释放因子1(eukaryotic release factor 1, ERF1),其直接与终止密码子作用,非特异性释放因子为ERF3,其既可作为运载蛋白也可促进第1类肽链释放因子的生物活性[1-6]. 翻译终止过程中由ERF1和ERF3共同介导完成,ERF1在核糖体A位点识别终止密码子后与该位点结合,从而终止蛋白质的翻译,ERF3通过水解三磷酸鸟苷(guanosine triphosphate, GTP)的方式来促进此反应[7-8]. ERF1是由3个结构域组成的在空间结构上模拟转运RNA( transport RNA, tRNA)的蛋白因子:结构域1类似于tRNA反密码子的发夹结构,负责高保真终止密码子的识别;结构域2可以刺激核糖体肽基转移酶中心(peptidyl transferase center, PTC)的水解活性并释放新生多肽,该模块包含高度保守的甘氨酸-甘氨酸-谷氨酰胺(glycine-glycine-glutamine, GGQ)模块;结构域3负责连接ERF3[9-12].
ERF1基因在真核生物中高度保守,不同物种之间ERF1蛋白质序列同源性高达50%以上[12-13]. 将来源于非洲爪蟾、人类、兔子和叙利亚仓鼠等物种的ERF1基因异源表达在酵母ERF1基因缺失突变株中,均能恢复酵母正常生长表型,说明不同物种ERF1基因的功能也高度保守[14-17]. 在大多数真核生物中,ERF1基因以单拷贝的形式存在,而在模式植物拟南芥中ERF1基因有高度同源的3个拷贝:ERF1-1、ERF1-2和ERF1-3, 拟南芥中的3个ERF1基因均有表达且都具有生理功能[18]. 有研究报道,在拟南芥中表达ERF1-1基因会触发共抑制(cosuppression),导致ERF1-1、ERF1-2和ERF1-3的表达量均下降,从而产生严重的发育缺陷表型[19]. 研究发现,erf1-2突变体对葡萄糖和植物激素的响应发生变化[20]. 尽管已取得一些研究成果,但是人们对ERF1基因在植物生长发育中的作用仍然了解得很少.
为研究ERF1-1基因的功能,采用CRISPR-Cas9基因编辑技术对拟南芥ERF1-1基因进行了敲除,观察不同突变形式的erf1-1突变体在正常生长条件下的表型.
1 材料和方法
1.1 植株生长条件
本实验所用的拟南芥为野生型Col-0,先后用体积分数为75%的酒精及体积分数为6%的次氯酸钠将种子消毒洗净,均匀播撒在1/2 Murashige和Skoog(MS)固体培养基,置于4 ℃冰箱24 h以打破种子休眠;然后在光照恒温培养箱培养2周,待其长成幼苗,移栽于营养土(V(泥土)∶V(蛭石)∶V(珍珠岩)=3∶3∶1)中,置于植物房培养.恒温培养箱与植物房的培养条件设置相同:22 ℃,光周期为16 h/8 h(光照/黑暗),光照强度为8 000 lx.
采用中国农业大学陈其军课题组开发的胚胎特异性启动子表达CAS9蛋白的CRISPR-Cas9系统[21]对ERF1-1(AT5G47880)进行基因敲除. 首先在http://www.genome.arizona.edu/crispr/CRISPRsearch.html网站系统上根据原间隔序列邻近模块序列(protospacer adjacent motif, PAM)特异性在ERF1-1基因编码区外显子上下游各挑选一个靶点序列设计向导核糖核酸(guide ribonucleic acid, gRNA)序列(图1和表1). 间隔序列为长20核苷酸(nucleotide, nt)的gRNA间隔序列对应的脱氧核糖核酸(deoxyribonucleic acid, DNA)序列,与目的基因的某一段序列互补;PAM序列是CAS9蛋白的切割位点.

图1 ERF1-1 (AT5G47880 )基因结构及gRNA设计位点示意图(ERF1-1基因编码区无内含子)Fig.1 Diagram of the gene structure of ERF1-1 (AT5G47880 ) and the designed gRNA sites (ERF1-1 gene has no intron)
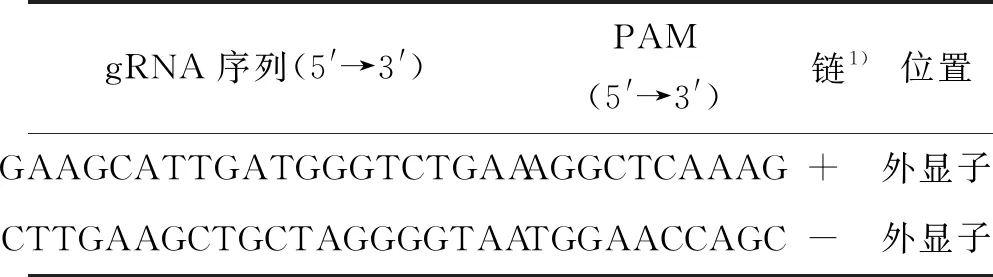
表1 ERF1-1 基因CRISPR-Cas9靶点选择及gRNA序列Table 1 The sequences of gRNA in ERF1-1 gene and the target sites for CRISPR-Cas9
1.3 载体构建
将稀释100倍的pCBC-DT1T2质粒作为聚合酶链式反应(polymerase chain reaction, PCR)模板,以DT1-BsF、DT2-BsR、DT1-F0和T2-R0为扩增引物(表2),获取ERF1-1基因CRISPR-Cas9靶点序列PCR产物.将PCR产物转移到一个干净的1.5 mL离心管,先在37 ℃放置5 h,进行BsaI酶切;酶切产物同时与pHEE401质粒连接,于50 ℃放置5 min;最后于80 ℃放置10 min,使离心管中所有酶失活.将酶连产物转化大肠杆菌DH5α感受态.将筛选到的阳性转化子扩大培养并提取质粒.将重组的pHEE401质粒转化农杆菌GV3101菌株.
1.4 农杆菌侵染拟南芥染花序
将转有pHEE401质粒的农杆菌GV3101在液体Luria-Bertani(LB)培养基(含抗生素利福平、卡那霉素和庆大霉素)中,于28 ℃恒温振荡培养36 h.离心收集培养好的农杆菌,采用菌体重悬液(1 L去离子水+30 g蔗糖+200 μL表面活性剂Silwet77)混匀,然后将拟南芥花序持续浸没其中达3 min后,保鲜膜包裹植株,避光培养2 d,最后放入光照充足的温室(22 ℃)中培养.
1.5 测 序
植物核酸提取方法见参考文献[22-23].本研究所涉及到的测序结果均由广州艾基生物技术有限公司提供,获取的ERF1-1 CRISPR-Cas9靶点序列的PCR产物测序引物为U626-IDF和U629-IDF,各突变株DNA敲除结果的测序验证引物为Sense和ANTI(表2).

表2 引物序列及用途1)
2 结果与分析
2.1 ERF1家族成员蛋白质序列高度保守
在美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)上搜索ERF1基因,发现拟南芥基因组中有3个基因编码ERF1,分别被命名为ERF1-1(AT5G47880)、ERF1-2(AT1G12920)和ERF1-3(AT3G26618).这3个基因表达的蛋白质的氨基酸数量均为435个,序列比对分析结果显示,它们彼此之间高度同源(图2),其中,ERF1-1与ERF1-2蛋白之间氨基酸序列同一性为85.7%,ERF1-1与ERF1-3蛋白之间氨基酸序列同一性为85%,而ERF1-2与ERF1-3蛋白之间氨基酸序列同一性高达94.2%(表3),这些分析结果表明,ERF1家族成员蛋白质序列高度保守,暗示它们在功能上可能会存在冗余性.
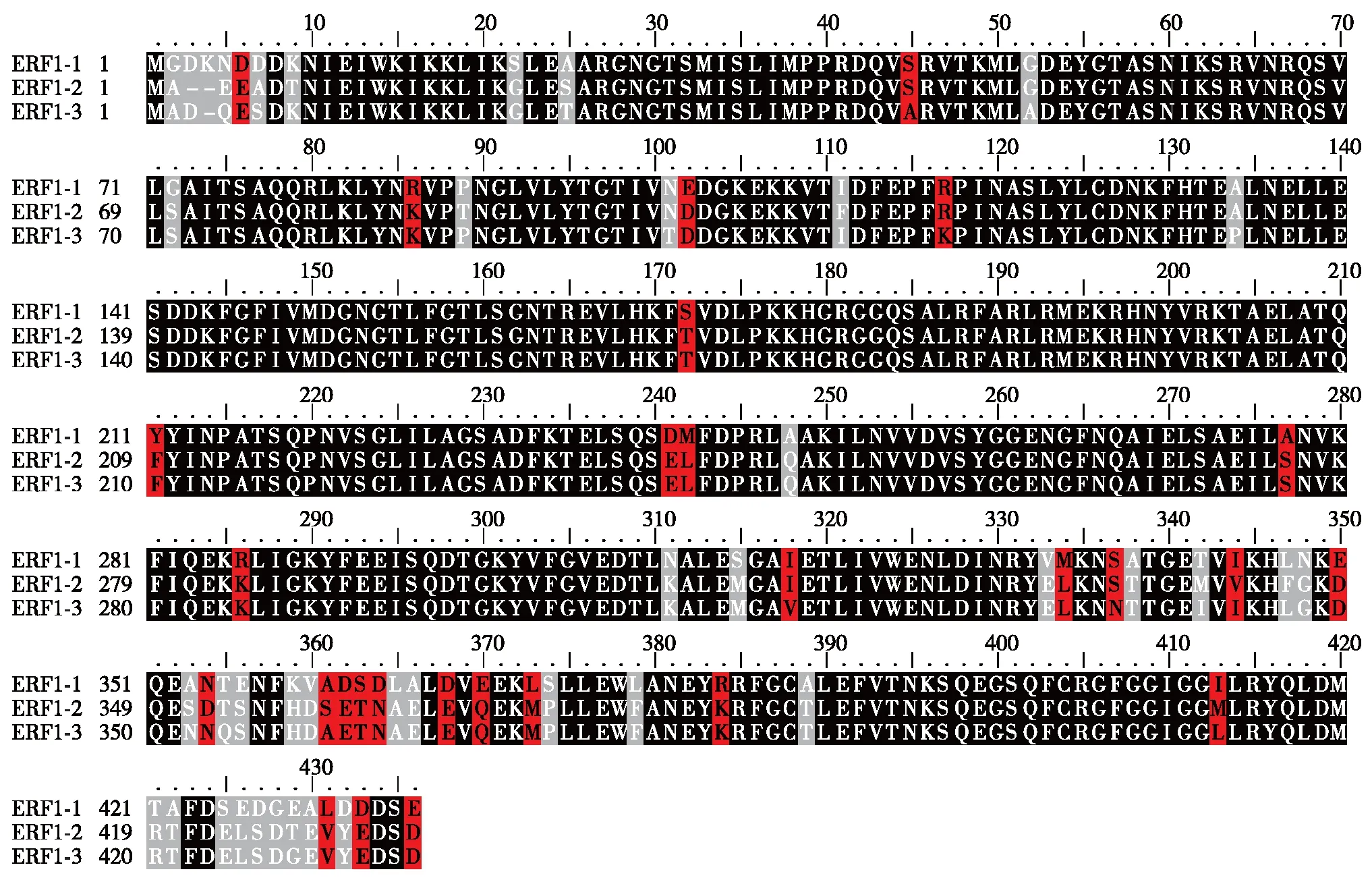
图2 ERF1家族蛋白序列比对Fig.2 Protein sequence alignments of ERF1 family members
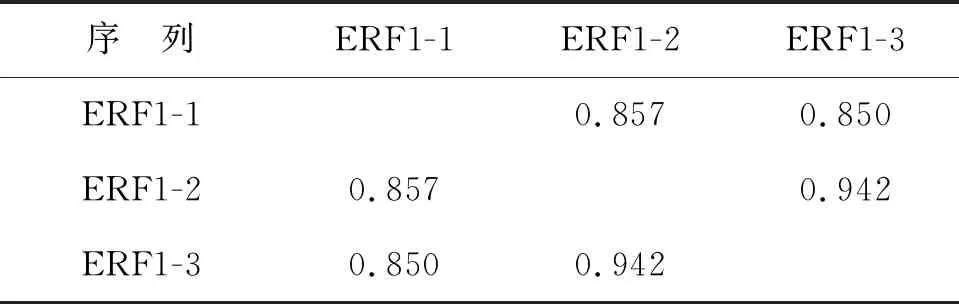
表3 ERF1-1、ERF1-2和ERF1-3蛋白序列之间氨基酸序列同一性统计
2.2 ERF1-1基因CRISPR/Cas9编辑位点分析
通过测序鉴定了ERF1-1基因发生突变的位点.发现获得ERF1-1突变株的突变类型有4种:单碱基插入、单碱基缺失、单碱基替换以及双碱基替换(表4).gRNA1靶向的位点及gRNA2靶向的位点均有编辑发生,遗憾的是本研究并未鉴定到大片段缺失突变株.单碱基插入突变中,gRNA1位点存在两种突变形式,gRNA2也存在两种突变形式;单碱基缺失突变中,仅在gRNA2位点发生碱基G的缺失;单间碱基替换突变中,仅在gRNA1位点发生碱基C替换成碱基G、碱基A替换成碱基G;而双碱基突变中同样是gRNA1位点发生碱基CC替换成碱基GT.根据序列比对结果及测序峰图,以上所列出的突变形式均得到了纯合突变植株.
2.3 erf1-1纯合突变体表型观察
将获得的各种类型的纯合突变体种植在1/2 MS固体培养基上,然后在22 ℃光照恒温培养箱(光周期为16 h/8 h(光照/黑暗),光照强度为8 000 lx)培养以观察表型.如图3,培养到第11天的erf1-1纯合突变体与野生型相比仅有微弱的表型差异——植株稍大,莲座叶叶片轻微上翘,erf1-1纯合突变体成苗株高与野生型相比差别不大.所有的单碱基插入或缺失突变体均观察到同样的表型,说明观察的微弱的生长发育缺陷表型缺失确实是由于ERF1-1突变导致的.
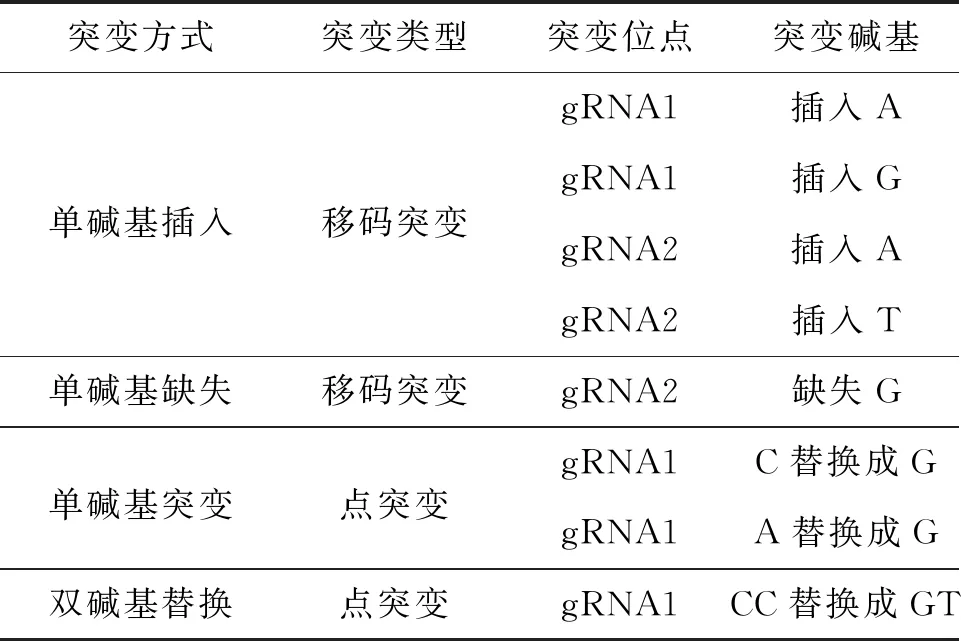
表4 ERF1-1基因编辑位点统计

图3 erf1-1纯合突变体第11天表型Fig.3 Phenotypes of 11-day old plants of erf1-1 mutants homozygous
3 讨 论
翻译终止是蛋白质在核糖体中合成中重要的一环,而释放因子EF则是翻译终止过程中新生肽链释放过程中的关键因素.目前,对于酵母和人类来源ERF1蛋白的研究比较多,且在酵母中ERF1翻译终止作用已被证实,而在植物中对ERF1蛋白的功能研究有限[24]. 在拟南芥中使用35S启动子去表达ERF1-1基因时会引发共抑制,导致ERF1基因家族的3个成员表达量都下降.ERF1家族基因发生共抑制会严重影响植株的表型,例如导致花序成扫帚状,节间伸长减少等[24].
在ABRC拟南芥生物资源保藏中心,ERF1家族中ERF1-2和ERF1-3均可直接获得T-DNA插入突变体,而ERF1-1则没有相应资源.为进一步探究拟南芥ERF1-1基因的功能,本研究利用CRISPR-Cas9系统对拟南芥的ERF1-1基因进行高效率的编辑,共得到ERF1-1基因的8种不同编辑形式(表3),其中,4种为单碱基插入,1种为单碱基缺失,3种为碱基替换.单碱基插入或缺失均会导致读码框移码,造成无意突变,即对ERF1-1基因形成了有效敲除.
在正常生长条件下,erf1-1突变植株并没有显著生长发育缺陷表型,形态与野生型相差不大,只是植株稍微比野生型大且叶片边缘轻微往上翘.推测ERF1-1、ERF1-2和ERF1-3功能冗余,在erf1-1突变植株中ERF1-2和ERF1-3基因继续发挥功能,ERF1基因家族的功能受影响较小,因此,erf1-1单突变表型并不明显.
结 语
mRNA翻译成蛋白质翻译结束步骤中,新生多肽链的释放需要释放因子ERF1的参与.本研究采用CRISPR-Cas9基因编辑技术靶向突变了模式植物拟南芥中ERF1基因家族中的ERF1-1基因,获得了众多不同突变位点的erf1-1突变植株,这些突变体植株在正常生长条件下只有轻微生长发育缺陷表型,据此结果推测,ERF1基因家族成员之间可能功能冗余.erf1-1单基因突变是否会对各种不同的生物胁迫和非生物胁迫有响应则需要设计实验进一步验证.本研究所获得的erf1-1单基因突变体材料将为探究其生物学功能提供重要遗传学基础.
