肝癌行腹腔镜超声引导微波消融后肝功能不全的危险因素分析
2021-09-23金一帮潘江华童晓春胡逸人徐智锋李幼林
金一帮,陈 璐,潘江华,童晓春,胡逸人,徐智锋,李幼林
(温州市人民医院普通外科,浙江 温州,325000)
微波消融自上世纪90年代Seki首次报道用于治疗肝癌并取得成功以来[1],逐渐被证明具有疗效确切、损伤小、安全性高、康复快、重复性好等优点,已被临床广泛接受。肝损伤是微波消融治疗过程中必然伴随的,术后肝功能不全作为其常见并发症,已逐渐引起重视。本研究回顾分析本院近4年接受腹腔镜超声引导微波消融治疗的146例原发性肝癌患者的临床资料,探讨影响术后肝功能不全的危险因素。
1 资料与方法
1.1 临床资料 回顾分析2016年1月至2019年12月因确诊原发性肝癌在本院行腹腔镜超声引导下微波消融治疗的146例患者的临床资料,其中男112例,女34例,平均(61±11)岁;其中首诊95例,肝癌切除术后或微波消融术后复发51例,共276个病灶。均依据病史、甲胎蛋白、影像学检查及病理报告等证实为原发性肝癌或治疗后复发,其中病理确诊28例,临床诊断118例;均无大血管浸润,无淋巴结或肝外转移;术前肝功能分级Child-Pugh A级126例,Child-Pugh B级20例;肿瘤直径0.5~5 cm,病灶数量均≤4枚。
1.2 仪器及方法 采用彩色多普勒超声设备,术中腹腔镜超声,末端可屈曲。MTC-3C型微波凝固治疗仪,微波频率(2 450±50)Hz,功率0~100 W。治疗方法:患者取仰卧位,采用全身麻醉,建立人工气腹。腹腔镜直视下用腹腔镜超声再次扫描肝脏,根据肿瘤位置、大小、数量等确定腹腔镜微波消融治疗方案。超声刀游离肝脏,通过超声探头引导,腹壁插入微波消融针,针芯超过肿瘤中心,功率设置在80~100 W,根据实际情况设置4~10 min的消融时间进行微波消融治疗,并在腹腔镜直视下察看是否发生异常。通过术中B超动态实时监测,治疗过程中消融处回声逐渐增强并覆盖肿瘤,保证消融范围达到肿瘤周边1.0 cm的肝脏组织,达到标准后将针退出适当位置并进行再次消融,直至肿瘤完全消融,拔出针尖前对针道进行适当消融,以预防针道种植及出血。治疗后1周内行腹部MRI平扫及增强检查,判断肿瘤灭活情况[2],必要时再次行微波消融治疗,以确保病灶完全灭活。
1.3 观察指标 包括患者一般情况:性别、年龄、乙肝病史、复发、肝硬化情况;术前情况:白细胞、血红蛋白、血小板、甲胎蛋白、谷丙转氨酶、谷草转氨酶、总胆红素、白蛋白、凝血酶原时间、国际标准化比值、吲哚菁绿15 min潴留率(indocyanine green retention rate at 15 min,ICGR15)、肝功能Child-Pugh分级等;手术情况:手术时间、术中出血量、消融病灶数、肿瘤位置(存在肿瘤位置毗邻肝内较大血管或胆管距离≤1 cm为相对危险位置,否则为相对安全位置)、肿瘤最大直径等。
1.4 术后肝功能不全的判定标准 术后定期复查相关指标,根据总胆红素、白蛋白、凝血酶原时间、腹水情况及有无肝性脑病进行肝功能分级,与术前相比出现Child-Pugh分级降低者为肝功能不全组,否则为肝功能代偿良好组。
1.5 统计学处理 采用SPSS 17.0软件进行数据分析,单因素分析采用t检验或χ2检验,多因素分析采用非条件Logistic回归分析,P<0.05为差异有统计学意义。
2 结 果
2.1 术后恢复情况及转归 患者接受治疗后均顺利出院,146例肝癌患者经治疗后,110例术后肝功能恢复良好,36例于术后2周内出现肝功能分级降低,经积极治疗后,30例肝功能恢复良好,6例肝功能难以恢复至术前水平,未出现与治疗直接相关的肝功能衰竭病例。
2.2 两组间各观察指标的比较 两组患者性别、年龄、乙肝病史、复发情况、术前白细胞、血红蛋白、血小板、甲胎蛋白、谷丙转氨酶、谷草转氨酶、凝血酶原时间、国际化标准比值、肝功能分级及手术时间、术中出血量、肿瘤最大直径等差异无统计学意义(P>0.05),肝硬化、术前总胆红素、白蛋白、ICGR15及肿瘤位置差异有统计学意义(P<0.05),见表1。
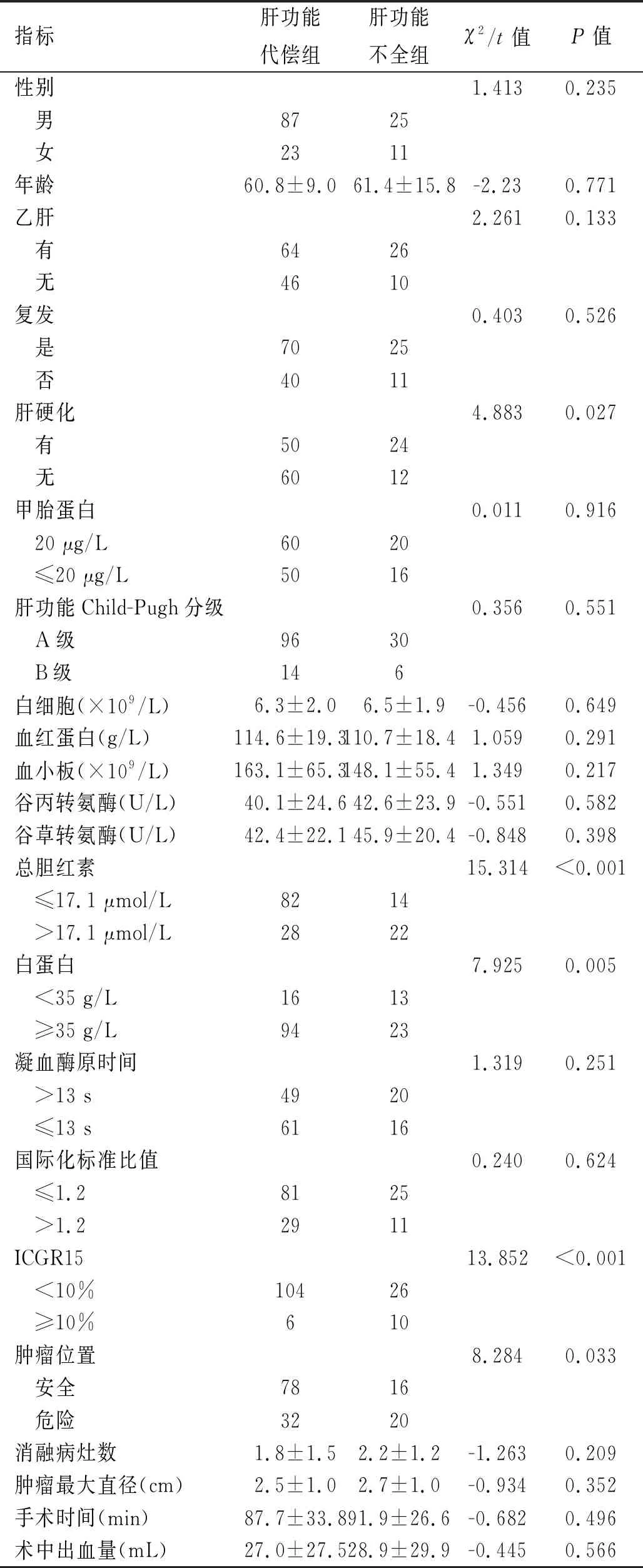
表1 影响治疗后发生肝功能不全的单因素分析
2.3 影响肝功能不全的多因素分析 多因素Logistic回归分析结果显示,总胆红素>17.1 μmol/L、白蛋白<35 g/L、ICGR15≥10%、肿瘤位置危险是肝癌行腹腔镜超声引导微波消融治疗后肝功能不全的独立危险因素,见表2。
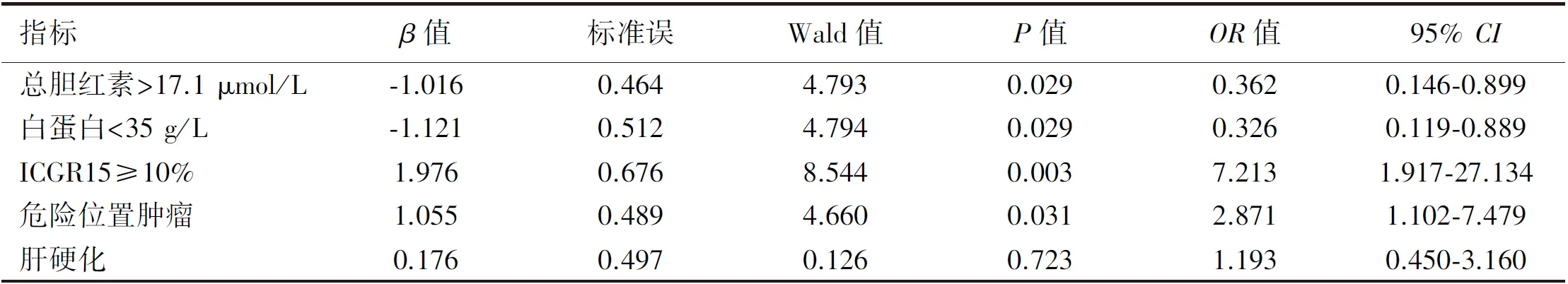
表2 影响治疗后发生肝功能不全的多因素Logistic回归分析
3 讨 论
原发性肝癌是临床常见的恶性肿瘤,据统计,我国每年因肝癌死亡的人数已达30万人[3-4]。随着近年医疗技术的发展,原发性肝癌的非手术治疗取得较好疗效,其中微波消融在治疗肝癌方面疗效确切,已逐渐成为治疗肝癌成熟可靠的新手段,其原理是利用微波的热量效应,将天线植入到肿瘤内部并产生 60~100℃高温,使肿瘤细胞发生不可逆的蛋白质凝固、变性及坏死,坏死后的肿瘤细胞进一步导致周围血管栓塞,并抑制肿瘤的扩散与转移,从而达到治疗目的[5],与传统肝切除术相比,具有适应证广、创伤小、康复快、可重复治疗等优点;在疗效方面,尤其直径≤3 cm的肝癌具有较高的完全消融率、较低的肿瘤局部进展率,通过远期随访观察,其疗效可与外科手术相媲美[6]。针对一些无法手术根治的中晚期肝癌,选用微波消融行根治性或姑息性治疗均取得一定疗效。由于原发性肝癌的特点,临床上确诊的病例往往存在不同程度的肝功能不全甚至肝功能衰竭,这使得部分无法耐受手术切除的病例从而选择微波消融等非手术方式治疗。与手术切除相比,微波消融治疗肝癌会对包括肿瘤及其周边1 cm的正常肝组织进行彻底消融灭活,能最大程度地保留肝组织,因而对肝功能影响更小[6]。本研究中虽未出现因肝功能衰竭死亡的病例,但术后肝功能不全的发生率达24.7%(36/146)。因此,进行准确的术前评估对于降低术后肝功能不全发生率、提高疗效具有重要意义。
肝脏储备功能可反映肝脏对于机体内外环境紊乱(如手术等)的耐受程度,被认为是影响术后肝功能恢复的主要因素,其评估方法多样,并不存在统一标准。用于评估肝脏储备功能的血生化指标较多,通过检测静脉血中肝脏合成的蛋白、酶、胆红素等水平获得,可一定程度上反映肝细胞的损害程度及肝脏储备功能;吲哚菁绿排泄试验是利用其只经肝脏排泄的特点,通过定时检测体内的吲哚菁绿浓度评估肝脏储备功能的定量试验[7]。研究表明,其能比较准确地反应肝脏实际储备功能,可一定程度上预测外科手术后肝功能不全的发生[8],已被列为常用的术前检验项目。此外,是否存在乙肝、肝硬化等情况也可能对肝脏储备功能有一定影响。通过单因素分析显示,肝脏储备功能的相关指标中,肝硬化是微波消融治疗后出现肝功能不全的危险因素,总胆红素>17.1 μmol/L(OR=0.362)、白蛋白<35 g/L(OR=0.326)、ICGR15≥10%(OR=7.213)等是独立危险因素(P<0.05)。提示总胆红素、白蛋白、ICGR15等在一定程度上反应了肝脏储备功能的真实状态,结合其进行术前风险评估,有助于提高术后发生肝功能不全预测的准确性。
除肝脏储备功能外,手术创伤也是术后肝功能恢复的重要因素。微波消融治疗肝癌的整个操作过程伴随着肝细胞及肝内血管、胆管的直接破坏,同时伴随热能传导,这是导致患者术后肝功能损害的直接原因,且具有一定的毒副作用,对术后肝脏代谢亦有一定程度的影响。本研究结果显示,微波消融在治疗肿瘤直径≤5 cm的肝癌中,肿瘤大小、肿瘤数量、术中出血量、手术时间等因素与治疗后出现肝功能不全无相关性,而存在危险位置肿瘤(OR=2.871)是微波消融治疗后出现肝功能不全的独立危险因素(P<0.05);提示微波消融本身对肝功能的直接影响相对有限,是较为安全的治疗手段[9],而一些相对危险位置的肝癌经微波消融治疗后出现术后肝功能恢复不良的风险更大。原因可能是邻近消融区域的肝内血管、胆管的副损伤更容易导致局部范围的淤血、缺血、淤胆等情况,术前风险评估应结合肿瘤病灶部位进行评判,邻近大血管、胆管的肿瘤需考虑相应风险。为减少此种情况发生,笔者体会:(1)消融范围是以消融针头为中心的椭圆形区域,为保持消融范围的可控性,应调整进针方向并尽量保持针尖指向肝内血管或胆管,术中B超实时监测,必要时及时调整进针深度;(2)消融的作用范围与消融功率、时间关系密切,因血管、胆管对高温的耐受不同,消融功率、时间应根据情况进行必要调整;(3)消融治疗本身可重复性强,可分次进行治疗,提高了安全性,亦可与其他治疗方式如肝动脉化疗栓塞等联合应用,治疗效果更佳[10]。
综上所述,术前总胆红素高、低蛋白血症、ICGR15升高及存在危险位置肿瘤是原发性肝癌行腹腔镜超声引导微波消融治疗后肝功能不全的独立危险因素,临床上重点结合以上指标进行风险评估,有助于提高预测术后发生肝功能不全的准确性,这对临床上采取积极干预措施、改善预后均具有较好的指导意义。
