腹腔镜保留肝右静脉Ⅷ背侧段属支的原位扩大肝右后叶切除术
2021-09-23郑志鹏陈雪芳彭建新刁竞芳何军明
郑志鹏,陈雪芳,叶 青,彭建新,刁竞芳,何军明
(广州中医药大学第二附属医院,广东省中医院肝胆外科,广东 广州,510120)
随着腔镜器械的发展、外科技术的成熟,国内外腹腔镜肝切除的技术日益成熟,大范围的左右半肝切除术的报道逐渐增多。但由于肝右后叶位于肝脏膈面深部,术野暴露、出血控制、切面的把握与肝右静脉(right hepatic vein,RHV)的解剖等存在一定困难,腹腔镜下右后叶切除术仍在探索中[1]。2019年1月至2020年10月我院施行腹腔镜下保留Ⅷ背侧段属支(V8d)联合RHV切除的原位扩大右后叶肝切除术10例,临床疗效良好。现将体会报道如下。
1 资料与方法
1.1 临床资料 本组10例患者中男8例,女2例;40~58岁,平均(51.4±6.1)岁。10例术前诊断原发性肝癌,肿瘤数量1~2枚,平均(1.2±0.4)枚,直径3~6 cm,平均(4.1±0.9)cm,肿瘤均位于右后叶。术前1周谷丙转氨酶(46.6±25.5)U/L,凝血酶原活动度(66.5±14.9)%,总胆红素(16.1±8.2)μmol/L,白蛋白(41.4±7.1)g/L。患者术前均无腹水,肝功能为Child-Pugh A级,7例合并轻-中度肝硬化。术前CT均使用EDDA软件进行三维重建,三维重建显示10例均存在V8d,且均汇入RHV,汇入处距下腔静脉(1.4±0.3)cm,肿瘤与RHV最小距离(0.5±0.2)cm。
1.2 手术方法 全身麻醉,患者取人字位,右腰垫高,头高脚低30°、左侧卧位25°。平脐右缘2 cm处做小切口穿刺气腹针,建立CO2气腹,压力维持在12~15 mmHg,右锁骨中线肋缘下3 cm处做12 mm主操作孔,右腋后线第10肋间隙处做5 mm副操作孔,分别于正中线剑突下2 cm、脐上1 cm处做12 mm、5 mm辅助操作孔。术中B超定位右肝肿瘤边界,了解有无肝内转移,定位RHV主干。离断肝圆韧带、镰状韧带至下腔静脉陷窝,切开肝胃韧带,经文氏孔留置自制手套边预置Pringle阻断带,切除胆囊。Rouviere沟根部切开肝实质,显露右后叶肝蒂上缘,切开尾状叶腔静脉旁部显露右后叶肝蒂下缘,用金手指经上述两处切开的肝实质贯穿解剖出右后叶肝蒂并带线结扎,于肝表面画出右后叶肝缺血线。将肝脏面向上翻起,切开肝肾韧带,向上解剖将右侧肾上腺与肝裸区游离,完全显露肝后下腔静脉旁间隙;将尾状突及腔静脉旁部向上翻起,自下向上逐支离断肝短静脉,至显露RHV根部。Pringle法间断阻断第一肝门(15’+5’模式,即阻断15 min,间歇5 min),采用控制性低中心静脉压技术,经尾侧入路使用超声刀切开肝实质,第一肝门游离出右后叶肝蒂用直线切割闭合器切断,肝实质内解剖出RHV属支,沿属支向上追踪主干,于其腹侧完全游离RHV。于RHV根部解剖出V8d,远端用直线切割闭合器切断RHV。切断右后叶肝周韧带。去除阻断带,冲洗肝脏创面,严密止血,常规放置腹腔引流管1~2根,将切除组织置入标本袋,经耻骨上横切口取出。见图1。
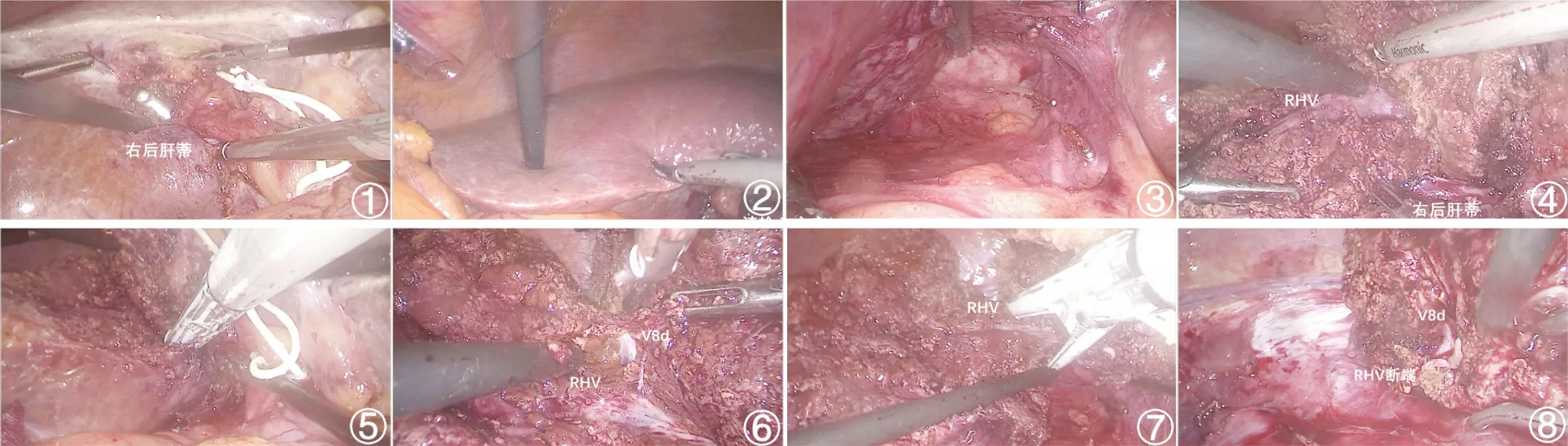
图1 手术过程(①用金手指解剖出右后叶肝蒂;②显示右后叶缺血线;③游离肝后下腔前间隙、旁间隙;④RHV腹侧入路;⑤离断右后叶肝蒂;⑥显示V8d、RHV;⑦于V8d远端切断RHV;⑧切除后断面)
2 结 果
10例腹腔镜右后叶肝切除术均获成功,无一例中转开腹。手术时间150~240 min,平均(198.0±30.8)min;术中出血量100~700 mL,平均(345.0±216.6)mL,无输血病例。术后无一例出现大出血、肝功能衰竭、胆漏、感染、死亡等严重并发症。术后第1天转氨酶(204.3±67.4)U/L,凝血酶原活动度(56.3±9.1)%,总胆红素(27.2±3.7)μmol/L,白蛋白(33.8±3.0)g/L,腹腔引流量(200.0±149.4)mL。患者均于术后24 h后下地活动,24 h内进食流质,术后住院7~14 d,平均(9.5±2.2)d。术后病理均为肝细胞癌,切缘均为阴性。患者出院后1个月来院复查,此后间隔3个月复查,随访至2020年10月。随访2~21个月,平均(10.0±6.3)个月,均未见复发。
3 讨 论
由于肝右后叶位置深在,邻近下腔静脉,右后叶肝蒂及RHV的解剖复杂,无体表标记,切面大,术中暴露与出血控制难度大[2-3],腹腔镜下肝右后叶切除仍被认为是困难肝切除术之一[4],因此有必要探索安全、有效、流程简化的手术方式。本中心在前期积累了丰富的开腹与腹腔镜肝切除术经验的前提下,采用腹腔镜下保留V8d联合RHV切除的原位扩大右后叶切除术,探索了简单、可行的手术入路与技巧。本组10例患者临床疗效良好。
右后叶由于解剖位置深在,体积较大,暴露困难,常规入路对肝脏翻转幅度较大,容易对肿瘤造成挤压;采用原位切除的方法可避免对肿瘤的翻转、挤压,更符合肿瘤切除的“不接触”原则[5-6]。原位切除要求充分暴露肝后下腔静脉前间隙与旁间隙,先行离断回流右后叶的肝短静脉,贯通肝后隧道,将下腔静脉前壁作为离断肝实质时的路标,避免肝切面偏移。
传统保留RHV全长的肝右后叶切除术适于肿瘤较小、位置较边缘的右后叶肿瘤;肿瘤体积较大或肿瘤毗邻RHV、右后叶肝蒂时,可能无法获得满意切缘,甚至切除过程中可能进入肿瘤,导致肿瘤破碎,影响肿瘤学预后。合并RHV的扩大肝右后叶切除术,以RHV腹侧为解剖标志,避免切入肿瘤,可获得相对宽的切缘,可能利于提高远期生存率[7]。
右后叶Glisson鞘解剖变异较多,Ⅵ、Ⅶ段肝蒂的汇合形态多变,非共干的比例高[8]。采用鞘外法右后叶肝蒂一并处理,方法简单可行,阻断了Glisson鞘内的侧支循环,阻断效果更佳。操作技巧是先在Rouviere沟解剖出右后叶肝蒂上缘,然后切开尾状叶腔静脉旁部,显露右后叶肝蒂下缘,将两者连线在鞘外间隙用金手指沟通,这样可将Ⅵ、Ⅶ段及尾状突的肝蒂均包括在内一并处理。操作过程中可能有少许渗血,在Pringle法阻断下操作可减少渗血,右后叶肝蒂结扎后渗血多可自行停止。
肝右后叶切面较大,难以把握,肝切除过程中容易出现切面偏移及管道的误损伤,我们的经验是应以“三线一面”作为肝切除平面,即浅层为右前-右后之间的缺血线,中层为RHV腹侧,深层为下腔静脉前壁。由于尾状突的存在使得上述平面不规整,我们的经验是常规切除右侧尾状突,显露下腔静脉作为与深层的解剖标志,而且尾状突体积较小,切除对肝功能影响不大。RHV的背侧有多支Ⅵ、Ⅶ段的属支汇入,而腹侧属支较少,存在相对无血管平面[9]。传统保留RHV全长的肝右后叶切除需逐支离断RHV背侧的属支,操作复杂且静脉损伤风险高;我们通过在RHV腹侧相对无血管区操作,可减少出血量及肝静脉破裂、气栓的风险,缩短手术时间。
切除RHV是否影响肝右前叶血液回流仍存在争议。陈亚进等[9]认为,切除RHV不影响右前叶的静脉回流,肝右前区完全可通过肝中静脉的右侧分支回流。肝右前叶的背侧段由Ⅷ背侧段、Ⅴ段背侧段组成,Ⅷ背侧段所占体积比例大,而且V段主要汇入肝中静脉[10-11],因此,只要保留了V8d的完整,肝右前叶背侧段的静脉回流就不会受到影响。谢于等[11]的研究发现,90%的病例V8d回流至RHV,其余回流至肝中静脉。通过影像资料明确V8d的回流类型,规划手术方案:如果V8d回流至肝中静脉,于根部切断RHV不会影响肝右前叶的回流;如果V8d回流至RHV,保留V8d,在其远处切断RHV即可保证肝右前叶的回流,术后对肝功能的影响不大,不会出现肝功能不全、肝坏死。
出血的控制是手术成功的关键。通过采用15′+5′模式的Pringle法,较区域血流阻断法可减少肝实质侧支循环的出血,显著减少肝切除过程中的出血,术后对肝功能的影响也较小[12]。手术团队应与麻醉医生沟通配合,通过控制液体输入、使用血管活性药物等方法维持低中心静脉压,减少肝静脉倒流出血[13]。切肝器械的灵活应用可减少术中出血量,缩短手术时间[14]。我们常规使用超声刀作为断肝器械,实质浅层操作时工作臂应处电凝状态由浅入深插入,再逐步加压闭合超声刀头可有效凝闭直径3 mm内的血管,在血管表面操作时手法应轻柔,用非工作臂小口钳夹破碎,避免大口用力钳夹,以免导致血管撕裂。创面使用双极电凝、氩气刀止血,效果很好。
腹腔镜下右后叶切除术是高难度的复杂手术,通过手术入路与流程的优化,我们认为腹腔镜下保留V8d联合RHV切除的原位肝右后叶切除术是安全、可行的。
