腹腔镜困难胆囊切除术的手术策略分析
2021-09-23王毅,刘杰
王 毅,刘 杰
(桂林市人民医院肝胆胰外科,广西 桂林,541002)
腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)现已成为胆囊良性疾病手术治疗的金标准[1],随着手术器械的不断更新及术者手术技能的不断提高,既往认为的腹腔镜手术相对禁忌证,如上腹部手术史[2]、急性期胆囊炎[3]、Mirizzi综合征[4]等,现已不再是LC的禁忌证。困难胆囊切除无统一定义,一般包括急性期胆囊炎、萎缩性胆囊炎、Mirizzi综合征、有上腹部手术史、冰冻样胆囊三角等[5]。行腹腔镜困难胆囊切除术时,手术难度、手术并发症发生风险均会增加。本文回顾分析2016年1月至2020年4月我院实施的124例腹腔镜困难胆囊切除术,以总结腹腔镜困难胆囊切除术的治疗经验。
1 资料与方法
1.1 临床资料 收集2016年1月至2020年4月我院施行的124例腹腔镜下困难胆囊切除术的临床资料,术前均完善肝功能、腹部B超及腹部CT检查,如有胆源性胰腺炎、胆红素升高或B超、CT提示胆总管扩张>8 mm时,则行磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)检查,进一步明确有无胆总管结石。入选标准,根据术前病史、实验室检查及影像学资料诊断为:(1)急性期胆囊炎(图1),腹部B超提示胆囊壁≥5 mm;(2)萎缩性胆囊炎(图2),腹部B超提示胆囊萎缩,包括胆囊充满型结石;(3)Mirizzi综合征(图3),术前CT或MRCP提示存在Mirizzi综合征可能;(4)有上腹部手术史(图4);(5)有反复急性炎症的慢性胆囊炎(图5),术中胆囊三角呈冰冻样,包括胆源性胰腺炎治疗后的病例。病程8 h~30年,术前诊断均为结石性胆囊炎,无胆囊癌病例,其中男46例(37.1%),女78例(62.9%),24~86岁,平均(49.3±15.1)岁。急性胆囊炎66例(53.2%),萎缩性胆囊炎22例(17.7%),Mirizzi综合征3例(2.4%),有上腹部手术史10例(8.1%),有反复急性炎症的慢性胆囊炎23例(18.5%),6例合并门静脉高压症。3例急性胆囊炎、1例萎缩性胆囊炎、1例有反复急性炎症的慢性胆囊炎合并上腹部手术史。5例急性胆囊炎患者术前合并胆总管结石,结石自行排出胆总管后经MRCP确认胆总管内无结石或经过内镜逆行胰胆管造影取石、2例急性胆囊炎、4例有急性炎症的慢性胆囊炎患者合并胆源性胰腺炎,胰腺炎控制后施术。
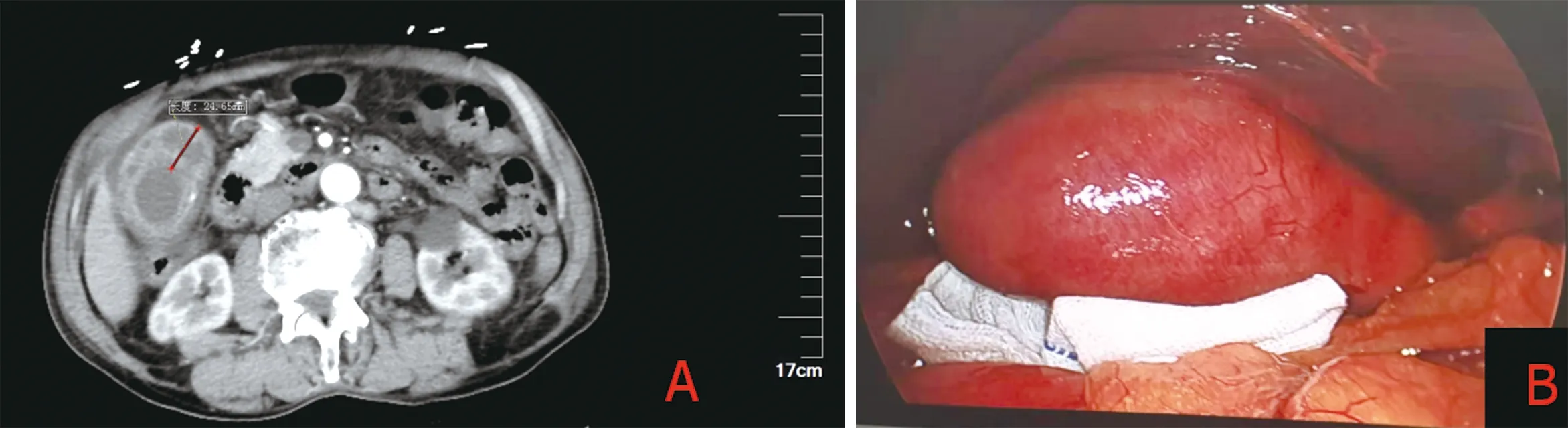
图1 急性胆囊炎(A:CT见胆囊壁增厚约25 mm;B:术中见胆囊增大,充血水肿)

图2 萎缩性胆囊炎(A:B超显示胆囊萎缩,充满结石;B:胆囊结石为阴性结石)
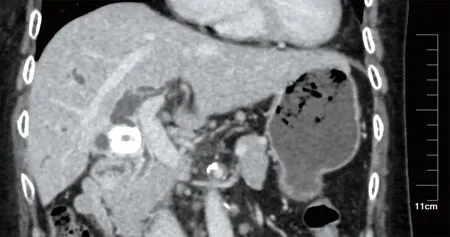
图3 Mirizzi综合征Ⅰ型

图4 患者40年前有胃大部切除史,术中见胆囊完全被包裹

图5 有过反复急性炎症发作的慢性胆囊炎(A:CT见胆囊床形成肝脓肿;B:术中见胆囊内膜部分坏疽)
1.2 手术方法 患者取平卧位,气管插管全麻,常规消毒铺巾。脐下切口穿刺建立CO2气腹,压力维持在12 mmHg。常规于剑突下、右肋缘下做小切口,穿刺3~4枚Trocar进行操作。患者体位改为头高脚低约30°位,左侧卧15°,左手持无损伤操作钳,右手用超声刀或电钩操作。提起胆囊,暴露胆囊三角,超声刀或电钩解剖胆囊三角,分离出胆囊管、胆囊动脉,用可吸收生物夹夹闭胆囊管及胆囊动脉。提起胆囊底,用超声刀或电钩将胆囊自胆囊床上逆行剥离,最终游离胆囊,仅剩胆囊管及胆囊动脉相连,再次确认胆囊管及胆囊动脉后,分别切断胆囊动脉及胆囊管,完整切除胆囊。如果术中胆囊三角炎症粘连严重,难以游离出胆囊动脉及胆囊管或考虑分离过程中容易损伤胆管,可暂不处理胆囊三角,逆行切除胆囊,逆行分离胆囊前可先切开胆囊减压。彻底止血,确认无出血、胆漏后,将胆囊由剑突下切口取出,必要时于胆囊窝处放置腹腔引流管,关闭切口。术中如出现胆道意外损伤,及时中转开腹行胆管修补或胆肠吻合术。
2 结 果
123例(99.2%)完成LC;1例(0.8%)因合并门静脉高压症肝门区曲张血管较多,术中出血量较大且难以控制而中转开腹。术中发现1例右肝管开口于胆囊管;1例左、右肝管汇合部位置较低,而胆囊管汇入肝总管位置也较低;2例右肝动脉变异;4例胆囊床有迷走小胆管;1例存在胆囊十二指肠内瘘;1例存在胆囊胃内瘘。患者均留置腹腔引流管,拔管后出院,无死亡病例。手术时间54~160 min,中位数70.5 min。术中出血量20~500 mL,中位数50 mL,均未输血。术后引流量20~520 mL,中位数50 mL,引流液颜色均为淡红色。术后留置腹腔引流管2~6 d,中位数3 d。术后住院2~10 d,中位数3 d。无术后大出血病例,2例出现胆漏,引流量均不大,经过引流后治愈出院。无胆管横断等不可逆胆道损伤,1例患者术中生物夹同时将胆囊管与肝总管夹闭,术后出现腹痛、黄疸,MRCP发现肝总管中断,行再次手术取出夹闭肝总管的生物夹后恢复良好。1例出现继发性胆总管结石,术后发生腹痛、黄疸,内镜逆行胰胆管造影取石后治愈出院。8例出现剑突下主操作孔切口感染或脂肪液化,经换药后,门诊随访发现切口均愈合。门诊随访1周~2年,28例失访,无并发症发生。
3 讨 论
LC是肝胆外科施行最多的手术之一,手术较简单,但腹腔镜困难胆囊切除术因严重粘连、解剖变异等情况,不论手术难度抑或手术风险均大大增加。施行腹腔镜困难胆囊切除术的前提首先是保证患者的安全,尽量减少或避免手术风险的发生。完善的术前准备尤其影像学检查可进一步了解胆道、血管情况,增加LC的成功率[6],但最重要的还是术中经验与操作。现将我们施行的腹腔镜困难胆囊切除术的经验与体会总结汇报如下。
3.1 最后切断胆囊管及胆囊动脉 传统LC一般先解剖胆囊三角,游离出胆囊管、胆囊动脉后先切断,再顺行剥离胆囊,此法优点是较容易剥离胆囊。单纯采用逆行切除胆囊,由于未处理胆囊动脉,分离胆囊过程中出血可能较多。术中我们采用顺逆结合法方离,最后切断胆囊管、胆囊动脉,即游离出胆囊管、胆囊动脉后,先用生物夹夹闭,暂不切断,逆行剥离胆囊后,再次确认胆囊管、胆囊动脉并切断。此法最大的优势在于最大程度上减少了胆道不可逆损伤的发生。如最后在切断胆囊管、胆囊动脉前,发现之前夹闭的管道有误,可拆除原来夹闭的生物夹,在正确部位施夹。本研究中2例患者术中使用生物夹夹闭右肝管,1例术中用生物夹夹闭右肝动脉,但最终完全游离胆囊后辨认出胆囊管、胆囊动脉,从而避免了右肝管与右肝动脉的损伤;1例患者术中用生物夹夹闭胆囊管、肝总管,但最终切断的是胆囊管,肝总管未损伤,术后发现后再次手术恢复。后切断胆囊管及胆囊动脉法尤其适于有胆道变异的胆囊切除术,可显著降低胆道损伤的发生率。但此法在未切断胆囊管、胆囊动脉时,剥离胆囊不能将胆囊管提起牵引,因此剥离胆囊较传统先切断胆囊管及胆囊动脉法困难,但随着术者技术水平的提高,两种方法的手术时间并无明显差异。
3.2 胆囊部分切除 施行腹腔镜困难胆囊切除时,如胆囊三角粘连较致密,难以分辨出胆囊管、胆囊动脉,此时强行分离胆囊三角,可能造成胆总管或肝总管损伤[7]。对于萎缩性胆囊炎或冰冻胆囊三角的情况,由于胆囊缩小、胆囊壁纤维化、胆囊三角粘连致密使三角结构不清,使得分离粘连时创面渗血较多,间接增加了手术并发症的发生率[8]。Mirizzi综合征的病例,胆囊颈部或胆囊管结石嵌顿,炎症波及肝总管或胆总管,导致胆囊三角粘连不清,甚至胆囊管结构消失。此时可考虑暂不处理胆囊三角,先由胆囊底逆行剥离,将胆囊向胆囊三角游离,如因严重粘连不能分离出胆囊管,可于胆囊壶腹部或胆囊颈部切断胆囊,将胆囊内结石取出。国外学者报道[9],行胆囊部分切除术后结石残留率约为3.1%;胆囊部分切除术中,取出胆囊结石后用胆道镜通过残端向胆囊管方向探查,是减少结石残留的有效方法。缝合胆囊残端前先烧灼胆囊黏膜,可达到与胆囊完整切除相同的效果[10]。切断胆囊时应预留足够的胆囊壁,以便缝合胆囊残端;如预留组织过少,可能导致缝合残端张力过大,发生术后胆漏。胆囊部分切除术中因于腹腔内切开胆囊,尤其化脓性胆囊炎,胆囊内脓性胆汁进入腹腔,导致腹腔污染[11],因此需冲洗干净腹腔,并留置腹腔引流管。
3.3 胆囊切开减压 对于胆囊内结石较小,曾有继发性胆总管结石的病例,术中牵拉胆囊,可能增加胆囊内胆汁压力,从而使胆囊内小结石通过胆囊管挤入胆总管,形成继发性胆总管结石。如果术前考虑可能因术中操作导致继发胆总管结石,为减少继发性胆总管结石的发生,牵拉胆囊前可先切开胆囊底部,吸尽胆囊内胆汁,再进行操作。吸尽胆囊内胆汁,操作过程中胆囊内无较高压力的胆汁,从而可能降低胆囊小结石被挤入胆总管的风险。此方法能否减少术中因操作导致的继发胆总管结石,尚需进一步比较研究加以验证。对于胆囊炎症较重、胆囊壁水肿严重的病例,术中牵拉胆囊较困难,也可先切开胆囊吸尽胆囊内胆汁,以便牵拉胆囊。胆囊结石较大且嵌顿于胆囊颈部或胆囊壶腹部,导致右肝管或肝总管受压时,强行解剖胆囊三角可能较困难,胆道损伤的风险也会增加,此时可先于胆囊壶腹部切开,取出嵌顿的结石,再解剖胆囊三角,以降低分离难度,减少胆道损伤的发生。
3.4 术中分离技巧 术中应遵循“一切分离操作靠近胆囊”的原则。剥离胆囊时应靠近胆囊侧,一方面如遇胆囊床有迷走胆管及变异的胆囊动脉,切断后能留出足够的长度施夹,另一方面可避免损伤肝脏引起的渗血及损伤较浅的中肝静脉属支导致的大出血。本研究中,有多例坏疽性胆囊炎,剥离胆囊较困难,则将部分胆囊壁保留在胆囊床上,用电钩烧灼。术中如有胆囊与胃肠道粘连,应靠近胆囊分离,宁愿损伤胆囊,也应避免胃肠道损伤;本组病例中存在胆囊十二指肠内瘘及胆囊胃内瘘,此时靠近胆囊分离,甚至保留部分胆囊壁,以留出足够的组织修补十二指肠及胃的瘘口。如有上腹部手术史,估计上腹部粘连严重,难以由脐部开始建立气腹及置入腹腔镜时,可先在无手术史的部位如下腹部切开建立气腹,置入腹腔镜探查,分离上腹部粘连后,再根据手术需要更换Trocar位置。
3.5 术中止血的技巧 建立气腹后,开始腹腔内操作前我们习惯常规于胆囊下放置一块小方纱,如遇出血可立即用于压迫止血,如胆囊分破胆汁进入腹腔也可暂时将胆汁局限,同时也可起到保护胃肠道的作用。探查术区后,如考虑术中可能出现大出血,可于肝门预置阻断带,遇难以控制的出血时实施肝门阻断,再处理出血点。合并门静脉高压症,肝门区静脉曲张严重的病例,分离过程中如遇较多渗血,切不可勉强,应及时中转开腹。
3.6 减少术后切口疼痛的术中技巧 对于右肋缘下的副操作孔,建立气腹后切口应尽量远离肋弓。我们于肋缘下约3横指处做切口,手术结束撤除气腹后切口会上移,但不会上移至肋弓以上,术后呼吸对肋缘下切口的牵扯较轻,切口疼痛明显减轻。对于剑突下的主操作孔,如果切口位置下移会影响手术操作,可于切口缝合完毕后在切口下注射长效局麻药如7.5 mg/mL的盐酸罗哌卡因,术后可减轻切口疼痛。
综上所述,在腹腔镜下行困难胆囊切除时,手术难度与风险增加,综合运用最后切断胆囊管与胆囊动脉、胆囊部分切除、胆囊切开减压等策略,可减少胆道损伤的发生,增加手术安全性,适合在各级医院实施推广。
