迷迭香精油对紫色杆菌群体感应抑制实验
2021-09-23施宇黄小芹王文婷杨辉祥潘磊丁弘扬叶镔姬李永裕
施宇,黄小芹,王文婷,杨辉祥,潘磊,丁弘扬,叶镔姬,李永裕
(福建农林大学园艺学院/园艺植物天然产物研究所,福建 福州350002)
植物细菌性病害在全世界范围内有不同程度发生,对农林业生产造成了巨大损失。致病细菌寄主植物众多,主要包括十字花科、茄科、豆科、伞形科和葫芦科等多种蔬菜及多种观赏花卉植物[1,2]。传统的防治方法多采用培育和利用抗病品种及使用化学杀菌剂,但是由于抗病育种的周期长,病原小种的分化速度往往超过品种更新换代的速度;而化学防治细菌病害效果大多不很理想,长期使用对细菌产生选择耐药性,且污染环境[3]。
细菌群体感应(Quorum Sensing,QS)是响应细菌密度变化而调节基因表达的机制,由信号分子合成酶和信号分子接受蛋白组成。研究表明,细菌QS系统调控多种致病因子的表达和分泌,包括色素、生物膜、群集运动、胞外酶、生物发光等[4,5]。紫色杆菌(Chromobacterium violaceum)为β-变形菌属革兰氏阴性菌,具有唯一的QS系统(CviI-CviR型系统)。许多表型特征和代谢产物都与群体感应调控有关,包括:抗生素、氰化物、弹性蛋白酶、各种胞外酶、紫色杆菌素、生物膜形成和群集运动等[6~8]。由于C.violaceum产生肉眼可见的紫色杆菌素,且受QS严格调控[9],因此被作为研究细菌QS系统的模式菌株。紫色杆菌CV 026是源自C.violaceumATCC31532的突变体,缺失了信号分子合成基因cviI,因此需加入外源信号分子才能产生紫色杆菌素,常被用于检测细菌信号分子和筛选群体感应抑制剂(Quorum Sensing Inhibitor,简称QSI)开发以细菌QS为靶标的抗毒力药物,能够在不影响病原菌正常生长的前提下,干扰毒力因子的产生,控制病害,并且使病原菌不易产生耐药性。
植物精油(Essential Oil,精油)取自天然芳香植物,绿色环保,安全无毒,具有广谱的抗菌活性,有效杀菌浓度一般在微摩尔水平,且不同植物精油之间具有协同抗菌作用[10],以植物精油作为QS抑制剂的研究越来越受到人们的关注。前人研究发现阿魏精油、绿薄荷精油、香樟精油、千层金精油等都对细菌QS具有潜在的起始抑制活性[11~14]。迷迭香(Rosmarinus officinalis)为唇形科迷迭香属常绿亚灌木,原产于地中海地区。迷迭香精油是优良的抗氧化剂,同时具有广谱的抗真菌和细菌活性[15~17]。但是迷迭香精油作为细菌QS抑制剂的研究未见报道。本研究以模式菌紫色杆菌Chromobacterium violaceumATCC31532为研究菌株,对迷迭香精油的QS抑制活性进行研究,为迷迭香精油更广泛的利用提供理论参考,对丰富和创新群体感应抑制剂开发具有重要意义。
1 材料与方法
1.1 试验材料及菌株
迷迭香植物材料为1~2年生枝条,产地为上海地区,于-20℃冰箱保存备用。野生型紫色杆菌 ATCC31532(ChromobacteriumviolaceumATCC31532)、紫 色 杆 菌CV 026(Chromobacterium violaceumCV 026)、胡萝卜软腐果胶杆菌胡萝卜亚种(Pectobacterium carotovorumsubsp.Carotovoru)、大 肠 杆 菌ATCC25922(Escherichia coliATCC25922)、铜 绿假 单 胞 菌PAO1(PseudomonasaeruginosaPAO1)、粘质沙雷氏菌MG1(Serratia marcescensMG1)、白色粘质沙雷氏菌(Serratia marcescens)保存于本实验室。CV 026为紫色杆菌信号分子合成酶CviI缺失型的突变体,需加入外源信号分子才能诱导紫色杆菌素的合成。所有细菌1%接种于LB液体培养基中,30℃、150 r·min-1活化13 h。将上述活化后的细菌按照菌液、60%甘油1∶1混合,保存于-80℃冰箱。在使用时,将保存好的菌液按1%接种于LB液体培养基中,30℃、150 r·min-1培养12 h。
1.2 试剂及培养基
卡那霉素(全式金公司,中国北京)、结晶紫(Crystal Violet,CV,Solarbio公司,中国北京)、PBS缓冲液(Solarbio公司,中国北京)。
LB固体和液体培养基:酵母提取物(Yeast Extract)5 g、NaCl 5 g、蛋白胨(Tryptone)10 g,加水定容至1 L,固体培养基中加入琼脂粉20 g·L-1。
Swimming培养基:蛋白胨(Tryptone)1%、NaCl 0.5%、琼脂(Agar)0.3%,加水溶解定容至1 L。
Swarming培养基:蛋白胨(Tryptone)1%、Na-Cl 0.5%、琼脂(Agar)0.5%、D-葡萄糖(D-glucose)0.5%加水溶解定容至1 L。
所有培养基分装后高压锅中121℃灭菌20 min备用。
1.3 主要仪器
电子调温电热套(98-1-B型,天津市泰斯特仪器有限公司,中国),恒温循环器(HX-1050,北京博医康实验仪器有限公司,中国),台式高速冷冻离心机(5811型,Eppendorf公司,德国);光学显微镜(上海上光仪器有限公司,中国),多功能酶标仪(ELISA,iMark,Bio-Bad公司,美国),恒温培养摇床(ZHWY-200B型,上海智城分析仪器有限公司,中国),紫外分光光度计(U-290型,Hitachi公司,日本),生化培养箱(BPMJ-150F型,上海一恒公司,中国)。
1.4 试验方法
1.4.1 迷迭香精油提取
迷迭香精油样品的提取采用水蒸气蒸馏法。取迷迭香枝条(含茎和叶)50~100 g,将植物材料与水按1∶10比例置于精油提取装置中,提取2~3 h,收集精油后离心,吸取油相,计算精油提取率后置于-20℃冰箱保存备用。精油提取率计算方法:
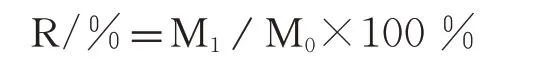
M1为所得精油质量;M0为提取前物料鲜重。
1.4.2 迷迭香精油成分分析
测定迷迭香精油组成成分,可以筛选并分离精油中具有群体感应抑制活性的主效成分,对其进行结构鉴定,为明确迷迭香精油的群体感应抑制机制奠定基础。在色谱瓶中加入1 mL色谱级甲醇和1‰(v/v)精油。洗液瓶中加入色谱级甲醇。使用气相色谱质谱联用仪器GC-MS(GC,Clarus®680;MS,SQ8T;Perkin Elmer Company,America)分析。色谱条件:色谱柱为DB-5MS(30 m×25 mm×0.25μm),载气为高纯氦气,流速为1 mL·min-1,进样口温度为250℃。升温程序为:50℃保持3 min,以3℃·min-1的速率升温至100℃,维持2 min;再以5℃·min-1的速率升温至160℃,维持2 min;最后以50℃·min-1的速率升温至250℃,维持2 min。进样量为1 L,分流比20∶1。质谱条件:电离方式为EI,电子能量70 eV,溶剂延迟1.9 min,离子源温度为230℃,扫描质量范围45~500 m/z。
1.4.3 迷迭香精油的广谱抑菌活性测定
通过平板计数法,计算每毫升菌液所含菌落数(CFU·mL-1),并根据试验结果将细菌浓度控制在同一数量级。具体为:在培养皿中加入20 mL溶化的LB固体培养基,待培养基凝固后,用无菌水将活化12 h的细菌菌液稀释至原浓度的10-5、10-6、10-7、10-8共4个浓度,在培养基表面加入菌液100μL,用三角推将菌液涂抹均匀。在30℃下培养12~24 h。选择适合计数的培养皿进行计数。
采用抑菌圈法测定了不同浓度精油对紫色杆菌ATCC31532、胡萝卜软腐果胶杆菌胡萝卜亚种、大肠杆菌ATCC25922、铜绿假单胞菌PAO1、粘质沙雷氏菌MG1、白色粘质沙雷氏菌的抑菌活性。方法参照S.Andotra等[18]并做一些修改。试验在无菌工作台中进行。将精油用色谱级甲醇稀释为原精油体积分数的25%、12.5%、6.25%、3.125%共4个浓度。将20 mLLB固体培养基加热融化后,冷却到40℃左右加入1%(v/v)菌液浓度为1×108CFU·mL-1的细菌菌液,摇匀后倒板。凝固后,用直径6 mm打孔器在培养基表面打孔,在孔中分别加入30~35μL不同浓度精油稀释液。以同体积1 mg·mL-1卡那霉素(Kanamycin)作为阳性对照;同时设置阴性对照,用色谱级甲醇代替精油稀释液。培养皿在30℃条件下培养12 h,观察并测量透明抑菌圈大小。
1.4.4 MIC测定
迷迭香精油对野生型紫色杆菌(Chromobacterium violaceumATCC31532)的MIC测定用倍半稀释法测定[19]。将精油与甲醇1∶1混合后,再用无菌水稀释到精油原液的80‰、40‰、20‰、10‰、5‰、2.5‰、1.25‰。在2 mL的离心管中加入300 μL的LB液体培养基、300μL精油稀释液、6μL经12 h活化后的紫色杆菌菌液。同时设置以无菌水代替精油的阴性对照。离心管在30℃、150 r·min-1培养24 h。观察混合液的浑浊情况,并在酶标仪中测定混合液OD600值,即为细菌浓度。试验设置3个重复。
1.4.5 生长曲线测定
为了探究亚抑菌浓度(Sub-MIC)下,迷迭香精油对紫色杆菌的生长影响情况,测定在亚抑菌浓度下,紫色杆菌的生长曲线。实验方法参照Wang W等[13]。将精油与甲醇1∶1混合后,用无菌水稀释至1/2MIC、1/4MIC、1/8MIC。在灭菌的250 mL锥形瓶中加入20 mLLB液体培养基、1%(v/v)活化的菌液、6%(v/v)各浓度精油稀释液。同时设置阴性对照,以无菌水代替精油稀释液。在30℃、150 r·min-1条件下培养,在紫外分光光度计中测定混合溶液3、6、9、12、24 h时OD600值,即为细菌浓度。
1.4.6 群集运动测定
群集运动参考Packiavathy IASV等[20]方法。试验方法具体如下:加热Swimming或Swarming固体培养基使其融化,待培养基温度降至约为40℃时加入不同浓度(Sub-MIC,6% v/v)的迷迭香精油,倒入培养皿。待培养基凝固后,将活化12 h的紫色杆菌菌液稀释至终浓度108CFU·mL-1,取5μL加到培养基中央滤纸片中,封口膜封口培养皿。试验设置阴性对照,以等体积的水代替精油。30℃条件下培养12~24 h,观察运动直径并拍照。
1.4.7 紫色杆菌素定量测定
测定迷迭香精油对紫色杆菌所产生的紫色杆菌素含量的影响,可以进一步研究迷迭香精油对紫色杆菌QS的抑制作用。方法参考Khan MSA等[21]。试验在无菌工作台中进行。将迷迭香精油稀释为MIC、1/2MIC、1/4MIC、1/8MIC四个浓度。在试管中加入4 mL的LB液体培养基、6%(v/v)精油、1%活化12 h的紫色杆菌菌液。混合液在30℃条件下培养24 h。吸取1 mL混合液于1.5 mL离心管中,10000 r·min-1、25℃离心5 min,使菌体和紫色杆菌素沉淀至离心管底部。去掉上清液,加入1 mL的二甲基亚砜至离心管中,使用涡旋机震荡离心管,使紫色杆菌素充分溶解于二甲基亚砜中。10000 r·min-1、25℃再次离心5 min,去除菌体及碎屑。取上清液,在紫外分光光度计中测定上清液OD595值,即为紫色杆菌素含量。紫色杆菌素抑制率按下式计算:
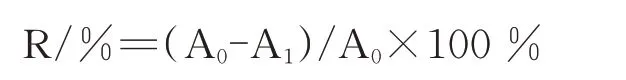
A0为对照组紫色杆菌素含量;A1为处理组紫色杆菌素含量。
1.4.8 生物膜定量测定
通过定量测定紫色杆菌生物膜含量,可以从生物膜的角度进一步确定迷迭香精油对紫色杆菌QS抑制性。参照O’Toole等[22]的方法并做一些修改。试验在无菌工作台中进行。将精油按照上述方法配置成MIC、1/2MIC、1/4MIC、1/8MIC四个浓度的精油稀释液。将活化12 h的紫色杆菌菌液按1%接种于LB液体培养基中。在96孔板中加入200μL含1%菌液的LB液体培养基、6%(v/v)的各浓度精油稀释液,同时试验设置阴性对照,以无菌水代替精油稀释液。每个浓度设置12个重复。将孔板在30℃条件下培养24 h。生物膜定量测定方法如下:将孔板内混合液倒掉,用双蒸水将孔板内混合液冲洗多次,晾干。用250μL 0.1%结晶紫染料对孔板内的生物膜染色15 min。待生物膜充分染色后,用双蒸水将孔板内的染料冲洗多次,晾干。在每孔中加入180μL 30%乙酸溶液,震荡7 min,将生物膜中的结晶紫染料溶解出来。在酶标仪单波长550 nm处测定溶液的吸光度值,即为生物膜量。生物膜抑制率按下式计算:
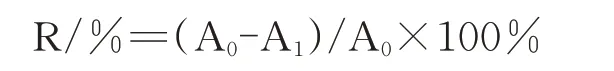
A0为对照组生物膜含量;A1为处理组生物膜含量。
1.4.9 生物膜光学显微镜观察
利用光学显微镜观测生物膜,研究精油在亚抑菌浓度下对紫色杆菌生物膜形态和含量的影响。实验参考Packiavathy IASV的方法[20]并做一些修改。试验在无菌工作台中进行。将精油用5%吐温溶液配制成浓度1/2MIC、1/4MIC、1/8 MIC、1/16MIC的精油稀释液。在6孔板每孔放入规格1 cm×1 cm的盖玻片,加入5 mL的LB液体培养基、1%(v/v)活化12 h的紫色杆菌菌液、6%(sub-MIC,v/v)不同浓度的精油稀释液。试验设置阴性对照,以5%吐温溶液代替精油稀释液。孔板在30℃条件下培养48 h。盖玻片用1%的结晶紫(Crystal Violet)染色,染色方法同上。将盖玻片翻转覆盖于载玻片上,在光学显微镜下观察生物膜分布情况。
1.4.10 已形成生物膜抑制检测
为了确定迷迭香精油对已形成生物膜的破坏能力,进行了生物膜破坏试验,方法参照Packiavathy I A S V等[19]。试验在无菌工作台中进行。在无菌96孔板,每孔加入200μL含有1%活化12 h的紫色杆菌菌液的LB液体培养基,置于30℃条件下静置培养24 h。在超净工作台移除孔中培养液并用无菌水清洗3次去除浮游细胞。随后加入200μL含有不同浓度(Sub-MIC,6% v/v)的迷迭香精油,于30℃条件下静置培养18~24 h,生物膜测量方法参考1.4.8。精油对C.violaceum已形成生物膜的抑制率按下式计算:
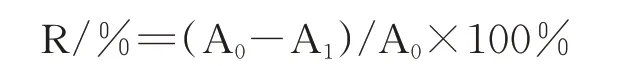
A0为对照组生物膜含量;A1为处理组生物膜含量。
1.4.11 信号分子(AHLs)测定
信号分子提取采用Renée S Blosser等[23]的方法,利用酸化乙酸乙酯(乙酸乙酯含0.1%冰醋酸)从细菌培养上清液中提取AHLs。具体为:在无菌工作台中,50 mL的LB液体培养基中加入1%(v/v)活化12 h紫色杆菌菌液、6%(sub-MIC,v/v)不同浓度的精油,30℃,150 r·min-1条件下培养24 h。将混合液在12000 r·min-1、4℃离心10 min,去除沉淀物。上清液用等体积乙酸乙酯萃取两次,得到100 mL乙酸乙酯萃取液。在旋蒸仪中将萃取液旋蒸至100μL,用同体积色谱甲醇溶解,得到200 μLAHLs提取液,在-20℃冰箱中保存备用。
AHLs定性分析采用CV 026型生物传感器检测,采用Joshi等[24]的方法。将紫色杆菌CV 026活化12 h后,按1%(v/v)接种于加热融化的20 mLLB固体培养基中,倒入培养皿。凝固后,在培养基上打6 mm的孔。将保存的AHLs提取液用色谱甲醇稀释100倍后,取40μL加入孔内。同时设置色谱甲醇代替AHLs提取液的阴性对照。观察孔周围紫色圈的直径并拍照。
1.4.12 数据统计
试验数据采用IBM SPSS Statistics 22数据处理软件进行单因素方差统计分析,采用GraphPad Prism8多重比较,显著性差异P<0.05。每组实验均重复3次或以上。图表制作工具为Excel和GraphPad Prism8。
2 结果与分析
2.1 迷迭香精油主要成分测定
利用水蒸气蒸馏法提取迷迭香枝条挥发油,称量并计算得到精油提取率为0.78%。通过GC-MS气质联用仪,通过气相质谱联用的方法测定得到了迷迭香精油主要成分构成和组分比例,结果如表1所示。由表1可见,主要成分α-蒎烯占比27.89%、桉叶油醇占比18.98%、马鞭草烯醇占比7.56%、龙脑占比5.45%。根据表中物质种类可知,该品种迷迭香枝条精油成分主要为萜烯类化合物,并且以单萜衍生物为主,其次为萜烯类化合物中的倍半萜衍生物和二萜衍生物。得知迷迭香精油成分构成,可以进一步探索迷迭香精油抑制QS的有效成分,为研究QS抑制活性成分在抑制QS的作用机制奠定基础。
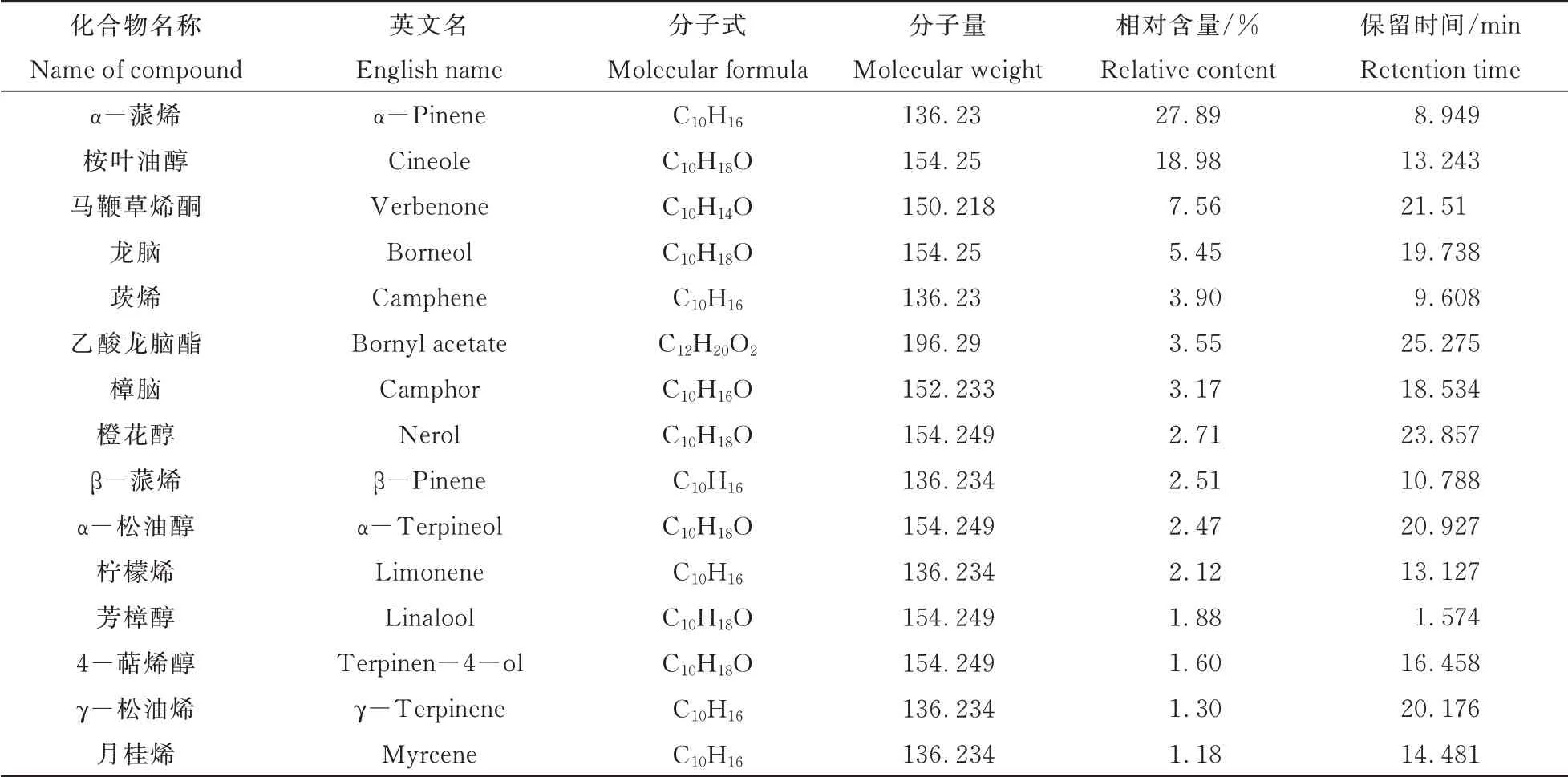
表1 迷迭香精油主要成分测定Table 1 Determination of main components of Sub-MIC Rosmarinusofficinalis EO
2.2 迷迭香精油抑菌广谱性检测
对6种细菌进行平板计数,发现6种细菌活化12 h后细菌浓度均在1×109CFU·mL-1以上,后续试验将菌液细菌浓度控制在1×108CFU·mL-1后使用。随后测定了迷迭香精油对6种细菌的抑菌活性。由图1可见,孔中精油浓度25%~3.125%(v/v)时,随着浓度的提高,精油对6种细菌的抑菌活性随之提高。与阳性对照相比,最高测试浓度25%(v/v)的迷迭香精油抑菌活性强于Kan(1 mg·mL-1)。说明迷迭香精油对于多种细菌具有较强抑菌活性,是一种潜在的抑菌活性物质,可以应用于植物病害防治工作。
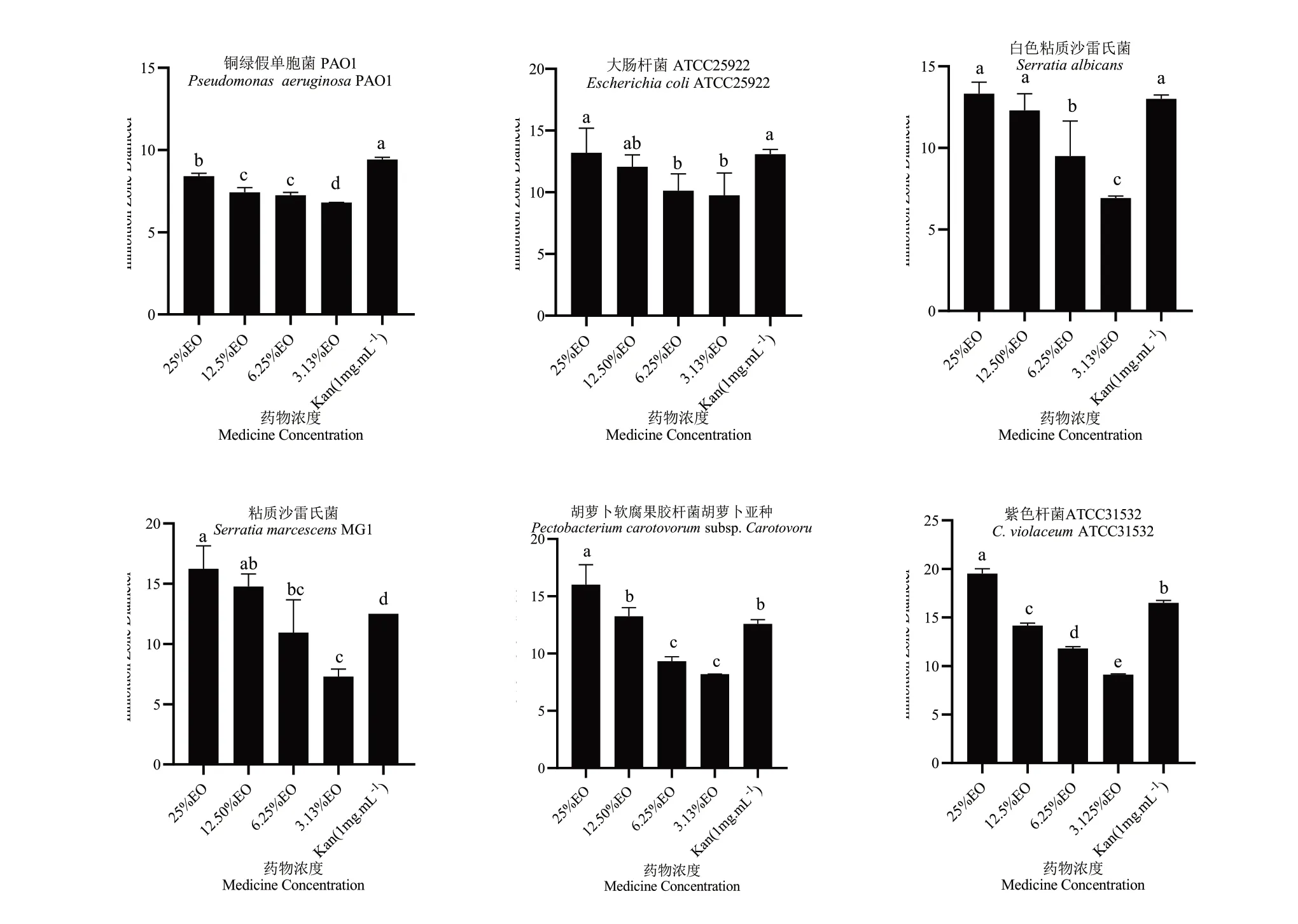
图1 迷迭香精油广谱抑菌活性测定Fig.1 Determination of R.officinalis EO by broad-spectrum antimicrobial activity
2.3 MIC测定
试验采用二倍稀释法,用浓度梯度(80‰、40‰、20‰、10‰、5‰、2.5‰、1.25‰)的精油稀释液对紫色杆菌进行了MIC测定。培养12~24 h后观察并拍照,结果如图2所示,精油浓度在10‰以下的各组混合液有明显的浑浊现象或色素产生,10‰及以上浓度混合液则同样清澈。通过酶标仪测得混合液OD600值证实精油浓度在10‰及以上各组OD600为0.05~0.08之间,基本无菌生长,而精油浓度在10‰以下各组混合液OD600值均在0.85~0.95之间,细菌生长到达平台期。因此测得迷迭香精油对紫色杆菌C.violaceumATCC31532)的MIC为10‰。在后续试验中,以MIC试验结果为参考,精油试验浓度控制在10‰以下,以确保不对细菌生长造成影响。

图2 迷迭香精油对紫色杆菌MIC测定Fig.2 Determination of MIC of R.officinalis EO against C.violaceum
2.4 生长曲线测定
试验测定了Sub-MIC下,紫色杆菌在不同浓度精油处理下24 h的生长曲线,结果如图3所示。因为在各组混合培养液中精油稀释液所占比例为6%(v/v),所以混合液中精油的终浓度远小于MIC。由图4可见,细菌生长对数期(3~9 h),各组的OD600值变化趋势相同,稳定期(12~24 h)每组OD600值基本相同。可以保证在一定处理时间内(12 h以上),Sub-MIC(20‰、10‰、5‰、2.5‰和1.25‰(6% v/v))迷迭香精油不会影响C.violaceum的正常生长。
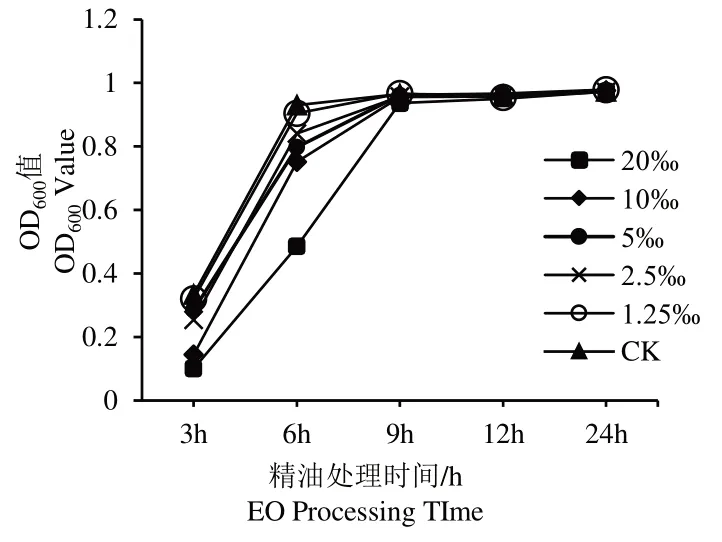
图3 Sub-MIC迷迭香精油处理下C.violaceum的生长曲线Fig.3 Growth curve of C.violaceum under Sub-MIC R.officinalis EO treatment
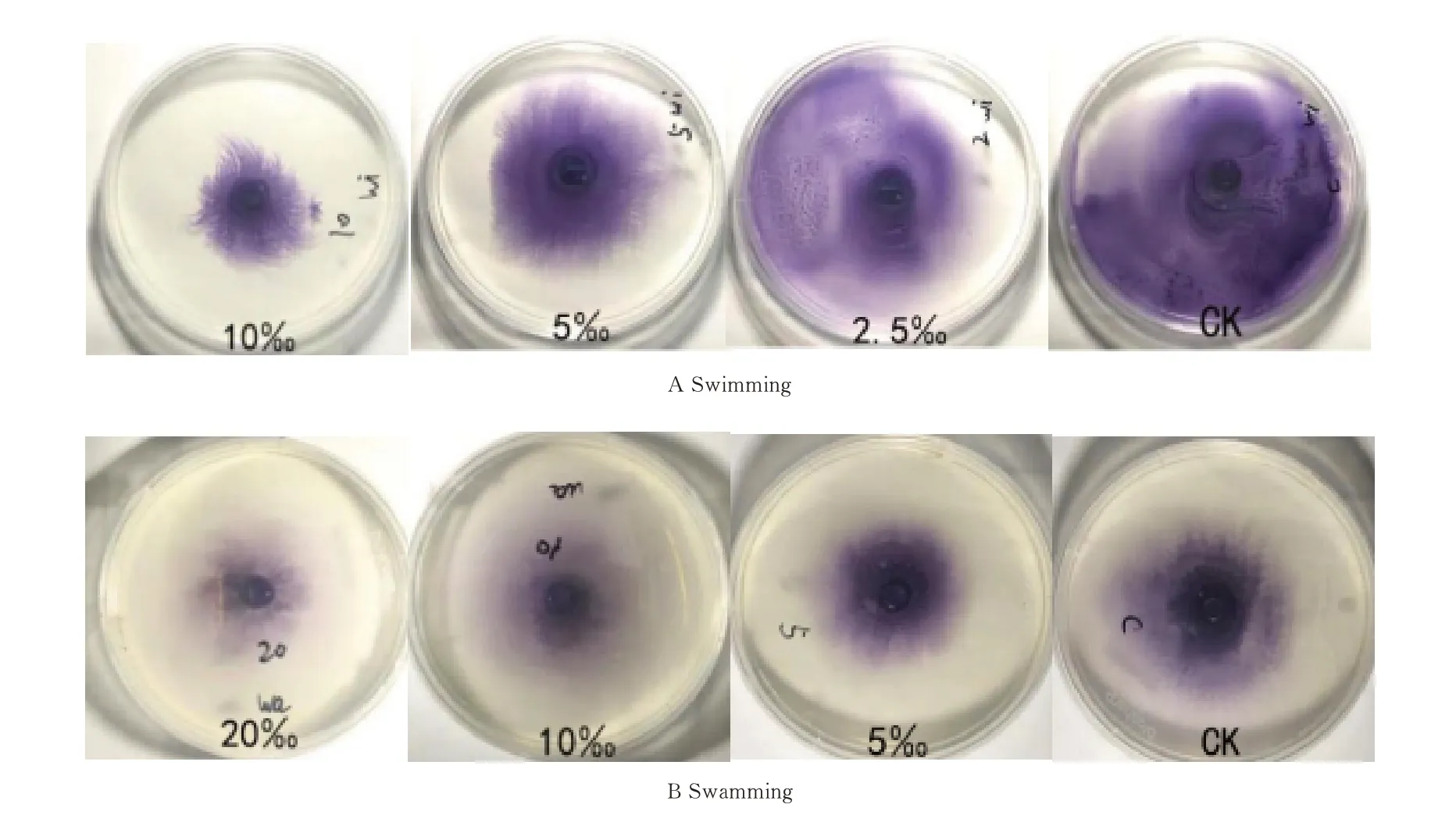
图4 Sub-MIC处理对C.violaceum群集运动的影响Fig.4 Effects of EO on C.violaceum cluster motion under Sub-MIC concentration
2.5 群集运动检测
群集运动是指细菌在培养基表面依赖于鞭毛的由接种点向周围扩散的群体迁移方式,对细菌的定殖和侵染有帮助且受QS参与调控。试验测定了Sub-MIC下,不同浓度精油(10‰、5‰、2.5‰(6% v/v))对C.violaceum群集运动的影响。由图5可以看出,Swimming和Swamming试验中,随着精油浓度提高,两种运动迁移距离随之变小,且与精油浓度呈负相关。说明在不影响细菌正常生长的前提下,迷迭香精油能够抑制C.violaceum群集运动。
2.6 紫色杆菌素定量测定
紫色杆菌素的产生受QS调控,是衡量迷迭香精油对C.violaceumQS抑制性的一个指标。试验 测 定 了Sub-MIC(10‰、5‰、2.5‰、1.25‰(6% v/v))下,迷迭香精油对紫色杆菌素含量的影响。由图5可见,随着精油浓度的提高,紫色杆菌素含量减少,抑制率提高。在10‰浓度的精油处理下,C.violaceum的紫色杆菌素含量减少85%。说明在不影响细菌正常生长情况下,迷迭香精油会对降低C.violaceum紫色杆菌素的含量。
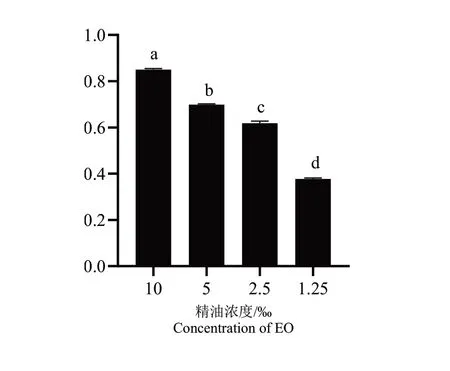
图5 Sub-MIC下迷迭香精油对C.violaceum色素含量的影响Fig.5 Effects of Rosmarinus officinalis EO on pigment content of C.violaceum under Sub-MIC condition
2.7 生物膜定量测定
QS参与调控C.violaceum生物膜形成,所以测定迷迭香精油对C.violaceum生物膜含量的影响。试验测定了迷迭香精油在Sub-MIC(10‰、5‰、2.5‰、1.25‰(6% v/v))下C.violaceum生物膜含量。在酶标仪550 nm处测得混合液的生物膜含量,计算得到抑制率。由图6可见,精油浓度为10‰和5‰时,生物膜抑制率相差不大且明显大于其他两组,抑制率分别为44%和39%,说明在不影响细菌生长条件下,迷迭香精油会对紫色杆菌的生物膜含量造成影响。但是,生物膜的减少除了精油抑制了紫色杆菌QS系统的可能,是否有精油降解了已经形成的生物膜的因素,有待进一步试验研究。
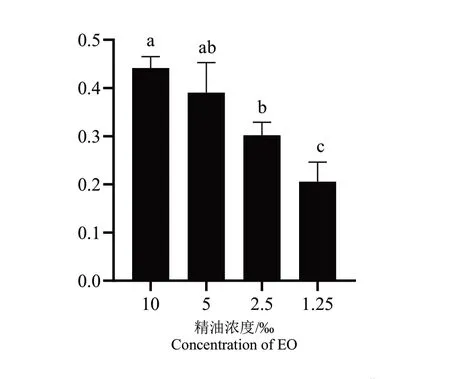
图6 Sub-MIC迷迭香精油对C.violaceum生物膜含量的影响Fig.6 Effects of EO at sub-MIC concentration on C.violaceum biofilm content
2.8 生物膜光学显微镜观测
对生物膜进行光学显微镜观察,可以更加直观的看到迷迭香精油对于C.violaceum生物膜结构和分布的影响。将经Sub-MIC(20‰、10‰、5‰、2.5‰、1.25‰(6% v/v))精油处理过,附着有C.violaceum生物膜的盖玻片染色后放在光学显微镜下观察。在10×物镜下观察,结果如图7所示。与对照相比,精油处理过的生物膜含量降低,且生物膜含量与精油浓度呈反比;结构松散,聚集性降低,且松散程度与精油浓度呈正比。说明迷迭香精油能降低C.violaceum生物膜含量,并破坏生物膜稳定结构。
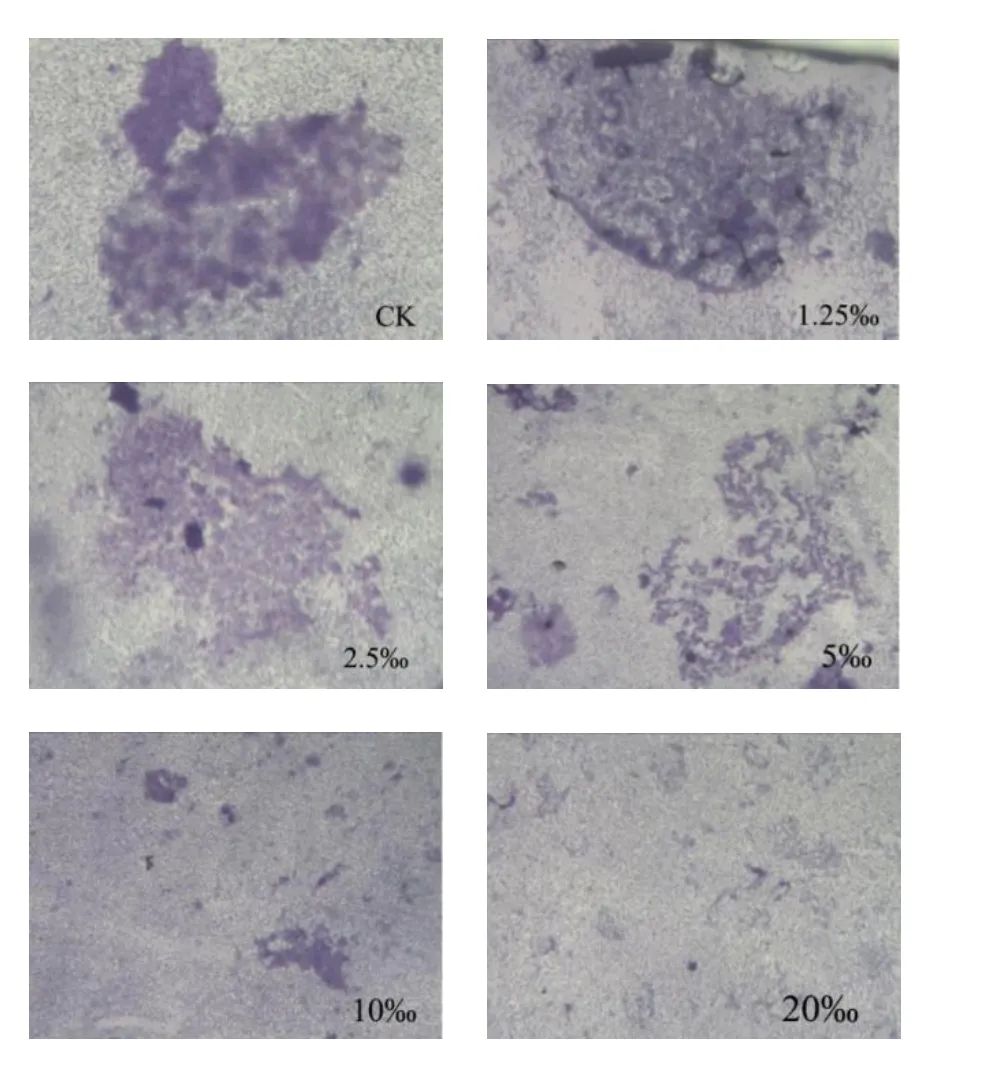
图7 光学显微镜观测Sub-MIC下,迷迭香精油对C.violaceum生物膜定殖的影响Fig.7 Optical microscope observation of the effect of Rosmarinus officinalis EO on C.violaceum biofilm colonization under Sub-MIC condition
2.9 已形成生物膜降解检测
为探究迷迭香精油降低紫色杆菌生物膜含量的原因,本文还检测了迷迭香精油对已形成生物膜的影响。由图8可以看出,迷迭香精油具有明显的清除生物膜的作用,Sub-MIC(20‰、10‰、5‰、2.5‰(6% v/v))精油处理下,精油对C.violaceum生物膜的清除率为64.0%~50.3%,且清除能力与精油处理浓度成正比。以上结果表明迷迭香精油除可能抑制生物膜形成外,还能够清除C.violaceum已形成生物膜。
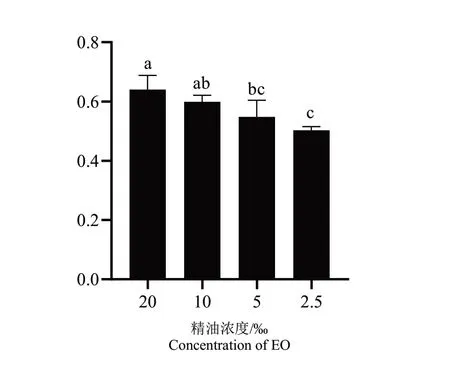
图8 Sub-MIC下,迷迭香精油对C.violaceum已形成生物膜含量的影响Fig.8 Effects of Rosmarinus officinalis EO on the content of C.violaceum biofilm under Sub-MIC condition
2.10 信号分子(AHLs)生物检测
C.violaceumQS类型是CviI/CviR,由CviI(自诱导剂合成酶)和CviR(转录受体蛋白)组成。CviI合成信号分子C6-HSL,该物质对于QS监测群体密度、激活下游基因(包括一些毒力因子)表达必不可少。因此,有必要测定迷迭香精油对C6-HSL含 量 的 影 响。在Sub-MIC(10‰、2.5‰(6% v/v))精油处理下,各平板紫色杆菌素圈直径大小反应了AHLs含量。如图9所示,与CK无精油处理相比,在精油处理后,平板中AHLs含量减少,AHLs含量与精油浓度呈反比。说明精油会降 低C.violaceumQS的AHLs含量。
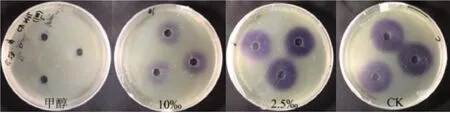
图9 利用紫色杆菌CV 026检测Sub-MIC下,迷迭香EO对C.violaceum AHL含量的影响Fig.9 The effects of Rosmarinusofficinalis EO on the content of C.violaceum AHL under Sub-MIC condition was detected by C.violaceum CV 026
3 讨论
本研究所使用迷迭香产自上海,GC-MS测得主成分为α-蒎烯和桉叶油醇,占比分别27.89%和18.98%,这与潘岩等[25]测得贵州产迷迭香成分组成相似。植物精油作为一种广谱抑菌剂,具有高效低毒的特点,不同精油之间具有协同作用[26]。Prabuseenivasan等[27]研究了21种植物精油在不同浓度下对6种细菌的抗菌活性,其中1/6、1/11(v/v)的迷迭香精油对大肠杆菌的抑菌圈直径达到15.1 mm和9.1 mm,与本实验结果相似。程伟贤等[28]测定了从迷迭香分离得到的迷迭香酚和鼠尾草酚的抗菌活性,结果发现2种物质对大肠杆菌抑菌活性明显强于铜绿假单胞菌,这与本实验测定结果相同。本实验测定了迷迭香精油对6种细菌的抑制活性,均表现出明显的抑制效果,表明迷迭香具有广谱抑菌活性,与以上研究结果相似。
群体感应是基于一定群体数量的作用机制,在细菌数量达到临界值才会起作用。据吴红等报道,在细菌浓度达到107CFU·mL-1以上,信号分子的浓度就会超过一个阈值水平(大约10 nmol·L-1),才会引起群体感应系统的调控作用[29]。本研究使用细菌经活化后,细菌浓度均在109CFU·mL-1以上,符合研究要求。紫色杆菌素是C.violaceum重要的次生代谢产物,它的产生和分泌是由群体感应系统调控的。有研究表明:在不影响细菌正常生长的情况下,能够明显降低C.violaceum紫色杆菌素含量的化合物可被视为潜在的群体感应抑制剂[30,31]。试验测定结果显示迷迭香精油能降低紫色杆菌素含量,这与王锦利等[11]对阿魏精油影响紫色杆菌群体感应的研究结果相似。生物膜作为粘附在宿主表面的由多糖、蛋白质和核酸包裹着的微生物群体,在细菌致病性和耐药性形成方面扮演了重要的角色,生物膜一旦形成,在生物膜中微生物的抗性会增至10~1000倍,此时,微生物的耐药性变大并难以清除[32]。试验测定了精油对C.violaceum生物膜的影响,发现生物膜的含量和聚集形态都发生变化,这与王文婷等[13]对千层金精油抑制紫色杆菌群体感应的研究结果相似。
细菌的群集运动有Swimming和Swamming,一般来说,基于鞭毛的群集运动被认为是形成成熟生物膜结构的重要因子,同时还有助于增强细菌的QS行为[33]。通过试验验证,发现迷迭香精油对C.violaceum和P.c.c.的群集运动都有显著抑制效果,这与王文婷等[14]对香樟精油抑制紫色杆菌群体感应的研究结果相似。QS依靠信号分子浓度来感知细菌浓度,并且通过信号分子结合受体蛋白,激活毒力因子的表达。试验测定迷迭香精油会降低C.violaceum产生的AHLs含量,说明迷迭香精油对群体感应系统存在QS淬灭能力,这与王文婷等[13]测定千层金精油能够减少C.violaceum的AHLs含量结果相似,并且该研究通过GC-MS定量检测发现,减少的AHLs为C6-HSL。
植物精油影响细菌群体感应系统的方式有3种:(1)利用信号分子类似物,与信号分子竞争受体结合蛋白位点。使下游基因无法被激活[34];(2)利用信号分子合成底物类似物或者抑制信号分子合成酶活性。使信号分子合成酶无法或者错误的合成信号分子,从而抑制了群体感应调控毒力因子;(3)降解信号分子。信号分子数量在阈值以下,就不会和转录受体蛋白结合,从而无法激活下游毒力因子表达[35]。本研究结果显示,精油处理后AHL含量降低,据此推断迷迭香精油抑制群体感应系统的作用机制可能是抑制信号分子合成酶活性、充当AHL的底物或者降解信号分子,又因为AHL信号分子合成底物为酰基-酰基载体蛋白(Acy1.ACP)和S-腺 苷 甲 硫 氨 酸(SAM)[35],SAM属于氨基酸类物质,而本研究测定迷迭香精油成分几乎没有这类物质,所以推测精油可能抑制了信号分子合成酶活性的活性,这需要进一步的研究验证。
4 结论
综上所述,本文在测定迷迭香精油的成分组成及抑菌活性的基础上,检测了迷迭香精油对C.violaceumQS抑制活性,对QS参与调控的多种致病因子检测,并对QS的AHLs含量做生物检测,结果表明,在亚抑菌浓度下,迷迭香精油会对C.violaceum的群体感应系统及其所参与调控的相关致病因子产生抑制作用,证明迷迭香精油具有QS抑制活性,可以作为一种以群体感应为靶标的新型农药继续深入研究。下一步试验会以迷迭香精油作为QS抑制剂,研究迷迭香精油对植物细菌性病害致病菌QS及相关毒力因子的抑制活性,并找出迷迭香精油中,起QS抑制作用的主效成分,为探究迷迭香精油抑制细菌QS的作用机制奠定基础。
