番红花小球茎乙醇提取物抗真菌活性分析
2021-09-23王德富张鹏王玉芬杜江牛颜冰
王德富,张鹏,王玉芬,杜江,牛颜冰
(山西农业大学 生命科学学院,山西 太谷030801)
番红花(Crocus SativusL.)为鸢尾科(Iridaceae)番红花属(Crocus)植物,以其干燥三叉柱头入药[1~4],具有活血化瘀、凉血解毒、健胃等功效[5~8]。目前,番红花主要种植在亚洲和欧洲地中海地区,其中伊朗种植面积最大,其产量占世界总产量的85%以上[9]。中国、法国、美国、英国和葡萄牙等国也有较小规模种植[10~12]。在我国,番红花主要采用室内采花、大田繁殖球茎的方式进行栽培[13,14]。而在长期的营养繁殖过程中,球茎越种越小,小球茎开花少且花小,有的甚至不开花,失去药用价值而废弃[15,16]。目前,有关番红花的研究大多集中在药用部位柱头上[17,18],也有研究者对其花瓣、雄蕊、花粉和球茎等非药用部位的化学成分进行研究,且发现这些非药用部位含有黄酮、山奈酚、槲皮素等抗菌和抗氧化活性成分[12,19,20],而对小球茎提取物的抑菌性能研究较少。利用西红花非药用部位较好的抗菌和抗氧化性能,将其开发成为一种天然添加剂应用到食品防腐等领域,不仅为天然防腐剂的开发提供丰富原料,而且能变废为宝,扩大番红花资源综合利用率,对实际生产具有重要经济价值和现实意义。
现今,食源性病菌引起的食品污染和腐败问题极为普遍,且其防治以添加化学防腐剂为主,对人体健康造成严重威胁,而源于植物的天然防腐剂具有无毒无害等优点,已成为人们研究的热点[21~23]。为了扩大番红花资源综合利用率,本试验以番红花小球茎(<8 g)为研究对象,以食品中常见的6种真菌为供试菌种进行抑菌试验,并对球茎的有效抑菌成分进行初步分离,以期为番红花小球茎抑菌活性成分的纯化研究奠定基础,为番红花小球茎作为食品天然防腐剂的开发利用提供科学依据。
1 材料与方法
1.1 材料
番红花小球茎(<8 g)采自山西农业大学生命科学学院番红花种植基地;酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Asppergillus niger)、桔青霉(Penicillium citrinum)、黑根霉(Rhizopus nigricans)、米曲霉(Aspergillus oryzae)和绿色木霉(Trichoderma viride)由山西农业大学食品学院微生物实验室提供。
1.2 方法
1.2.1 小球茎处理
将洗净的番红花小球茎置50℃烘干,粉碎机粉碎。称取50 g球茎粉末加入500 mL 95%乙醇中,室温下磁力搅拌24 h后抽滤,滤渣重复提取3次,将所得滤液合并,于旋转蒸发仪(50℃、0.1 MPa)浓缩至深棕色膏状物,4℃冰箱中保存备用。
1.2.2 供试药剂配制
用无菌水溶解球茎乙醇提取物,配制成100 mg·mL-1的待测液,再用无菌水稀释成10 mg·mL-1,采用二倍递减稀释法将待测液稀释成50、25、12.5和6.25 mg·mL-1的药液,4℃保存备用。
1.2.3 菌种活化
在无菌条件下将供试菌接入马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)斜面培养基上,于28℃培养24 h,备用。
1.2.4 含药培养基制备
准确吸取1 mL 100、50、25、12.5和6.25 mg·mL-1的提取液,随即加入9 mL熔化的PDA培养基(45~50℃),混合均匀制成平板,使提取物的最终浓度分别为10、5、2.5、1.25和0.625 mg·mL-1。培养基冷却凝固后即为含药培养基,以加入相同体积的无菌水做对照。
1.2.5 病原菌接种
用接种针将活化好的供试菌接种到5种不同浓度含药培养基中央,每个处理重复3次,于28℃培养48 h后测量菌落直径大小,每个菌落用十字交叉法测量2次,取平均值,计算公式如下:

以提取液浓度的对数作为变量x,抑菌率转换成几率值作为变量y,用Execl回归统计法得到毒力回归方程,并计算其半最大效应浓度(concentration for 50% of maximal effect,EC50)。
1.2.6 小球茎提取物液液萃取分离
称取20 g球茎提取物溶于200 mL无菌水中,然后装入500 mL分液漏斗中。先用200 mL石油醚萃取3次,合并有机相,减压浓缩制得石油醚组分;水相继续用200 mL乙酸乙酯萃取3次,合并有机相,减压浓缩制得乙酸乙酯组分;水相最后再用正丁醇萃取3次,每次200 mL,合并有机相,减压浓缩制得正丁醇组分,各分离组分保存4℃冰箱,备用。
1.2.7 酚酸类化合物成分检测
分别配置甲液(2%三氯化铁水溶液)和乙液(1%铁氰化钾水溶液),将甲乙溶液等体积混合后,取1~2滴加入1 mL提取液中,若溶液反应呈蓝色或墨绿色,证明提取液中可能含有酚酸类化合物。
1.2.8 硅胶柱层析分离活性组分
取1 g乙酸乙酯萃取膏状物用石油醚溶解后加入预处理的层析柱中,并在样品上方加适量脱脂棉。以石油醚∶乙醇为洗脱液,通过调节各组分的配比,逐步增大极性分步洗脱,流速为每秒3~4滴。所得各流分(每份约50 mL)经薄层色谱(Thin Layer Chromatography,TLC)指导合并,各流分减压浓缩后获得膏状提取物,4℃保存备用。
1.3 数据统计分析
利用Excel和SPSS统计软件对数据进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析检验显著性,以P<0.05表示差异显著。
2 结果与分析
2.1 番红花小球茎乙醇提取物抑菌活性分析
由图1、图2可见,球茎提取物对黑曲霉和黑根霉的抑制效果最好,在0.625 mg·mL-1时就分别达到了81.34%和75.65%,而同浓度提取物对米曲霉、桔青霉、绿色木霉和酿酒酵母的抑制率分别为24.86%、14.76%、31.84%和35.66%;当提取物浓度增加到1.25 mg·mL-1时,除对米曲霉的抑制效果显著增强外,对其它5种供试真菌的抑制作用增强不显著;当浓度升到2.5 mg·mL-1以上后,除酿酒酵母外,提取物对供试真菌的抑制作用随浓度的提高而显著增加(P<0.05),且10 mg·mL-1的提取物能完全抑制黑曲霉、黑根霉和酿酒酵母的生长,表明提取物浓度越高,对供试真菌的抑制作用越强。

图1 番红花小球茎乙醇提取物抗真菌活性分析Fig.1 Antifungal activity analysis of ethanol extracts from saffron small corm
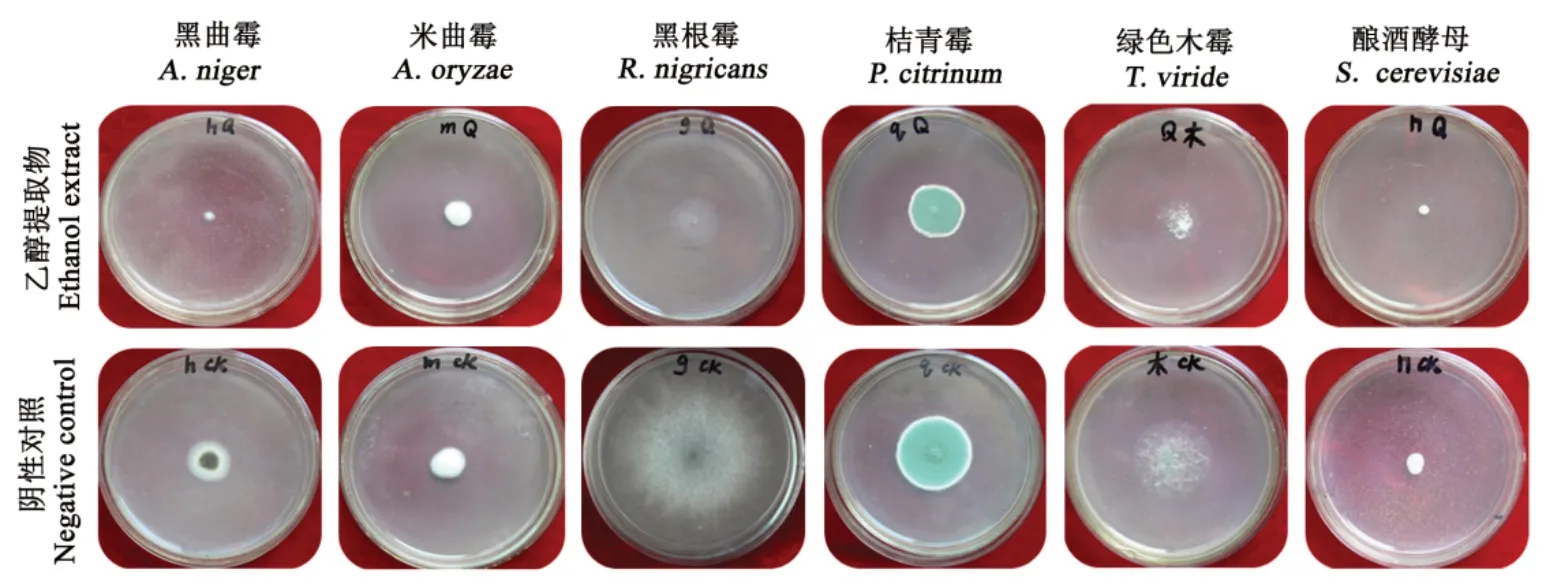
图2 番红花小球茎乙醇提取物(0.625 mg·mL-1浓度)抗真菌效果Fig.2 Antifungal effects of ethanol extracts from saffron small corm
相关性分析发现(表1),球茎提取物浓度的对数与6种供试真菌的菌丝生长抑制率几率值之间均表现为线性相关,且相关系数均差异显著(P<0.05)。从毒力回归方程可以看出,球茎提取物对黑根霉和黑曲霉的EC50值相对较小,分别为0.4412和0.3513 mg·mL-1,说明球茎提取物对黑曲霉和黑根霉的抑制作用最强,而对桔青霉和米曲霉的抑制作用较弱,其EC50值分别为1.5878和1.5624 mg·mL-1。

表1 番红花小球茎乙醇提取物对供试真菌的毒力回归方程及EC50Table 1 The toxicity regression equation and EC50 of saffron corm ethanol extracts to the six tested fungi
提取液对供试真菌的抑菌效果的方差分析表明(表2),球茎提取物不同浓度之间对供试真菌的抑制效果均差异显著(P<0.05)。基于上述抑菌实验结果,后续试验将以黑曲霉和黑根霉为主要供试菌进行活性组分的初步分离研究。

表2 番红花小球茎乙醇提取物抗真菌活性方差分析Table 2 ANOVA analysis on antifungal activity of ethanol extracts from saffron small corm
2.2 番红花小球茎提取物最佳抑菌活性萃取组分确定
采用三氯化铁-铁氰化钾试验对提取液进行检测,当加入1滴等体积的三氯化铁-铁氰化钾混合液后,提取液呈墨绿色(图3),说明其主要化学成分可能为酚酸类化合物。

图3 番红花小球茎乙醇提取物化学成分预试实验结果Fig.3 Preliminary results of chemical components for ethanol extracts from saffron small corm
为确定番红花小球茎提取物的最佳抑菌活性萃取组分,采用石油醚、乙酸乙酯和正丁醇3种不同极性的有机溶剂对小球茎提取物进行萃取分离,分别得到石油醚、乙酸乙酯、正丁醇和水4个萃取相。各萃取相对黑曲霉和黑根霉的抗菌效果见图4。乙酸乙酯萃取相对黑曲霉和黑根霉的抑制效果最好,分别达到了89.13%和74.36%,而石油醚萃取相对黑曲霉和黑根霉的抑制率分别为20.95%和37.81%,正丁醇萃取相为20.97%和13.46%,均低于乙酸乙酯萃取相,水相抑制效果最差,分别为7.47%和7.33%。
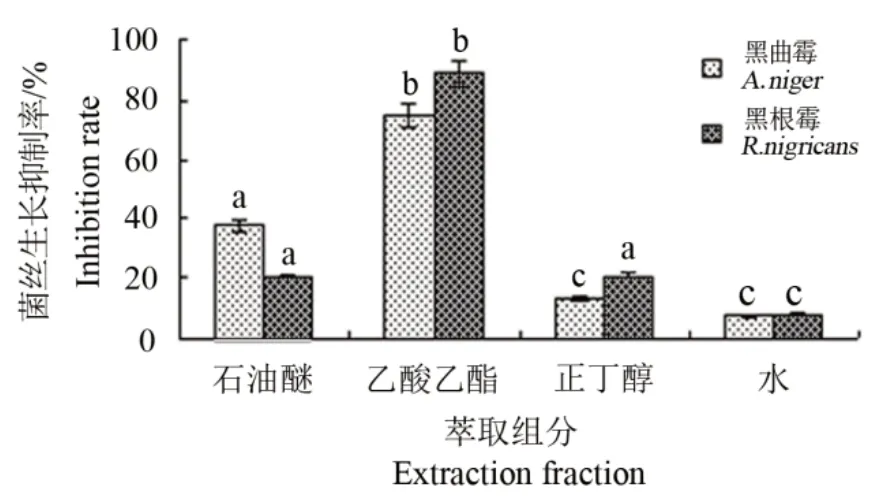
图4 番红花小球茎乙醇提取物不同萃取组分抗真菌活性分析Fig.4 Antifungal activity analysis of saffron corm ethanol extracts with different extraction fractions
不同萃取相对黑根霉和黑曲霉抑制活性的方差分析结果表明(表3),乙酸乙酯萃取相对黑曲霉和黑根霉的抑制率均与其它3种萃取相差异显著(P<0.05),因此确定小球茎提取物乙酸乙酯萃取相含有最佳抑菌组分。

表3 番红花小球茎乙醇提取物不同萃取组分抗真菌活性方差分析Table 3 ANOVA analysis on antifungal activity of saffron corme thanol extracts with different extraction fractions
2.3 番红花小球茎乙酸乙酯萃取相最佳抑菌活性流分确定
将球茎提取物乙酸乙酯萃取相通过硅胶柱层析和TLC分离获得9种流分(Fraction,F),以黑曲霉和黑根霉为供试菌种,分别测定了9种流分的抑菌活性。由图5可见,9种流分中,F6对黑曲霉的抑制效果最好(90.95%),与F1、F5、F8、F9差异显著(P<0.05)。F6对黑根霉的抑制率最高(93.83%),与F2、F4、F5、F7、F8差异显著(P<0.05)。
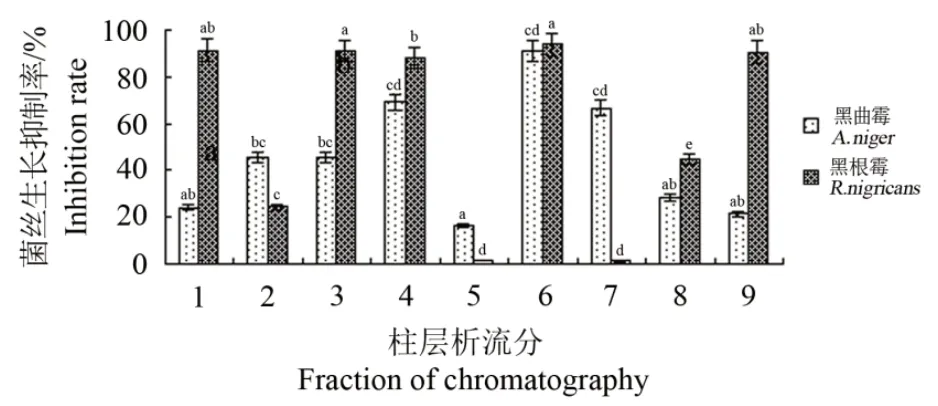
图5 番红花小球茎提取物不同流分抗真菌活性分析Fig.5 Antifungal activity of the saffron corm ethanol extracts with different fractions
不同流分抑菌活性的方差分析结果表明(表4),不同流分对黑曲霉和黑根霉的抑菌活性差异显著(P<0.05)。F6的抑菌效果最好,说明F6为番红花小球茎提取物的最佳抑菌活性组分。

表4 番红花小球茎乙酸乙酯萃取组分不同流分的抑菌效果方差分析Table 4 ANOVA analysis on antifungal activity of the saffron corm ethanol extracts with different fractions
3 讨论
番红花球茎中含有山奈酚和飞燕草苷等活性物质,具有较好的抗菌和抗氧化能力,这些非药用部位可用于食品、制药和化妆品等高端日用品的生产,具有极高的开发利用价值[12,24]。目前番红花栽培中产生的不能继续当作种栽的小球茎(<8 g)往往直接作为农业残留物来处理,尚缺乏合理的开发与利用途径。鉴于此,本研究以番红花小球茎(<8 g)为原料,开展其乙醇提取物抗真菌活性分析,结果发现番红花小球茎乙醇提取物对黑根霉和黑曲霉具有显著抑制作用,其EC50分别为0.3513和0.4412 mg·mL-1,且进一步通过有机溶剂萃取和硅胶柱层析分离得到9个分级产物,其中F6对黑曲霉和黑根霉的抑制效果最好,分别达到了90.95%和93.83%。因此,确定F6为番红花小球茎乙醇提取物的最佳有效抑菌组分,但其具体抑菌机理尚不清楚。已有研究表明,天然产物抑菌主要通过降解细胞壁、损伤质膜结构、抑制膜蛋白合成、引起胞内物质渗漏、降低胞内代谢活动相关酶活力等方式,引起机体代谢紊乱,导致菌体死亡而发挥抑菌作用[25~27]。而本研究得到的番红花小球茎乙醇提取物具体是通过上述其中的一条途径或多条途径来有效抑制真菌生长,需进一步验证。陈娜等[28]研究表明西红花非药用部位富含黄酮、酚酸、皂苷和多糖等化合物,而本研究通过三氯化铁-铁氰化钾试验初步测定番红花小球茎乙醇提取液中含有酚酸类化合物,但其具体以那种酚酸种类和分子结构存在还需进一步鉴定。
研究表明许多植物提取物都具有抗菌活性,但一种植物中有效的抗菌成分不可能抑制所有微生物[29]。如果实验中选择了不合适的待测试微生物种类,则含有高活性抗菌成分的植物将被忽视。因此,实验中必须以从腐败产品中直接分离出来的微生物为测试对象,针对这类微生物开展源于植物提取物的潜在抗菌活性研究,从延长产品货架期的角度来看,这样的研究结果或发现更具针对性和应用价值。本研究中选择的待测微生物大部分为食物腐败类微生物(黑曲霉、桔青霉、黑根霉、米曲霉、绿色木霉),且抗菌活性分析表明,番红花小球茎乙醇提取物对几种典型食源性真菌均有潜在的抑制作用,特别是对黑根霉和黑曲霉的抑制作用最为显著。另有研究表明,一些植物源化合物既有一定的抗细菌活性也有一定的抗真菌活性[30~33],而本研究仅揭示了番红花小球茎乙醇提取物具有潜在的抗真菌能力,其是否具有抗细菌活性还需进一步实验验证。目前,已开展了大量的植物提取物体外抗菌活性研究,但关于食品体内的研究很少,可能是因为植物提取物在食品内产生的抑制作用没有体外效果明显。而这种抑菌有效性降低可能是大多数研究中都使用了粗提物,因粗提物中含有糖苷形式的类黄酮,其中的糖会降低对某些菌体的有效性[34,35]。本研究通过体外实验也获得了较好的抗真菌活性结果,但将其运用于食品添加剂领域,其适宜添加量的确定以及是否对食品感官特性存在潜在不利影响,还需开展更多的实验研究来证实番红花提取物在未来食品中作为天然防腐剂的可行性。
4 结论
番红花小球茎乙醇提取物对6种供试真菌均有一定抑制作用,其中对黑根霉和黑曲霉的抑制作用最为显著(P<0.05),其EC50分别为0.3513 mg·mL-1和0.4412 mg·mL-1,且随着提取物浓度的增高,其抑菌效果也在增强,当提取物浓度为10 mg·mL-1时,对黑曲霉和黑根霉的抑菌率达到100%;此乙醇粗提物的乙酸乙酯萃取组分对黑曲霉和黑根霉的抑制效果最好,其抑菌率分别达到了89.13%和74.36%,且该萃取组分经硅胶柱层析分离获得9个分级产物,其中F6对黑曲霉和黑根霉的抑菌率达90.95%和93.83%,说明F6为番红花小球茎提取物的最佳有效抑菌组分。
